2.3 分子的结构与物质的性质(第3课时 物质溶解性和分子手性)(共21张PPT)-【核心素养目标】2023-2024学年高二化学同步精品课件(人教版2019选择性必修2)
文档属性
| 名称 | 2.3 分子的结构与物质的性质(第3课时 物质溶解性和分子手性)(共21张PPT)-【核心素养目标】2023-2024学年高二化学同步精品课件(人教版2019选择性必修2) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 13:14:27 | ||
图片预览





文档简介
(共21张PPT)
第三节 分子的结构与物质的性质
第3课时 物质溶解性和分子手性
人教版选择性必修2
榆次一中 李金虎
学习目标
1.从分子结构的角度,认识“相似相溶”规律。
2.了解“手性分子”在生命科学等方面的应用。
学习目标
通过研究“手性分子”在生命科学等方面的应用,培养学生“科学精神和社会责任”的学科素养。
素养目标
情境引入
青蒿素提取
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
思考:为什么需要用乙醚来提取青蒿素,用水不可以呢?
情境引入
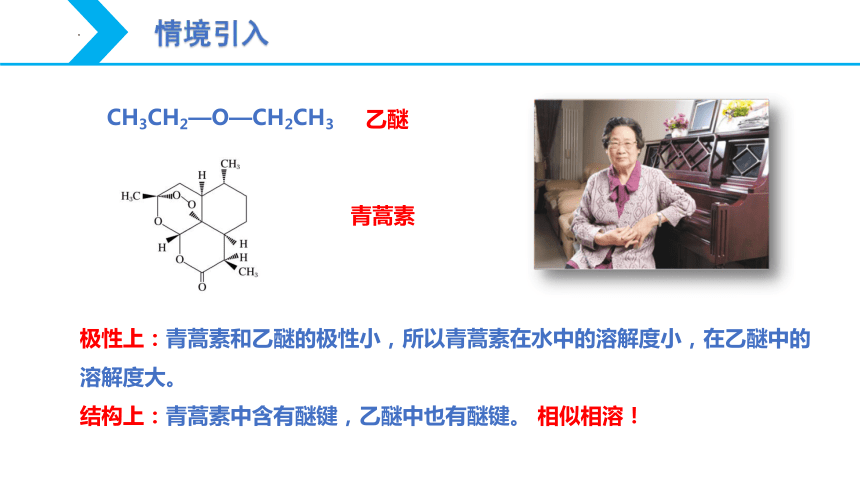
CH3CH2—O—CH2CH3
乙醚
青蒿素
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
教学过程
一、物质溶解性
思考:为什么蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水。
1.分子的极性
蔗糖、氨、水是极性分子,而萘、碘、四氯化碳是非极性分子。通过对许多实验的观察和研究,人们得出了一个经验性的“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
水是极性溶剂,根据“相似相溶”,极性溶质比非极性溶质在水中的溶解度大。
教学过程
2.分子的结构
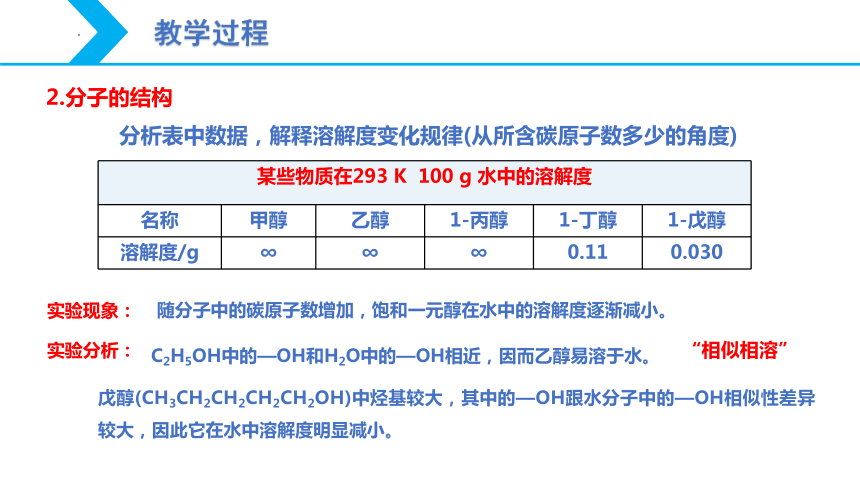
分析表中数据,解释溶解度变化规律(从所含碳原子数多少的角度)
某些物质在293 K 100 g 水中的溶解度 名称 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
实验现象:
实验分析:
C2H5OH中的—OH和H2O中的—OH相近,因而乙醇易溶于水。
戊醇(CH3CH2CH2CH2CH2OH)中烃基较大,其中的—OH跟水分子中的—OH相似性差异较大,因此它在水中溶解度明显减小。
随分子中的碳原子数增加,饱和一元醇在水中的溶解度逐渐减小。
“相似相溶”
教学过程
1、比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
NH3分子和H2O分子都是极性分子,CH4是非极性分子,根据相似相溶,NH3易溶于水,CH4难溶于水中
2、日常生活中:为什么用有机溶剂溶解油漆,而不用水?
思考与讨论:
水分子的极性大,油漆极性小更易溶于极性小的乙酸乙酯中
教学过程
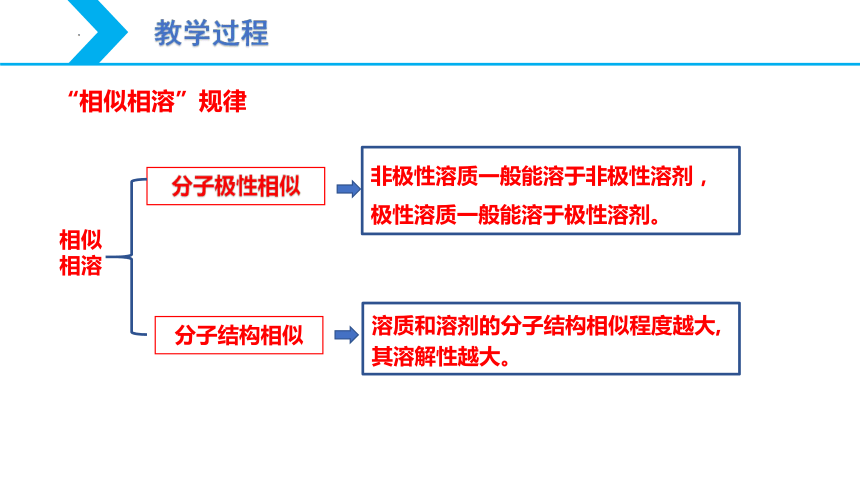
非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂。
分子极性相似
溶质和溶剂的分子结构相似程度越大,其溶解性越大。
分子结构相似
相似相溶
“相似相溶”规律
教学过程
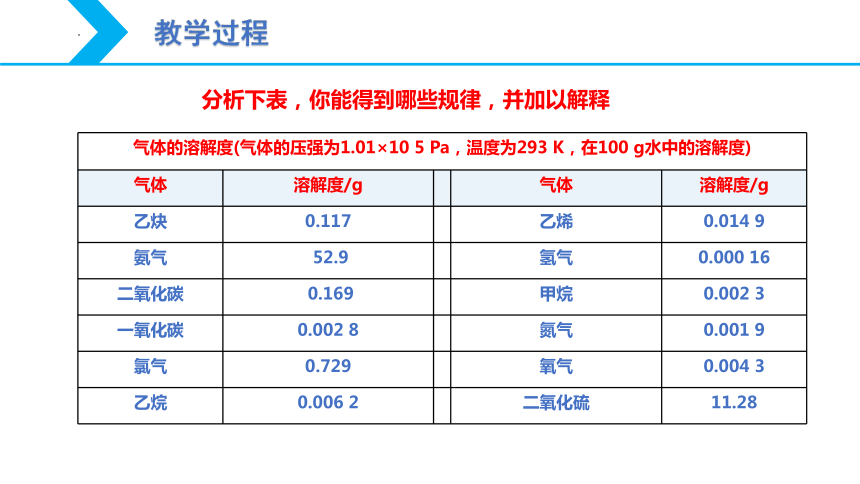
分析下表,你能得到哪些规律,并加以解释
气体的溶解度(气体的压强为1.01×10 5 Pa,温度为293 K,在100 g水中的溶解度) 气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.014 9
氨气 52.9 氢气 0.000 16
二氧化碳 0.169 甲烷 0.002 3
一氧化碳 0.002 8 氮气 0.001 9
氯气 0.729 氧气 0.004 3
乙烷 0.006 2 二氧化硫 11.28
教学过程
规律1:
规律2:
规律3:
水是极性溶剂,根据“相似相溶”,非极性溶质在水中的溶解度不大
如:H2、O2、N2、CH4
如果溶质与水发生化学反应,可增大其溶解度
如CO2、Cl2
NH3是极性分子,能H2O发生反应且与H2O分子间能形成氢键,氨气溶解度最高
教学过程
总结:
影响物质溶解性的因素:
“相似相溶”规律
分子结构
极性
氢键
反应
如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键作用力越大,溶解度越大。
溶质与水发生反应时可增大其溶解度,如SO2与H2O生成H2SO3,NH3与H2O生成NH3·H2O等。
外界因素:主要有温度、压强等。
教学过程
思考与讨论:
碘和四氯化碳是非极性分子,水是极性分子,非极性溶质一般能溶于非极性溶剂,而极性溶质一般能溶于极性溶剂。所以碘在四氯化碳中溶解性较好。
在水溶液里可发生如下反应:I2+I-=I3-,故溶液紫色变浅。
教学过程
碘在水中和四氯化碳中的溶解性
教学过程
二、分子的手性
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能叠合,互称为手性异构体(或对映异构体)。有手性异构体的分子叫做手性分子。
1.手性异构体与手性分子
教学过程
2.手性分子的成因
当4个不同的原子或基团连接在碳原子上时,这个碳原子是不对称原子。这种分子和它“在镜中的像”就不能重叠,因而表现为“手性”。手性分子中的不对称碳原子称为手性碳原子。例如,CHBrClF是一个简单的手性分子,如下图所示的两个分子互为镜像。又如,丙氨酸分子(手性碳原子上连接—H、—CH3、—NH2、—COOH)的手性如下图所示。
CHBrClF手性分子
手性分子
教学过程
3.手性分子的应用
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成的药物生产造福人类并带来巨大的经济效益。
典例1.
【答案】B
课堂练习
下列现象不能用“相似相溶”规律解释的是( )
A. 氯化氢易溶于水
B. 氯气易溶于NaOH溶液
C. 碘易溶于CCl4
D. 酒精易溶于水
典例2.
【答案】D
课堂练习
下列说法不正确的是( )
A. 互为手性异构体的分子互为镜像
B. 利用手性催化剂可主要得到一种手性分子
C. 手性异构体分子组成相同
D. 手性异构体性质相同
典例3.
【答案】C
课堂练习
下列化合物中含3个“手性碳原子”的是( )
A.
B.
C.
D.
课堂小结
感 谢 倾 听
第三节 分子的结构与物质的性质
第3课时 物质溶解性和分子手性
人教版选择性必修2
榆次一中 李金虎
学习目标
1.从分子结构的角度,认识“相似相溶”规律。
2.了解“手性分子”在生命科学等方面的应用。
学习目标
通过研究“手性分子”在生命科学等方面的应用,培养学生“科学精神和社会责任”的学科素养。
素养目标
情境引入
青蒿素提取
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
思考:为什么需要用乙醚来提取青蒿素,用水不可以呢?
情境引入
CH3CH2—O—CH2CH3
乙醚
青蒿素
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
教学过程
一、物质溶解性
思考:为什么蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水。
1.分子的极性
蔗糖、氨、水是极性分子,而萘、碘、四氯化碳是非极性分子。通过对许多实验的观察和研究,人们得出了一个经验性的“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
水是极性溶剂,根据“相似相溶”,极性溶质比非极性溶质在水中的溶解度大。
教学过程
2.分子的结构
分析表中数据,解释溶解度变化规律(从所含碳原子数多少的角度)
某些物质在293 K 100 g 水中的溶解度 名称 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
实验现象:
实验分析:
C2H5OH中的—OH和H2O中的—OH相近,因而乙醇易溶于水。
戊醇(CH3CH2CH2CH2CH2OH)中烃基较大,其中的—OH跟水分子中的—OH相似性差异较大,因此它在水中溶解度明显减小。
随分子中的碳原子数增加,饱和一元醇在水中的溶解度逐渐减小。
“相似相溶”
教学过程
1、比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
NH3分子和H2O分子都是极性分子,CH4是非极性分子,根据相似相溶,NH3易溶于水,CH4难溶于水中
2、日常生活中:为什么用有机溶剂溶解油漆,而不用水?
思考与讨论:
水分子的极性大,油漆极性小更易溶于极性小的乙酸乙酯中
教学过程
非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂。
分子极性相似
溶质和溶剂的分子结构相似程度越大,其溶解性越大。
分子结构相似
相似相溶
“相似相溶”规律
教学过程
分析下表,你能得到哪些规律,并加以解释
气体的溶解度(气体的压强为1.01×10 5 Pa,温度为293 K,在100 g水中的溶解度) 气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.014 9
氨气 52.9 氢气 0.000 16
二氧化碳 0.169 甲烷 0.002 3
一氧化碳 0.002 8 氮气 0.001 9
氯气 0.729 氧气 0.004 3
乙烷 0.006 2 二氧化硫 11.28
教学过程
规律1:
规律2:
规律3:
水是极性溶剂,根据“相似相溶”,非极性溶质在水中的溶解度不大
如:H2、O2、N2、CH4
如果溶质与水发生化学反应,可增大其溶解度
如CO2、Cl2
NH3是极性分子,能H2O发生反应且与H2O分子间能形成氢键,氨气溶解度最高
教学过程
总结:
影响物质溶解性的因素:
“相似相溶”规律
分子结构
极性
氢键
反应
如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键作用力越大,溶解度越大。
溶质与水发生反应时可增大其溶解度,如SO2与H2O生成H2SO3,NH3与H2O生成NH3·H2O等。
外界因素:主要有温度、压强等。
教学过程
思考与讨论:
碘和四氯化碳是非极性分子,水是极性分子,非极性溶质一般能溶于非极性溶剂,而极性溶质一般能溶于极性溶剂。所以碘在四氯化碳中溶解性较好。
在水溶液里可发生如下反应:I2+I-=I3-,故溶液紫色变浅。
教学过程
碘在水中和四氯化碳中的溶解性
教学过程
二、分子的手性
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能叠合,互称为手性异构体(或对映异构体)。有手性异构体的分子叫做手性分子。
1.手性异构体与手性分子
教学过程
2.手性分子的成因
当4个不同的原子或基团连接在碳原子上时,这个碳原子是不对称原子。这种分子和它“在镜中的像”就不能重叠,因而表现为“手性”。手性分子中的不对称碳原子称为手性碳原子。例如,CHBrClF是一个简单的手性分子,如下图所示的两个分子互为镜像。又如,丙氨酸分子(手性碳原子上连接—H、—CH3、—NH2、—COOH)的手性如下图所示。
CHBrClF手性分子
手性分子
教学过程
3.手性分子的应用
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成的药物生产造福人类并带来巨大的经济效益。
典例1.
【答案】B
课堂练习
下列现象不能用“相似相溶”规律解释的是( )
A. 氯化氢易溶于水
B. 氯气易溶于NaOH溶液
C. 碘易溶于CCl4
D. 酒精易溶于水
典例2.
【答案】D
课堂练习
下列说法不正确的是( )
A. 互为手性异构体的分子互为镜像
B. 利用手性催化剂可主要得到一种手性分子
C. 手性异构体分子组成相同
D. 手性异构体性质相同
典例3.
【答案】C
课堂练习
下列化合物中含3个“手性碳原子”的是( )
A.
B.
C.
D.
课堂小结
感 谢 倾 听
