3.2 分子晶体与共价晶体(第1课时 分子晶体)(共23张PPT)-【核心素养目标】2023-2024学年高二化学同步精品课件(人教版2019选择性必修2)
文档属性
| 名称 | 3.2 分子晶体与共价晶体(第1课时 分子晶体)(共23张PPT)-【核心素养目标】2023-2024学年高二化学同步精品课件(人教版2019选择性必修2) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 17:22:52 | ||
图片预览






文档简介
(共23张PPT)
第二节 分子晶体与共价晶体
第1课时 分子晶体
人教版选择性必修2
榆次一中 李金虎
学习目标
1.使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点;
2.知道一些常见的属于分子晶体的物质类别。
3.能借助分子晶体模型说明分子晶体中的粒子及粒子间的相互作用,以及范德华力与氢键对分子晶体结构与性质的影响。
学习目标
1.通过研究分子晶体的结构与性质,培养学生“宏观辨识与微观探析”的学科素养。
2.通过典型分子晶体晶胞模型来研究晶体内部的结构,培养学生“证据推理和模型认知”的学科素养。
素养目标
情境引入
晶体具有周期性的微观结构。你若能想象,二维的印花布图案是由原子、离子或分子等构成的,再把这种图案推演到三维空间里去,就如同晶体的微观结构了。晶体的微观基本单元称为晶胞,就好比蜂巢里的蜂室。晶体可简单地分为分子晶体、共价晶体、金属晶体和离子晶体四种类型。另外,还存在许多过渡晶体和混合型晶体。晶体的结构决定了晶体的性质。晶体的熔点、密度、硬度、延展性、溶解性、热分解性、化学反应性、生物活性……都与晶体结构密切相关。
教学过程
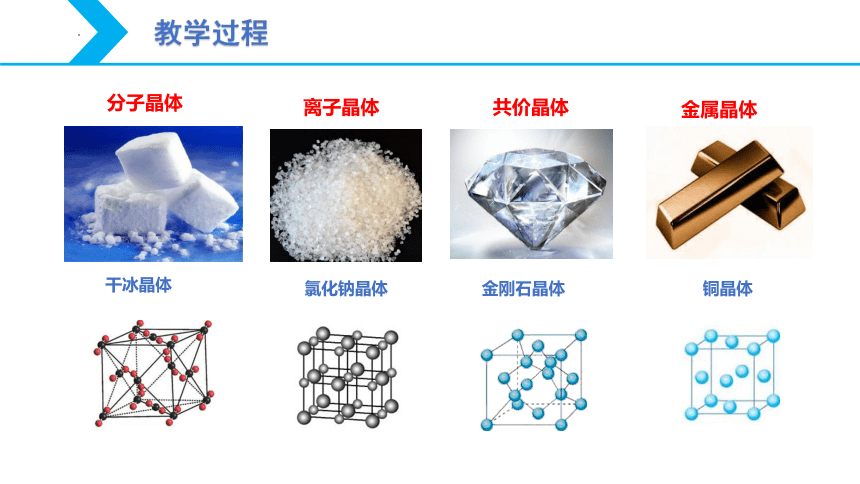
分子晶体
共价晶体
离子晶体
金属晶体
干冰晶体
金刚石晶体
氯化钠晶体
铜晶体
教学过程
一、分子晶体
(1) 定义:只含分子的晶体,或者分子间以分子间作用力结合形成的晶体叫分子晶体。
(2) 构成微粒:分子
(3) 微粒间的作用:分子间作用力
(4) 分子内作用力:共价键
1.构成粒子及作用力
【注意】稀有气体是单原子分子,不含共价键
分子间作用力影响晶体的物理性质,共价键影响晶体的化学性质
教学过程
(1)所有非金属氢化物:如H2O、NH3、CH4等。
(2)部分非金属单质:如卤素(X2)、O2、N2、白磷(P4)、硫(S8)等。
(3)部分非金属氧化物:如CO2、P4O10、SO2、SO3等。
(4)几乎所有的酸:如HNO3、H2SO4、H3PO4、H2SiO3等。
(5)绝大多数有机物:如苯、乙醇、乙酸、乙酸乙酯等。
2.常见的分子晶体
【注意】金刚石不是分子晶体
【注意】二氧化硅不是分子晶体
教学过程
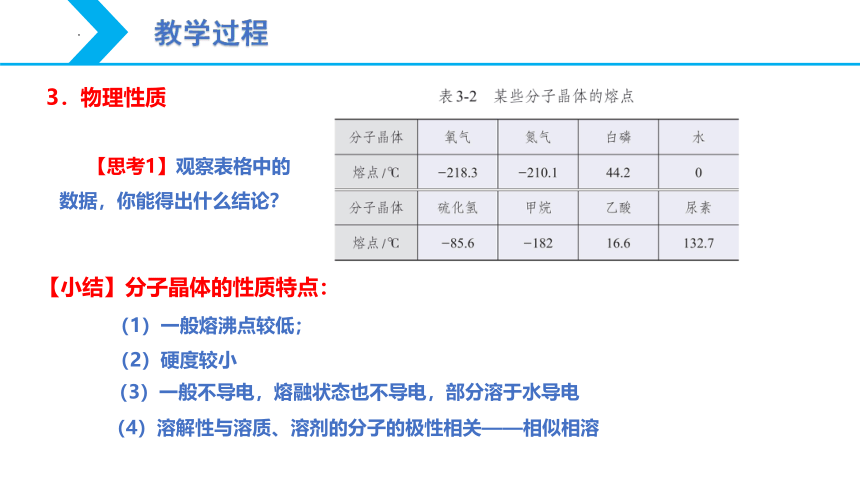
3.物理性质
【思考1】观察表格中的数据,你能得出什么结论?
【小结】分子晶体的性质特点:
(1)一般熔沸点较低;
(2)硬度较小
(4)溶解性与溶质、溶剂的分子的极性相关——相似相溶
(3)一般不导电,熔融状态也不导电,部分溶于水导电
教学过程
1.组成和结构相似、不含氢键的分子晶体,相对分子质量越大,分子间作用力越强,熔、沸点越高。如:I2>Br2>Cl2>F2
2.组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,熔、沸点越高。如:CH3OH>CH3CH3
3.含有分子间氢键的会导致熔、沸点反常升高。如:H2O>H2Te>H2Se>H2S
4.对于有机物来说,分子式相同,支链越多,熔、沸点越低。
5.烃、卤代烃、醇、醛、羧酸等有机物一般随分子里碳原子数的增加,熔、沸点升高。如:C2H6>CH4,C2H5Cl>CH3Cl
分子晶体熔、沸点高低的判断
如:CH3—CH2—CH2—CH2—CH3> >
教学过程
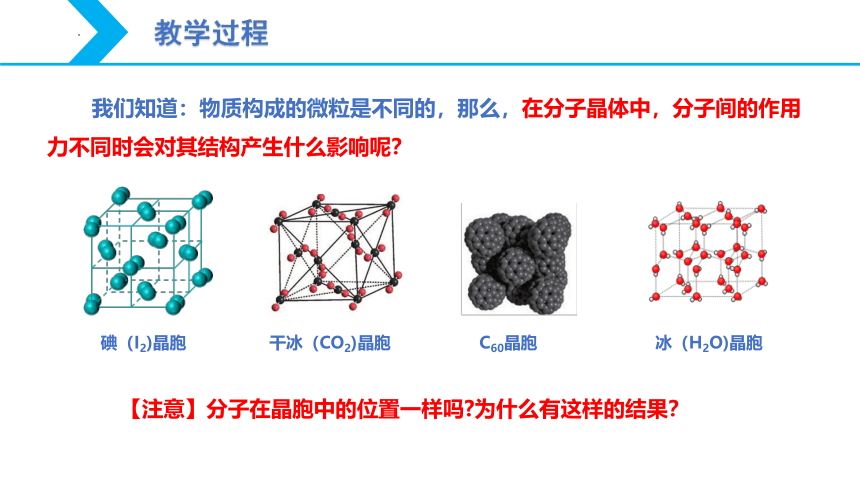
我们知道:物质构成的微粒是不同的,那么,在分子晶体中,分子间的作用力不同时会对其结构产生什么影响呢?
碘(I2)晶胞
干冰(CO2)晶胞
C60晶胞
冰(H2O)晶胞
【注意】分子在晶胞中的位置一样吗 为什么有这样的结果?
教学过程
(1)若分子间作用力只有范德华力,则分子晶体有分子密堆积特征,即每个分子周围有12个紧邻的分子。
如:干冰:CO2的晶体。
4.分子晶体的结构特点
思考:利用干冰晶体的结构模型认识分子晶体的结构特征,以一个分子为中心,每个CO2周围有几个紧密相邻的CO2
教学过程
1
x
y
z
2
3
4
教学过程
x
y
z
1
2
3
4
5
6
7
8
9
10
11
12
教学过程
(2)分子间含有其他作用力,如:氢键,则每个分子周围紧邻的分子要少于12个。如冰中每个水分子周围只有4个紧邻的水分子。
4.分子晶体的结构特点
水分子间存在氢键,氢键具有方向性和饱和性,迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这种特征称为分子非密堆积。
教学过程
思考2:为什么冰刚刚融化时,密度变大,4 ℃后密度又变小?
冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水的小。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,才由于热运动加剧,分子间距离加大,密度渐渐减小。
教学过程
分子密堆积 分子非密堆积
微粒间作用力
空间 特点 通常每个分子周围 有12个紧邻的分子 每个分子周围紧邻的分子数
小于12个,空间利用率不高
举例 C60、干冰、I2、O2 HF、NH3、冰
分子晶体的结构特征
范德华力
范德华力和氢键
教学过程
思考3:干冰和冰的外观相似、硬度也和冰相近,为什么干冰的熔点比冰的低得多,在常温下就可以升华,且密度比冰的高?
干冰中的CO2之间只存在范德华力,冰中水分子间还存在大量的氢键,所以干冰的熔点低于冰。
干冰中分子采取密堆积形式排列,空隙小;冰中分子采取非密堆积形式排列,导致冰中水分子间存在大量空隙,所以,在同一条件下,冰的体积比干冰的体积大,而二氧化碳的相对质量比水的相对质量大,即干冰的密度比冰的密度大。
教学过程
思考4:硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻的分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
硫化氢晶体中只存在范德华力,属于分子密堆积,而冰中主要作用力是氢键,氢键具有方向性,氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
下列性质符合分子晶体特点的是( )
①熔点1070℃,易溶于水,水溶液能导电
②熔点10.31℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8℃,沸点444.6℃
④熔点97.81℃,质软,导电,密度为0.97g·cm-3
A.①④ B.②③ C.①② D.②④
典例1.
【答案】B
课堂练习
典例2.
【答案】B
课堂练习
下列说法中,正确的是( )
A.冰融化时,分子中的H—O键发生断裂
B.有些分子间不仅存在范德华力,还可能存在氢键
C.分子晶体中,共价键能越大,该分子晶体的熔、沸点一定越高
D.分子晶体中,分子间作用力越大,对应的物质越稳定
典例3.
课堂练习
中学教材上介绍的干冰晶体结构如图所示,每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离 a (其中a为立方体棱长)的CO2有 ( )
A.4个 B.8个
C.12个 D.6个
【答案】C
课堂小结
课后小任务
许多气体可以与水形成水合物晶体。20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
天然气水合物—— 一种潜在的能源
甲烷水合物的化学式可表示为8CH4·46H2O,相当于CH4和H2O的物质的量比为1∶5.75。把甲烷水合物从海底提升到海平面,1m3固体可释放164 m3(标准状况)甲体。
感 谢 倾 听
第二节 分子晶体与共价晶体
第1课时 分子晶体
人教版选择性必修2
榆次一中 李金虎
学习目标
1.使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点;
2.知道一些常见的属于分子晶体的物质类别。
3.能借助分子晶体模型说明分子晶体中的粒子及粒子间的相互作用,以及范德华力与氢键对分子晶体结构与性质的影响。
学习目标
1.通过研究分子晶体的结构与性质,培养学生“宏观辨识与微观探析”的学科素养。
2.通过典型分子晶体晶胞模型来研究晶体内部的结构,培养学生“证据推理和模型认知”的学科素养。
素养目标
情境引入
晶体具有周期性的微观结构。你若能想象,二维的印花布图案是由原子、离子或分子等构成的,再把这种图案推演到三维空间里去,就如同晶体的微观结构了。晶体的微观基本单元称为晶胞,就好比蜂巢里的蜂室。晶体可简单地分为分子晶体、共价晶体、金属晶体和离子晶体四种类型。另外,还存在许多过渡晶体和混合型晶体。晶体的结构决定了晶体的性质。晶体的熔点、密度、硬度、延展性、溶解性、热分解性、化学反应性、生物活性……都与晶体结构密切相关。
教学过程
分子晶体
共价晶体
离子晶体
金属晶体
干冰晶体
金刚石晶体
氯化钠晶体
铜晶体
教学过程
一、分子晶体
(1) 定义:只含分子的晶体,或者分子间以分子间作用力结合形成的晶体叫分子晶体。
(2) 构成微粒:分子
(3) 微粒间的作用:分子间作用力
(4) 分子内作用力:共价键
1.构成粒子及作用力
【注意】稀有气体是单原子分子,不含共价键
分子间作用力影响晶体的物理性质,共价键影响晶体的化学性质
教学过程
(1)所有非金属氢化物:如H2O、NH3、CH4等。
(2)部分非金属单质:如卤素(X2)、O2、N2、白磷(P4)、硫(S8)等。
(3)部分非金属氧化物:如CO2、P4O10、SO2、SO3等。
(4)几乎所有的酸:如HNO3、H2SO4、H3PO4、H2SiO3等。
(5)绝大多数有机物:如苯、乙醇、乙酸、乙酸乙酯等。
2.常见的分子晶体
【注意】金刚石不是分子晶体
【注意】二氧化硅不是分子晶体
教学过程
3.物理性质
【思考1】观察表格中的数据,你能得出什么结论?
【小结】分子晶体的性质特点:
(1)一般熔沸点较低;
(2)硬度较小
(4)溶解性与溶质、溶剂的分子的极性相关——相似相溶
(3)一般不导电,熔融状态也不导电,部分溶于水导电
教学过程
1.组成和结构相似、不含氢键的分子晶体,相对分子质量越大,分子间作用力越强,熔、沸点越高。如:I2>Br2>Cl2>F2
2.组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,熔、沸点越高。如:CH3OH>CH3CH3
3.含有分子间氢键的会导致熔、沸点反常升高。如:H2O>H2Te>H2Se>H2S
4.对于有机物来说,分子式相同,支链越多,熔、沸点越低。
5.烃、卤代烃、醇、醛、羧酸等有机物一般随分子里碳原子数的增加,熔、沸点升高。如:C2H6>CH4,C2H5Cl>CH3Cl
分子晶体熔、沸点高低的判断
如:CH3—CH2—CH2—CH2—CH3> >
教学过程
我们知道:物质构成的微粒是不同的,那么,在分子晶体中,分子间的作用力不同时会对其结构产生什么影响呢?
碘(I2)晶胞
干冰(CO2)晶胞
C60晶胞
冰(H2O)晶胞
【注意】分子在晶胞中的位置一样吗 为什么有这样的结果?
教学过程
(1)若分子间作用力只有范德华力,则分子晶体有分子密堆积特征,即每个分子周围有12个紧邻的分子。
如:干冰:CO2的晶体。
4.分子晶体的结构特点
思考:利用干冰晶体的结构模型认识分子晶体的结构特征,以一个分子为中心,每个CO2周围有几个紧密相邻的CO2
教学过程
1
x
y
z
2
3
4
教学过程
x
y
z
1
2
3
4
5
6
7
8
9
10
11
12
教学过程
(2)分子间含有其他作用力,如:氢键,则每个分子周围紧邻的分子要少于12个。如冰中每个水分子周围只有4个紧邻的水分子。
4.分子晶体的结构特点
水分子间存在氢键,氢键具有方向性和饱和性,迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这种特征称为分子非密堆积。
教学过程
思考2:为什么冰刚刚融化时,密度变大,4 ℃后密度又变小?
冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水的小。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,才由于热运动加剧,分子间距离加大,密度渐渐减小。
教学过程
分子密堆积 分子非密堆积
微粒间作用力
空间 特点 通常每个分子周围 有12个紧邻的分子 每个分子周围紧邻的分子数
小于12个,空间利用率不高
举例 C60、干冰、I2、O2 HF、NH3、冰
分子晶体的结构特征
范德华力
范德华力和氢键
教学过程
思考3:干冰和冰的外观相似、硬度也和冰相近,为什么干冰的熔点比冰的低得多,在常温下就可以升华,且密度比冰的高?
干冰中的CO2之间只存在范德华力,冰中水分子间还存在大量的氢键,所以干冰的熔点低于冰。
干冰中分子采取密堆积形式排列,空隙小;冰中分子采取非密堆积形式排列,导致冰中水分子间存在大量空隙,所以,在同一条件下,冰的体积比干冰的体积大,而二氧化碳的相对质量比水的相对质量大,即干冰的密度比冰的密度大。
教学过程
思考4:硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻的分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
硫化氢晶体中只存在范德华力,属于分子密堆积,而冰中主要作用力是氢键,氢键具有方向性,氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
下列性质符合分子晶体特点的是( )
①熔点1070℃,易溶于水,水溶液能导电
②熔点10.31℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8℃,沸点444.6℃
④熔点97.81℃,质软,导电,密度为0.97g·cm-3
A.①④ B.②③ C.①② D.②④
典例1.
【答案】B
课堂练习
典例2.
【答案】B
课堂练习
下列说法中,正确的是( )
A.冰融化时,分子中的H—O键发生断裂
B.有些分子间不仅存在范德华力,还可能存在氢键
C.分子晶体中,共价键能越大,该分子晶体的熔、沸点一定越高
D.分子晶体中,分子间作用力越大,对应的物质越稳定
典例3.
课堂练习
中学教材上介绍的干冰晶体结构如图所示,每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离 a (其中a为立方体棱长)的CO2有 ( )
A.4个 B.8个
C.12个 D.6个
【答案】C
课堂小结
课后小任务
许多气体可以与水形成水合物晶体。20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
天然气水合物—— 一种潜在的能源
甲烷水合物的化学式可表示为8CH4·46H2O,相当于CH4和H2O的物质的量比为1∶5.75。把甲烷水合物从海底提升到海平面,1m3固体可释放164 m3(标准状况)甲体。
感 谢 倾 听
