3.2 分子晶体与共价晶体(第2课时 共价晶体)(共24张PPT)-【核心素养目标】2023-2024学年高二化学同步精品课件(人教版2019选择性必修2)
文档属性
| 名称 | 3.2 分子晶体与共价晶体(第2课时 共价晶体)(共24张PPT)-【核心素养目标】2023-2024学年高二化学同步精品课件(人教版2019选择性必修2) |

|
|
| 格式 | pptx | ||
| 文件大小 | 67.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 10:46:02 | ||
图片预览





文档简介
(共24张PPT)
第二节 分子晶体与共价晶体
第2课时 共价晶体
人教版选择性必修2
榆次一中 李金虎
学习目标
1.掌握共价晶体的概念,了解金刚石等典型共价晶体的结构特征;
2.能描述金刚石、二氧化硅等共价晶体的结构与性质的关系。
学习目标
1.通过典型共价晶体的晶胞模型来研究晶体内部的结构,培养学生“证据推理和模型认知”的学科素养。
2. 能够从化学键的特征分析理解共价晶体的物理特性,发展“宏观辨识和微观探析”的学科核心素养。
素养目标
情境引入
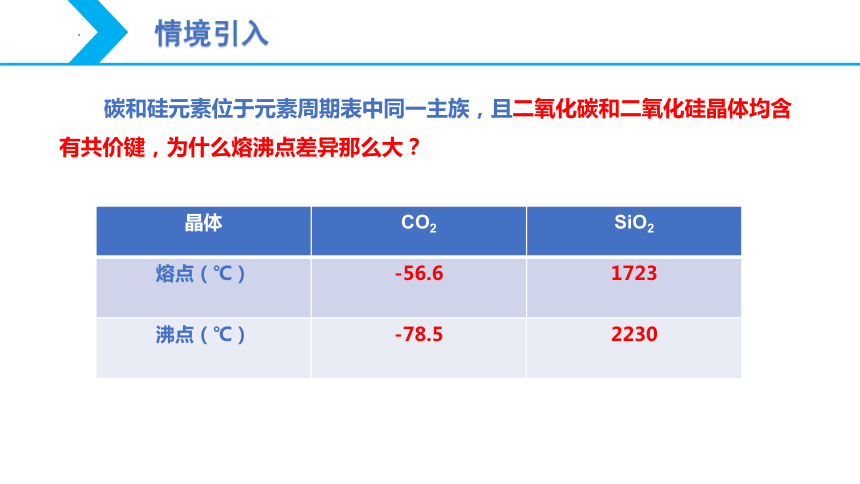
碳和硅元素位于元素周期表中同一主族,且二氧化碳和二氧化硅晶体均含有共价键,为什么熔沸点差异那么大?
晶体 CO2 SiO2
熔点(℃) -56.6 1723
沸点(℃) -78.5 2230
教学过程
一、共价晶体
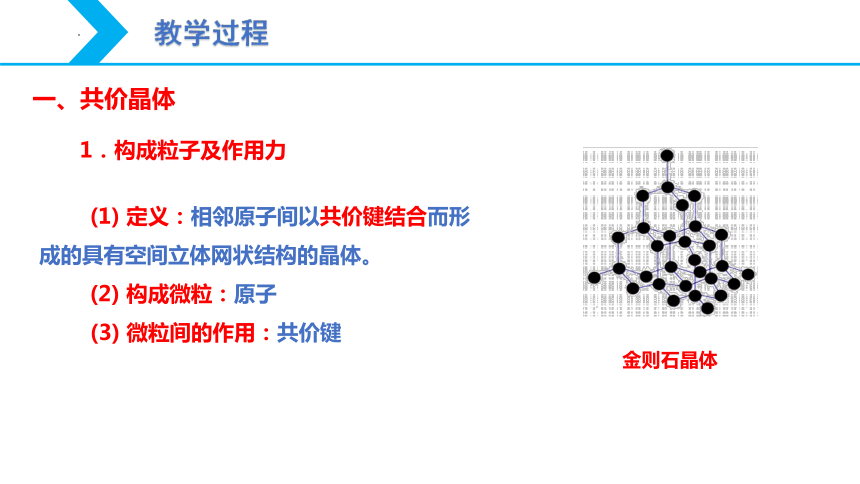
(1) 定义:相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体。
(2) 构成微粒:原子
(3) 微粒间的作用:共价键
1.构成粒子及作用力
金则石晶体
教学过程
思考:
1、由原子构成的晶体一定是共价晶体吗?
2、含有共价键的晶体一定是共价晶体吗?
不一定,金属晶体也是由原子构成的(下一节学习)
不一定,共价晶体中含有共价键,但分子晶体中也含有共价键,如 CO2,离子晶体也可能含有共价键,如NaOH
教学过程
2.典型的共价晶体
如:硼(B)、金刚石(C)、硅(Si)、锗(Ge)和锡(Sn)等
如:碳化硅(SiC)、二氧化硅(SiO2)及氮化硅(Si3N4)等
(3)极少数金属氧化物
(1)某些单质
(2)某些非金属氧化物
如:刚玉(ɑ-Al2O3)
教学过程
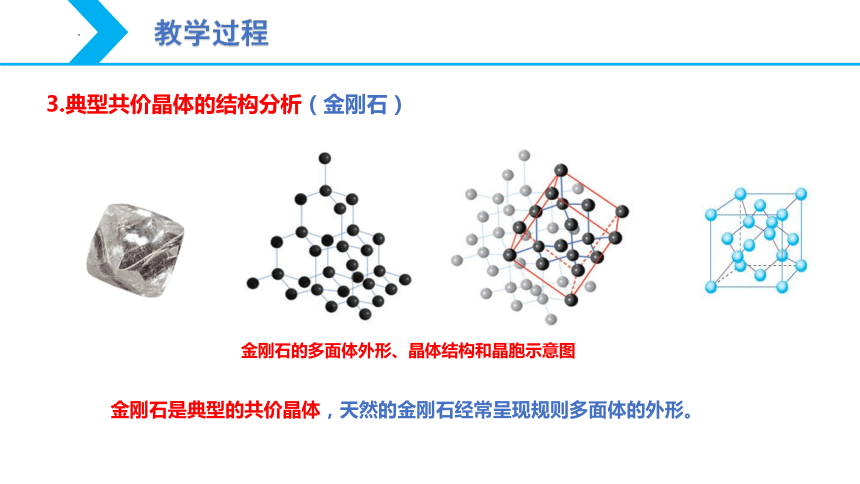
3.典型共价晶体的结构分析(金刚石)
金刚石的多面体外形、晶体结构和晶胞示意图
金刚石是典型的共价晶体,天然的金刚石经常呈现规则多面体的外形。
教学过程
金刚石中晶胞的截取
教学过程
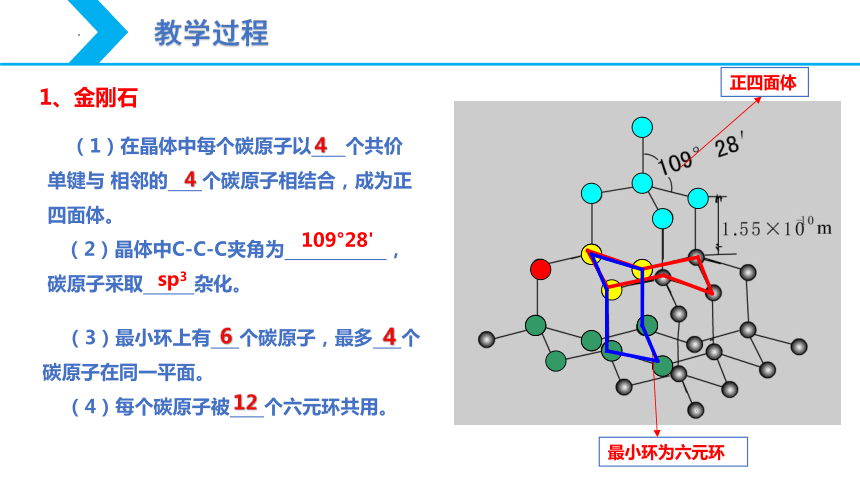
(1)在晶体中每个碳原子以 个共价单键与 相邻的 个碳原子相结合,成为正四面体。
(2)晶体中C-C-C夹角为 ,碳原子采取 杂化。
(3)最小环上有 个碳原子,最多 个碳原子在同一平面。
(4)每个碳原子被 个六元环共用。
4
4
109°28'
sp3
6
4
12
1、金刚石
最小环为六元环
正四面体
教学过程
(5)晶体中每个C参与了 条C—C键的形成,而在每条键中的贡献只有 ,故C原子与C—C键数之比为: 。
1、金刚石
(6)在金刚石晶胞中占有的碳原子数____。
8
(8×1/8+6×1/2+4=8)
(12g金刚石含有 个C原子,含有 个C-C键)
NA
2NA
1:2
4
1/2
金刚石里的C—C共价键的键长(154 pm)很短,键能(347.7 kJ/mol)很大,这一结构使金刚石在所有已知晶体中硬度最大,而且熔点(>3 500 ℃)也很高。高硬度、高熔点是许多有共价键三维骨架结构的共价晶体的特性。
教学过程
金刚石晶胞的结构特点
教学过程
不同角度观察金刚石晶胞结构原子的排列
教学过程
2、二氧化硅晶体
二氧化硅是自然界含量最高的固态二元氧化物,熔点1 713℃,有多种结构。
二氧化硅晶体中,每个硅原子均以4个共价键对称地与相邻的4个氧原子相结合,每个氧原子与2个硅原子相结合,向空间扩展,形成三维骨架结构(封闭的环状结构)。最小的环上有6个硅原子和6个氧原子,硅、氧原子个数比为_________。
1:2
教学过程
低温石英(α SiO2)是最常见的一种结构。遍布海滩河岸的黄沙、带状的石英矿脉、花岗石里的白色晶体、透明的水晶都是低温石英。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性(左、右型),被广泛用作压电材料,如制作石英手表。
石英的左、右型晶体
石英手表
石英晶体中的硅氧四面 体相连构成的螺旋链
教学过程
SiO2具有许多重要用途,是制造水泥、玻璃、单晶硅、硅光电池、芯片和光导纤维的原料。
教学过程
思考1:根据表中数据,归纳共价晶体的性质特点,并从结构角度解释原因
某些共价晶体的熔点和硬度 共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
硬度是衡量固体软硬程度的指标。硬度有不同的标度,最普通的硬度标度是划痕硬度,即摩氏硬度,以固体互相刻画时出现刻痕的固体的硬度较低。
共价晶体的性质特点
熔点高(通常>1 000 ℃) 硬度大
共价晶体的结构特点
非密堆积
原子通过共价键形成空间网状结构
教学过程
思考2:怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
共价晶体 金刚石 硅 锗
熔点/℃ >3 500 1 410 1 211
硬度* 10 6.5 6.0
三种物质中,每个原子均以sp3杂化形式与相邻的四个原子形成σ键,整体上形成三维骨架结构,同属于共价晶体,熔点都比较高。熔点的相对高低与共价键的强弱有关,共价键越强,熔点越高。金刚石、硅和锗的结构差别在于碳、硅、锗原子半径依次递增。C-C键、Si-Si键、 Ge-Ge键的键长依次递增,键长越长,键能越小,所以熔点和硬度依次下降。
教学过程
分子晶体和共价晶体对比
晶体类型 共价晶体 分子晶体
概念 相邻原子间以共价键相结合而形成的空间立体网状结构的晶体 分子间以分子间作用力相结合的晶体
组成微粒 原子 分子
微粒间作用力 共价键 分子间作用力
物理性质 熔、沸点高,硬度大,不溶于常见的溶剂,不导电,个别为半导体 熔、沸点较低,硬度较小,部分溶于水,不导电,部分溶于水导电
熔化时破坏的作用力 破坏共价键 一定破坏范德华力,有时还破坏氢键,如冰熔化
实例 金刚石、二氧化硅等 冰、干冰等
下列关于SiO2和金刚石的叙述正确的是( )
A.SiO2的晶体结构中,每个Si原子与2个O原子直接相连
B.通常状况下,1 mol SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数的值)
C.金刚石的网状结构中,由共价键形成的最小环上有6个碳原子
D.1mol金刚石中含有 4 NA个C-C键(NA表示阿伏加德罗常数的值)
典例1.
【答案】C
课堂练习
典例2.
【答案】B
课堂练习
将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型耐高温、耐磨材料,在工业上有广泛的应用。下列推断可能正确的是( )
A.SiCl4、Si3N4的晶体类型相同
B.Si3N4晶体是立体网状结构
C.原子晶体C3N4的熔点比Si3N4的低
D.SiCl4晶体在熔化过程中化学键断裂
典例3.
课堂练习
磷化硼是一种超硬耐磨涂层材料。如图为其晶体结构中最小的重复单元。下列有关说法正确的是( )
A.磷化硼的化学式为B2P
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体属于共价晶体
D.磷化硼晶体在熔化时需克服范德华力
【答案】C
课堂小结
共价晶体
结构特点
物理性质
常见共价晶体类型
典型的共价晶体的结构(金刚石、二氧化硅)
课后小任务
阅读下面内容,对金刚石以及它的合成进一步的认识。
感 谢 倾 听
第二节 分子晶体与共价晶体
第2课时 共价晶体
人教版选择性必修2
榆次一中 李金虎
学习目标
1.掌握共价晶体的概念,了解金刚石等典型共价晶体的结构特征;
2.能描述金刚石、二氧化硅等共价晶体的结构与性质的关系。
学习目标
1.通过典型共价晶体的晶胞模型来研究晶体内部的结构,培养学生“证据推理和模型认知”的学科素养。
2. 能够从化学键的特征分析理解共价晶体的物理特性,发展“宏观辨识和微观探析”的学科核心素养。
素养目标
情境引入
碳和硅元素位于元素周期表中同一主族,且二氧化碳和二氧化硅晶体均含有共价键,为什么熔沸点差异那么大?
晶体 CO2 SiO2
熔点(℃) -56.6 1723
沸点(℃) -78.5 2230
教学过程
一、共价晶体
(1) 定义:相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体。
(2) 构成微粒:原子
(3) 微粒间的作用:共价键
1.构成粒子及作用力
金则石晶体
教学过程
思考:
1、由原子构成的晶体一定是共价晶体吗?
2、含有共价键的晶体一定是共价晶体吗?
不一定,金属晶体也是由原子构成的(下一节学习)
不一定,共价晶体中含有共价键,但分子晶体中也含有共价键,如 CO2,离子晶体也可能含有共价键,如NaOH
教学过程
2.典型的共价晶体
如:硼(B)、金刚石(C)、硅(Si)、锗(Ge)和锡(Sn)等
如:碳化硅(SiC)、二氧化硅(SiO2)及氮化硅(Si3N4)等
(3)极少数金属氧化物
(1)某些单质
(2)某些非金属氧化物
如:刚玉(ɑ-Al2O3)
教学过程
3.典型共价晶体的结构分析(金刚石)
金刚石的多面体外形、晶体结构和晶胞示意图
金刚石是典型的共价晶体,天然的金刚石经常呈现规则多面体的外形。
教学过程
金刚石中晶胞的截取
教学过程
(1)在晶体中每个碳原子以 个共价单键与 相邻的 个碳原子相结合,成为正四面体。
(2)晶体中C-C-C夹角为 ,碳原子采取 杂化。
(3)最小环上有 个碳原子,最多 个碳原子在同一平面。
(4)每个碳原子被 个六元环共用。
4
4
109°28'
sp3
6
4
12
1、金刚石
最小环为六元环
正四面体
教学过程
(5)晶体中每个C参与了 条C—C键的形成,而在每条键中的贡献只有 ,故C原子与C—C键数之比为: 。
1、金刚石
(6)在金刚石晶胞中占有的碳原子数____。
8
(8×1/8+6×1/2+4=8)
(12g金刚石含有 个C原子,含有 个C-C键)
NA
2NA
1:2
4
1/2
金刚石里的C—C共价键的键长(154 pm)很短,键能(347.7 kJ/mol)很大,这一结构使金刚石在所有已知晶体中硬度最大,而且熔点(>3 500 ℃)也很高。高硬度、高熔点是许多有共价键三维骨架结构的共价晶体的特性。
教学过程
金刚石晶胞的结构特点
教学过程
不同角度观察金刚石晶胞结构原子的排列
教学过程
2、二氧化硅晶体
二氧化硅是自然界含量最高的固态二元氧化物,熔点1 713℃,有多种结构。
二氧化硅晶体中,每个硅原子均以4个共价键对称地与相邻的4个氧原子相结合,每个氧原子与2个硅原子相结合,向空间扩展,形成三维骨架结构(封闭的环状结构)。最小的环上有6个硅原子和6个氧原子,硅、氧原子个数比为_________。
1:2
教学过程
低温石英(α SiO2)是最常见的一种结构。遍布海滩河岸的黄沙、带状的石英矿脉、花岗石里的白色晶体、透明的水晶都是低温石英。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性(左、右型),被广泛用作压电材料,如制作石英手表。
石英的左、右型晶体
石英手表
石英晶体中的硅氧四面 体相连构成的螺旋链
教学过程
SiO2具有许多重要用途,是制造水泥、玻璃、单晶硅、硅光电池、芯片和光导纤维的原料。
教学过程
思考1:根据表中数据,归纳共价晶体的性质特点,并从结构角度解释原因
某些共价晶体的熔点和硬度 共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
硬度是衡量固体软硬程度的指标。硬度有不同的标度,最普通的硬度标度是划痕硬度,即摩氏硬度,以固体互相刻画时出现刻痕的固体的硬度较低。
共价晶体的性质特点
熔点高(通常>1 000 ℃) 硬度大
共价晶体的结构特点
非密堆积
原子通过共价键形成空间网状结构
教学过程
思考2:怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
共价晶体 金刚石 硅 锗
熔点/℃ >3 500 1 410 1 211
硬度* 10 6.5 6.0
三种物质中,每个原子均以sp3杂化形式与相邻的四个原子形成σ键,整体上形成三维骨架结构,同属于共价晶体,熔点都比较高。熔点的相对高低与共价键的强弱有关,共价键越强,熔点越高。金刚石、硅和锗的结构差别在于碳、硅、锗原子半径依次递增。C-C键、Si-Si键、 Ge-Ge键的键长依次递增,键长越长,键能越小,所以熔点和硬度依次下降。
教学过程
分子晶体和共价晶体对比
晶体类型 共价晶体 分子晶体
概念 相邻原子间以共价键相结合而形成的空间立体网状结构的晶体 分子间以分子间作用力相结合的晶体
组成微粒 原子 分子
微粒间作用力 共价键 分子间作用力
物理性质 熔、沸点高,硬度大,不溶于常见的溶剂,不导电,个别为半导体 熔、沸点较低,硬度较小,部分溶于水,不导电,部分溶于水导电
熔化时破坏的作用力 破坏共价键 一定破坏范德华力,有时还破坏氢键,如冰熔化
实例 金刚石、二氧化硅等 冰、干冰等
下列关于SiO2和金刚石的叙述正确的是( )
A.SiO2的晶体结构中,每个Si原子与2个O原子直接相连
B.通常状况下,1 mol SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数的值)
C.金刚石的网状结构中,由共价键形成的最小环上有6个碳原子
D.1mol金刚石中含有 4 NA个C-C键(NA表示阿伏加德罗常数的值)
典例1.
【答案】C
课堂练习
典例2.
【答案】B
课堂练习
将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型耐高温、耐磨材料,在工业上有广泛的应用。下列推断可能正确的是( )
A.SiCl4、Si3N4的晶体类型相同
B.Si3N4晶体是立体网状结构
C.原子晶体C3N4的熔点比Si3N4的低
D.SiCl4晶体在熔化过程中化学键断裂
典例3.
课堂练习
磷化硼是一种超硬耐磨涂层材料。如图为其晶体结构中最小的重复单元。下列有关说法正确的是( )
A.磷化硼的化学式为B2P
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体属于共价晶体
D.磷化硼晶体在熔化时需克服范德华力
【答案】C
课堂小结
共价晶体
结构特点
物理性质
常见共价晶体类型
典型的共价晶体的结构(金刚石、二氧化硅)
课后小任务
阅读下面内容,对金刚石以及它的合成进一步的认识。
感 谢 倾 听
