3.4 配合物与超分子 (第1课时 配合物)(共13张PPT)-【核心素养目标】2023-2024学年高二化学同步精品课件(人教版2019选择性必修2)
文档属性
| 名称 | 3.4 配合物与超分子 (第1课时 配合物)(共13张PPT)-【核心素养目标】2023-2024学年高二化学同步精品课件(人教版2019选择性必修2) |

|
|
| 格式 | pptx | ||
| 文件大小 | 27.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 00:00:00 | ||
图片预览




文档简介
(共13张PPT)
第二节 配合物与超分子
第1课时 配合物
人教版选择性必修2
榆次一中 李金虎
学习目标
1.通过熟悉的无水硫酸铜与其溶液颜色不同这一现象,认识配位键的特征,并能与共价键进行简单比较。
2.在配位键的基础上,认识配合物的存在、结构特点及常见配合物的制取等。
学习目标
1.能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。培养学生“宏观辨识与微观辨析”的学科素养。
2.能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。培养学生“证据推理与模型认知”的学科素养。
素养目标
情境引入
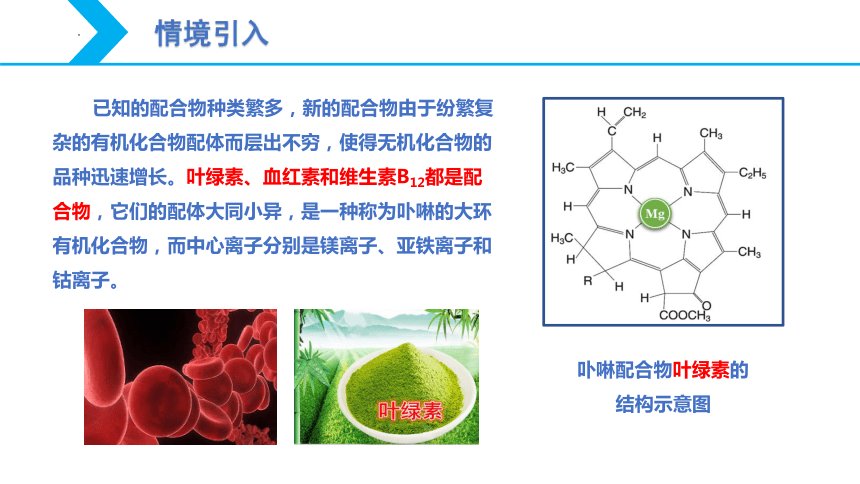
卟啉配合物叶绿素的
结构示意图
已知的配合物种类繁多,新的配合物由于纷繁复杂的有机化合物配体而层出不穷,使得无机化合物的品种迅速增长。叶绿素、血红素和维生素B12都是配合物,它们的配体大同小异,是一种称为卟啉的大环有机化合物,而中心离子分别是镁离子、亚铁离子和钴离子。
实验探究
一、配合物
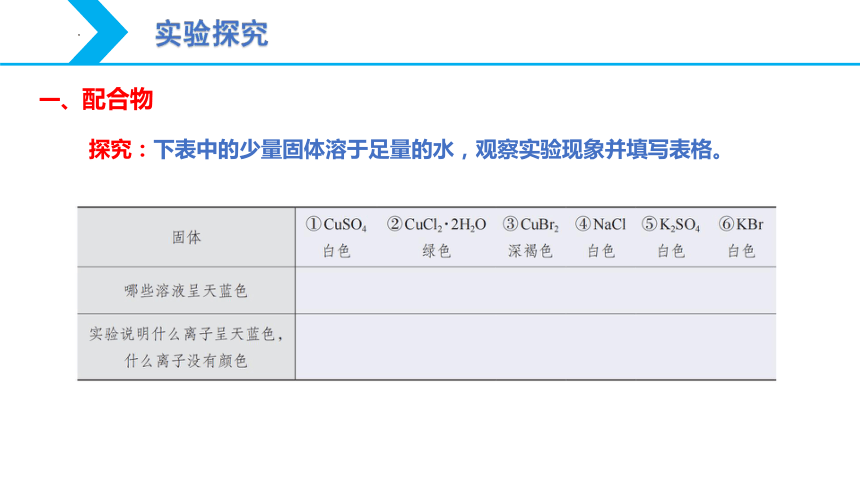
探究:下表中的少量固体溶于足量的水,观察实验现象并填写表格。
实验探究
教学过程
教学过程
固体 ①CuSO4 ②CuCl2·2H2O ③CuBr2 ④NaCl ⑤K2SO4 ⑥KBr
白色 绿色 深褐色 白色 白色 白色
哪些溶液呈天蓝色
实验说明什么离子呈天蓝色,什么离子没有颜色
固态二价铜盐不一定显蓝色,Cu2+在水溶液中常显蓝色;
Na+、K+、SO42- 、Cl-、Br-没有颜色;
天蓝色
天蓝色
天蓝色
无色
无色
无色
教学过程
溶液呈天蓝色与Cu2+和H2O有关,他们形成的微粒叫做四水合铜离子,可表示为[Cu(H2O)4]2+
CuSO4·5H2O晶体
思考:Cu2+与H2O结合显蓝色,它们是怎么结合的?
教学过程
教学过程
配位键
由一个原子单方面提供孤电子对,而另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
O
H
H
H
H
孤电子对
Cu2+
具有空轨道
Cu2+
OH2
H2O
H2O
H2O
配位键
教学过程
配位键
由一个原子单方面提供孤电子对,而另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
表示方法:
配位键常用A—B或A→B表示,其中A是提供孤电子对的原子,叫给予体,B是接受孤电子对的原子,叫接受体。
Cu
OH2
H2O
H2O
2+
OH2
Cu
OH2
H2O
H2O
2+
OH2
(电子对给予体)A→B(电子对接受体)或A—B。
教学过程
配位键
形成条件:
①成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
②多个原子有孤电子对,电负性小的提供;如CO、CN-、SCN-
③成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。
Cl
C
N
感 谢 倾 听
第二节 配合物与超分子
第1课时 配合物
人教版选择性必修2
榆次一中 李金虎
学习目标
1.通过熟悉的无水硫酸铜与其溶液颜色不同这一现象,认识配位键的特征,并能与共价键进行简单比较。
2.在配位键的基础上,认识配合物的存在、结构特点及常见配合物的制取等。
学习目标
1.能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。培养学生“宏观辨识与微观辨析”的学科素养。
2.能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。培养学生“证据推理与模型认知”的学科素养。
素养目标
情境引入
卟啉配合物叶绿素的
结构示意图
已知的配合物种类繁多,新的配合物由于纷繁复杂的有机化合物配体而层出不穷,使得无机化合物的品种迅速增长。叶绿素、血红素和维生素B12都是配合物,它们的配体大同小异,是一种称为卟啉的大环有机化合物,而中心离子分别是镁离子、亚铁离子和钴离子。
实验探究
一、配合物
探究:下表中的少量固体溶于足量的水,观察实验现象并填写表格。
实验探究
教学过程
教学过程
固体 ①CuSO4 ②CuCl2·2H2O ③CuBr2 ④NaCl ⑤K2SO4 ⑥KBr
白色 绿色 深褐色 白色 白色 白色
哪些溶液呈天蓝色
实验说明什么离子呈天蓝色,什么离子没有颜色
固态二价铜盐不一定显蓝色,Cu2+在水溶液中常显蓝色;
Na+、K+、SO42- 、Cl-、Br-没有颜色;
天蓝色
天蓝色
天蓝色
无色
无色
无色
教学过程
溶液呈天蓝色与Cu2+和H2O有关,他们形成的微粒叫做四水合铜离子,可表示为[Cu(H2O)4]2+
CuSO4·5H2O晶体
思考:Cu2+与H2O结合显蓝色,它们是怎么结合的?
教学过程
教学过程
配位键
由一个原子单方面提供孤电子对,而另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
O
H
H
H
H
孤电子对
Cu2+
具有空轨道
Cu2+
OH2
H2O
H2O
H2O
配位键
教学过程
配位键
由一个原子单方面提供孤电子对,而另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
表示方法:
配位键常用A—B或A→B表示,其中A是提供孤电子对的原子,叫给予体,B是接受孤电子对的原子,叫接受体。
Cu
OH2
H2O
H2O
2+
OH2
Cu
OH2
H2O
H2O
2+
OH2
(电子对给予体)A→B(电子对接受体)或A—B。
教学过程
配位键
形成条件:
①成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
②多个原子有孤电子对,电负性小的提供;如CO、CN-、SCN-
③成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。
Cl
C
N
感 谢 倾 听
