3-4配合物(教学课件)-高中化学人教版(2019)选择性必修2(共30张PPT)
文档属性
| 名称 | 3-4配合物(教学课件)-高中化学人教版(2019)选择性必修2(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 725.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 00:00:00 | ||
图片预览








文档简介
(共30张PPT)
第 四 节 配 合 物 与 超 分 子
第 一 课时
配合物
第三章晶体结构和性质
学习目标
1、知道配位键的特点,认识简单的配位化合物的成键特征,能 举例说明某些配位化合物的典型性质、存在与应用。
2、认识配位键与共价键、离子键的异同,能能运用配位键解释 某些沉淀溶解、颜色变化等实验现象。
CuCl 溶液
CuSO 溶 液 CuBr 溶液
天蓝色
无色
NaCl溶液
K SO 溶 液 NaBr 溶液
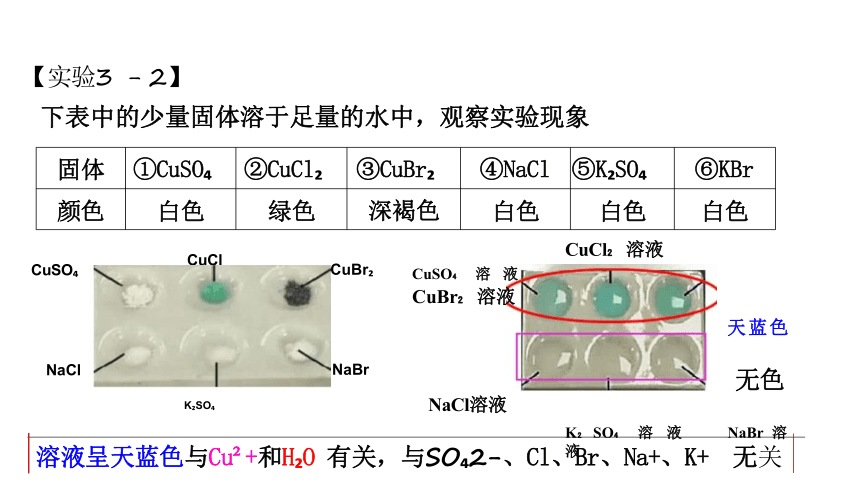
固体 ①CuSO ②CuCl ③CuBr ④NaCl ⑤K SO
⑥KBr
颜色 白色 绿色 深褐色 白色 白色
白色
【实验3 - 2】
下表中的少量固体溶于足量的水中,观察实验现象
溶液呈天蓝色与Cu +和H O 有关,与SO 2-、Cl、Br、Na+、K+ 无关
CuBr
NaBr
CuCl
CuSO
NaCl
K SO
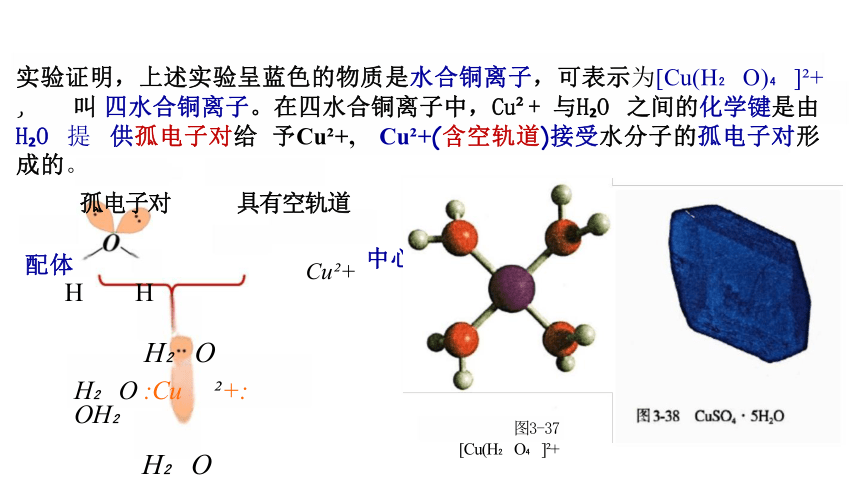
实验证明,上述实验呈蓝色的物质是水合铜离子,可表示为[Cu(H O) ] + , 叫 四水合铜离子。在四水合铜离子中,Cu + 与H O 之间的化学键是由H O 提 供孤电子对给 予Cu +, Cu +(含空轨道)接受水分子的孤电子对形成的。
孤电子对 具有空轨道
配体 Cu + 中心离子
H H
H O
H O :Cu +: OH
H O
图3-37 [Cu(H O ] +
一 、配位键
1、概念 成键原子或离子一方提供空轨道,另一方提供孤电子对而形成
的,这类“电子对给予-接受”键被称为配位键。
2、形成条件
①成键原子一方能提供孤电子对。如分子有NH 、H O 、HF 、CO 等; 离子有Cl- 、OH- 、CN- 、SCN- 等。
②成键原子另 一方能提供空轨道。如H+ 、Al + 、B 及过渡金属的原子
或离子。
H
H:F:
H:O:
[: :[:C::
H
H:N:H
3、特 点 配位键是一种特殊的共价键,同样具有饱和性和方向性。 一
般来说,多数过渡金属的原子或离子形成配位键的数目是基 本不变的,如Ag+形成2个配位键;Cu +形成4个配位键等。
4 、表 示 方 法 (电子对给予体)A→B(电子对接受体)或A—B。
或
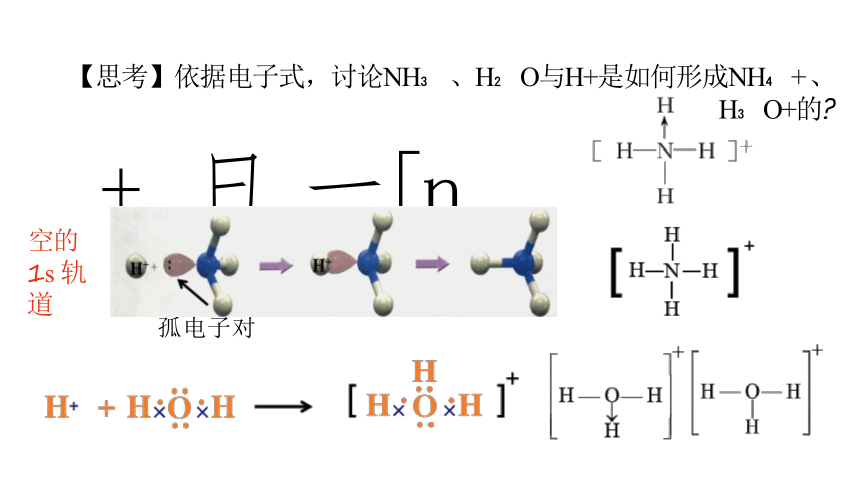
【思考】依据电子式,讨论NH 、H O与H+是如何形成NH + 、H O+的
+ 日 一[n
孤电子对
空的1s 轨道
课堂练习1、下列粒子中含配位键的是( C)
①N H +②CH ③OH-④NH +⑤Fe(CO) ⑥Fe(SCN) ⑦H O+
⑧Ag(NH ) OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D、全 部
课堂练习2、化合物NH 与BF 可以通过配位键形成NH ·BF 。
(1)配位键的形成条件 是形成配位键的 一 方能够提供孤电子对,另 一 方 能够提供空轨道 。
(2)在NH ·BF 中 ,氮(或N)_ 原子提供孤电子对, 硼(或B)_ 原子接受电子。
二、配合物
1、概念 通常由金属离子或原子(称为中心离子或原子)与某些分子或
离子(称为配位体或配体) 以配位键结合形成的化合物,简称
配合物 如 :[Ag(NH ) ]OH 、[Cu(NH ) ]SO
2、组成
[Cu(NH ) ]SO
中心离子 配体 配位数 离子(外界)
配离子(内界)
[Cu(NH ) ]SO =[Cu(NH ) ] ++SO 2-
配合物溶于水易电离为内界
配离子和外界离子,内界配 离子一般很稳定,不易电离。
有些配合物不存在外界
(1)中心原子(离子):
提供空轨道的金属离子或原子。 一般是过渡金属,必须有空轨道。
(2)配位体:
含有孤电子对的分子或离子NH H O CO Cl- SCN- CN-
(3)配位原子:
配位体中具有孤电子对原子N O P S,一 般是VA VI A VIA的非金属原子
(4)配位数:直接同中心原子配位的原子数目,一般是2、4、6、8
(5)配离子的电荷:等于中心离子和配体总电荷的代数和,如:[Fe(SCN) ]3-
课堂练习3、正误判断
(1)配位键实质上是一种特殊的共价键( √)
(2)提供孤电子对的微粒既可以是分子,也可以是离子(
(3)有配位键的化合物就是配位化合物(×)
(4)配位化合物都很稳定(×)
(5)在配合物[Co(NH ) Cl]Cl 中的Cl- 均可与AgNO 反应生成AgCl沉淀(X)
(6)Ni(CO) 是配合物,它是由中心原子与配体构成的(
提示:NH Cl中含配位键,但不是配位化合物。配合物一定含有配位键
配合物 内界 外界 中心粒子 配位体
配位数
[Ag(NH ) ]OH 氢氧化二氨合银 [Ag(NH ) ]+ OH- Ag+ NH
2
K [Fe(CN) ] 六氰合铁酸钾 [Fe(CN) ] - K+ Fe + CN-
6
[Co(NH ) Cl]Cl [Co(NH ) Cl] + Cl- Co + NH 、Cl-
6
Ni(CO) 四羰基镍 Ni(CO) 无 Ni CO
4
课堂练习4、完成下表:
难溶物溶解
得到深蓝色透明溶液
析出深蓝 色的晶体
产生蓝色
难溶物
【实验3-3】
95%
乙醇
氨水
氨水
[Cu(NH ) ] ++SO -+H O=[Cu(NH ) ]SO ·H O
溶剂极性:乙醇<水、[Cu( NH ) ]SO · H O在乙醇中的溶解度小
实验结论及有关方程式
CuSO +2 NH ·H O=Cu(OH) ↓+(NH ) SO
Cu(OH) +4 NH ·H O=[Cu(NH ) ](OH) +4 H O
提示:H O 、NH 同为中性分子,但电负性N<0,N 比O更容易给出孤
对电子,与Cu + 形成的配位键更强。
配位键的强度有大有小,有的配合物较稳定,有的配合物较不稳定。通
常情况,较稳定的配合物可以转化为稳定性更强的配合物
[Cu(H O ] +→Cu(OH) —→ [Cu(NH ) ] +
【思考】上述实验完成了四水合铜离子向四氨合铜离子的转化,Cu +与
NH 形成的配位键和Cu +与H O形成的配位键哪个稳定 从结构角度解释。
稳定性:
Cu ++4NH =[Cu(NH ) ] +
平衡向左移动
4NH +
[Cu(NH ) ] ++4H+=Cu ++4NH +
【思考】向上述实验深蓝色的透明溶液中逐滴滴加稀硫酸会有什么现象
写出反应方程式
和 5 0蓝色沉淀具 3 0深蓝色溶液
CuSO (aq)
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe +;
又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术
Fe ++nSCN-=[Fe(SCN)n] -n
n=1-6, 随 SCN-的浓度而异
配位数可为1—6
【实验3-4】
KSCN溶液
血红色 溶液
0
0
一
FeCl 溶液
实验步骤 实验现象
解释
少 两滴 两滴 FeCl (aq) KSCN(aq) 溶液变为 红色
生成
[Fe(SCN)n] -n (n=1~
两滴 两滴 量 K [Fe(CN) ](aq) KSCN(aq) 水 无明显现象
[Fe(CN) ] -
很难电离出Fe3+
写出K [Fe(CN) ]的电离方程式 K [Fe(CN) ]=3K++[Fe(CN) ] -
配离子[Fe(CN) -的中心离子Fe +、配体CN-、配位数6、 [Fe(CN)
Fe +性质不一样
在一定条 件下,配 位键比较 稳定,配 离子不易 发生电离。
【演示实验】课本104页实验2简单离子和配离子的区别
量 水
NaCl 溶 液 Cl沉淀 澄清
Ag++Cl-=AgCl
AgCl+2NH =[Ag(NH ) ]Cl
【实验3-5】
【思考】用平衡常数分析AgCl+2NH =[Ag(NH ) ]C l反应的实质
已知:AgCl 的溶度积常数Kp=1.8×10-10
[Ag(NH ) ]+的稳定常数]
AgCl+2NH =[Ag(NH ) ]++Cl- 反应平衡常数:
从平衡常数可知,选择氨水浓度较大为宜。若在上述[Ag(NH ) ]Cl 溶液中
加入Br, 则产生浅黄色的AgBr沉淀,因为AgBr的溶度积常数 Ksp=5.0×10-13非常小,AgBr仅微溶于浓氨水。
【思考】怎样配制银氨溶液 发生哪些反应
向AgNO 溶液中逐滴加稀氨水,直到最初生成的沉淀恰好溶解为止。
氨水呈弱碱性,滴入AgNO 溶液中,会形成AgOH白色沉淀,
Ag++NH ·H O=AgOHJ+NH +
继续滴加氨水时,NH 分子与Ag+形成[Ag(NH ) ]+配合离子,配合离子很 稳定,会使AgOH逐渐溶解。
AgOH+2NH ·H O=[Ag(NH ) ]++OH-+2H O
课堂练习5、下列过程与配合物的形成无关的是 ( A )
A. 除去Fe粉中的SiO 可用强碱溶液
B. 向一定量的AgNO 溶液中加入氨水至沉淀消失
C. 向Fe +溶液中加入KSCN溶液
D. 向一定量的CuSO 溶液中加入氨水至沉淀消失
课堂练习6、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,
继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象的说 法正确的是( A )
A. 沉淀溶解后,生成深蓝色的配合离子[Cu(NH ) ] +
B.[Cu(H O) ] + 比[Cu(NH ) ] +中的配位键稳定
C. 用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
D. 在[Cu(NH ) ] +中 ,Cu + 给出孤电子对,NH 提供空轨道
定义 “电子对给予—接受键”
配位键的形成条件
一 方提供空轨道
定义
配合物的组成
几个形成配合物的实验
一 、配位键
二、配合物
课堂小结
一 方提供孤电子对
课堂达标
1 、若 X 、Y两种粒子之间可形成配位键,则下列说法正确的是( C )
A.X、Y 只能是分子
B.X 、Y 只能是离子
C. 若 X提供空轨道,则Y至少要提供一对孤电子对 D 、若 X提供空轨道,则配位键表示为X→Y
2、下列不能形成配位键的组合是( D )
A.Ag+ 、NH B.H O 、H+
C.Co + 、CO D.Ag+ 、H+
3、下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是
( D )①H O ②NH ③F-④CN- ⑤CO
A.①② B.①②③
C.①②④ D.①②③④⑤
5 、下列各种说法中错误的是( D )
A 、形成配位键的条件是一方有空轨道一方有孤对电子 B 、配位键是一种特殊的共价键
C、 配位化合物中的配体可以是分子也可以是阴离子
D、共价键的形成条件是成键原子必须有未成对电子
6 、0.01mol氯化铬CrCl ·6H O) 在水溶液中用过量的硝酸银溶液处理,
产生0.02molAgCl沉淀。此氯化铬最可能是 (B)
A.[Cr(H O) ]Cl
B.[Cr(H O) Cl]Cl ·H O
C.[Cr(H O) Cl ]Cl-2H O
D.[Cr(H O) Cl ]·3H O
7. 回答下列问题:
(1)配合物[Ag(NH ) ]OH 的中心离子 是Ag+, 配位原子 是N, 配位数 是2 》
它的电离方程式 是[Ag(NH ) ]OH===[Ag(NH ) ]++OH。
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO 溶液,再加入氨水,观察 到的现象 是先产生白色沉淀,加入氨水后,白色沉淀溶解 0
(3)Zn的氯化物与氨水反应可形成配合物[Zn(NH ) ]Cl ,1 mol该配合物中 含有σ键的数目 为16NA 0
(4)关于配合物[Zn(NH ) ]Cl 的说法正确的是 0
A. 配位数为6 B. 配体为NH 和Cl-
C.[Zn(NH ) ] +为内界 D.Zn + 和NH 以离子键结合
第 四 节 配 合 物 与 超 分 子
第 一 课时
配合物
第三章晶体结构和性质
学习目标
1、知道配位键的特点,认识简单的配位化合物的成键特征,能 举例说明某些配位化合物的典型性质、存在与应用。
2、认识配位键与共价键、离子键的异同,能能运用配位键解释 某些沉淀溶解、颜色变化等实验现象。
CuCl 溶液
CuSO 溶 液 CuBr 溶液
天蓝色
无色
NaCl溶液
K SO 溶 液 NaBr 溶液
固体 ①CuSO ②CuCl ③CuBr ④NaCl ⑤K SO
⑥KBr
颜色 白色 绿色 深褐色 白色 白色
白色
【实验3 - 2】
下表中的少量固体溶于足量的水中,观察实验现象
溶液呈天蓝色与Cu +和H O 有关,与SO 2-、Cl、Br、Na+、K+ 无关
CuBr
NaBr
CuCl
CuSO
NaCl
K SO
实验证明,上述实验呈蓝色的物质是水合铜离子,可表示为[Cu(H O) ] + , 叫 四水合铜离子。在四水合铜离子中,Cu + 与H O 之间的化学键是由H O 提 供孤电子对给 予Cu +, Cu +(含空轨道)接受水分子的孤电子对形成的。
孤电子对 具有空轨道
配体 Cu + 中心离子
H H
H O
H O :Cu +: OH
H O
图3-37 [Cu(H O ] +
一 、配位键
1、概念 成键原子或离子一方提供空轨道,另一方提供孤电子对而形成
的,这类“电子对给予-接受”键被称为配位键。
2、形成条件
①成键原子一方能提供孤电子对。如分子有NH 、H O 、HF 、CO 等; 离子有Cl- 、OH- 、CN- 、SCN- 等。
②成键原子另 一方能提供空轨道。如H+ 、Al + 、B 及过渡金属的原子
或离子。
H
H:F:
H:O:
[: :[:C::
H
H:N:H
3、特 点 配位键是一种特殊的共价键,同样具有饱和性和方向性。 一
般来说,多数过渡金属的原子或离子形成配位键的数目是基 本不变的,如Ag+形成2个配位键;Cu +形成4个配位键等。
4 、表 示 方 法 (电子对给予体)A→B(电子对接受体)或A—B。
或
【思考】依据电子式,讨论NH 、H O与H+是如何形成NH + 、H O+的
+ 日 一[n
孤电子对
空的1s 轨道
课堂练习1、下列粒子中含配位键的是( C)
①N H +②CH ③OH-④NH +⑤Fe(CO) ⑥Fe(SCN) ⑦H O+
⑧Ag(NH ) OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D、全 部
课堂练习2、化合物NH 与BF 可以通过配位键形成NH ·BF 。
(1)配位键的形成条件 是形成配位键的 一 方能够提供孤电子对,另 一 方 能够提供空轨道 。
(2)在NH ·BF 中 ,氮(或N)_ 原子提供孤电子对, 硼(或B)_ 原子接受电子。
二、配合物
1、概念 通常由金属离子或原子(称为中心离子或原子)与某些分子或
离子(称为配位体或配体) 以配位键结合形成的化合物,简称
配合物 如 :[Ag(NH ) ]OH 、[Cu(NH ) ]SO
2、组成
[Cu(NH ) ]SO
中心离子 配体 配位数 离子(外界)
配离子(内界)
[Cu(NH ) ]SO =[Cu(NH ) ] ++SO 2-
配合物溶于水易电离为内界
配离子和外界离子,内界配 离子一般很稳定,不易电离。
有些配合物不存在外界
(1)中心原子(离子):
提供空轨道的金属离子或原子。 一般是过渡金属,必须有空轨道。
(2)配位体:
含有孤电子对的分子或离子NH H O CO Cl- SCN- CN-
(3)配位原子:
配位体中具有孤电子对原子N O P S,一 般是VA VI A VIA的非金属原子
(4)配位数:直接同中心原子配位的原子数目,一般是2、4、6、8
(5)配离子的电荷:等于中心离子和配体总电荷的代数和,如:[Fe(SCN) ]3-
课堂练习3、正误判断
(1)配位键实质上是一种特殊的共价键( √)
(2)提供孤电子对的微粒既可以是分子,也可以是离子(
(3)有配位键的化合物就是配位化合物(×)
(4)配位化合物都很稳定(×)
(5)在配合物[Co(NH ) Cl]Cl 中的Cl- 均可与AgNO 反应生成AgCl沉淀(X)
(6)Ni(CO) 是配合物,它是由中心原子与配体构成的(
提示:NH Cl中含配位键,但不是配位化合物。配合物一定含有配位键
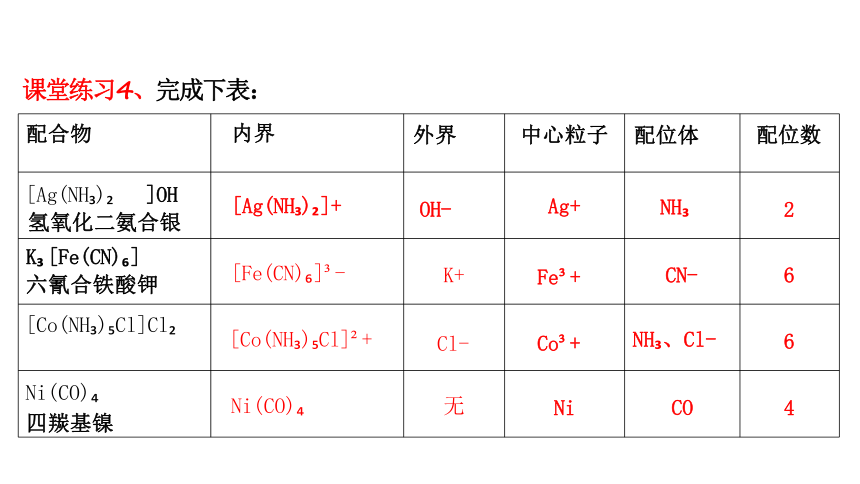
配合物 内界 外界 中心粒子 配位体
配位数
[Ag(NH ) ]OH 氢氧化二氨合银 [Ag(NH ) ]+ OH- Ag+ NH
2
K [Fe(CN) ] 六氰合铁酸钾 [Fe(CN) ] - K+ Fe + CN-
6
[Co(NH ) Cl]Cl [Co(NH ) Cl] + Cl- Co + NH 、Cl-
6
Ni(CO) 四羰基镍 Ni(CO) 无 Ni CO
4
课堂练习4、完成下表:
难溶物溶解
得到深蓝色透明溶液
析出深蓝 色的晶体
产生蓝色
难溶物
【实验3-3】
95%
乙醇
氨水
氨水
[Cu(NH ) ] ++SO -+H O=[Cu(NH ) ]SO ·H O
溶剂极性:乙醇<水、[Cu( NH ) ]SO · H O在乙醇中的溶解度小
实验结论及有关方程式
CuSO +2 NH ·H O=Cu(OH) ↓+(NH ) SO
Cu(OH) +4 NH ·H O=[Cu(NH ) ](OH) +4 H O
提示:H O 、NH 同为中性分子,但电负性N<0,N 比O更容易给出孤
对电子,与Cu + 形成的配位键更强。
配位键的强度有大有小,有的配合物较稳定,有的配合物较不稳定。通
常情况,较稳定的配合物可以转化为稳定性更强的配合物
[Cu(H O ] +→Cu(OH) —→ [Cu(NH ) ] +
【思考】上述实验完成了四水合铜离子向四氨合铜离子的转化,Cu +与
NH 形成的配位键和Cu +与H O形成的配位键哪个稳定 从结构角度解释。
稳定性:
Cu ++4NH =[Cu(NH ) ] +
平衡向左移动
4NH +
[Cu(NH ) ] ++4H+=Cu ++4NH +
【思考】向上述实验深蓝色的透明溶液中逐滴滴加稀硫酸会有什么现象
写出反应方程式
和 5 0蓝色沉淀具 3 0深蓝色溶液
CuSO (aq)
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe +;
又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术
Fe ++nSCN-=[Fe(SCN)n] -n
n=1-6, 随 SCN-的浓度而异
配位数可为1—6
【实验3-4】
KSCN溶液
血红色 溶液
0
0
一
FeCl 溶液
实验步骤 实验现象
解释
少 两滴 两滴 FeCl (aq) KSCN(aq) 溶液变为 红色
生成
[Fe(SCN)n] -n (n=1~
两滴 两滴 量 K [Fe(CN) ](aq) KSCN(aq) 水 无明显现象
[Fe(CN) ] -
很难电离出Fe3+
写出K [Fe(CN) ]的电离方程式 K [Fe(CN) ]=3K++[Fe(CN) ] -
配离子[Fe(CN) -的中心离子Fe +、配体CN-、配位数6、 [Fe(CN)
Fe +性质不一样
在一定条 件下,配 位键比较 稳定,配 离子不易 发生电离。
【演示实验】课本104页实验2简单离子和配离子的区别
量 水
NaCl 溶 液 Cl沉淀 澄清
Ag++Cl-=AgCl
AgCl+2NH =[Ag(NH ) ]Cl
【实验3-5】
【思考】用平衡常数分析AgCl+2NH =[Ag(NH ) ]C l反应的实质
已知:AgCl 的溶度积常数Kp=1.8×10-10
[Ag(NH ) ]+的稳定常数]
AgCl+2NH =[Ag(NH ) ]++Cl- 反应平衡常数:
从平衡常数可知,选择氨水浓度较大为宜。若在上述[Ag(NH ) ]Cl 溶液中
加入Br, 则产生浅黄色的AgBr沉淀,因为AgBr的溶度积常数 Ksp=5.0×10-13非常小,AgBr仅微溶于浓氨水。
【思考】怎样配制银氨溶液 发生哪些反应
向AgNO 溶液中逐滴加稀氨水,直到最初生成的沉淀恰好溶解为止。
氨水呈弱碱性,滴入AgNO 溶液中,会形成AgOH白色沉淀,
Ag++NH ·H O=AgOHJ+NH +
继续滴加氨水时,NH 分子与Ag+形成[Ag(NH ) ]+配合离子,配合离子很 稳定,会使AgOH逐渐溶解。
AgOH+2NH ·H O=[Ag(NH ) ]++OH-+2H O
课堂练习5、下列过程与配合物的形成无关的是 ( A )
A. 除去Fe粉中的SiO 可用强碱溶液
B. 向一定量的AgNO 溶液中加入氨水至沉淀消失
C. 向Fe +溶液中加入KSCN溶液
D. 向一定量的CuSO 溶液中加入氨水至沉淀消失
课堂练习6、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,
继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象的说 法正确的是( A )
A. 沉淀溶解后,生成深蓝色的配合离子[Cu(NH ) ] +
B.[Cu(H O) ] + 比[Cu(NH ) ] +中的配位键稳定
C. 用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
D. 在[Cu(NH ) ] +中 ,Cu + 给出孤电子对,NH 提供空轨道
定义 “电子对给予—接受键”
配位键的形成条件
一 方提供空轨道
定义
配合物的组成
几个形成配合物的实验
一 、配位键
二、配合物
课堂小结
一 方提供孤电子对
课堂达标
1 、若 X 、Y两种粒子之间可形成配位键,则下列说法正确的是( C )
A.X、Y 只能是分子
B.X 、Y 只能是离子
C. 若 X提供空轨道,则Y至少要提供一对孤电子对 D 、若 X提供空轨道,则配位键表示为X→Y
2、下列不能形成配位键的组合是( D )
A.Ag+ 、NH B.H O 、H+
C.Co + 、CO D.Ag+ 、H+
3、下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是
( D )①H O ②NH ③F-④CN- ⑤CO
A.①② B.①②③
C.①②④ D.①②③④⑤
5 、下列各种说法中错误的是( D )
A 、形成配位键的条件是一方有空轨道一方有孤对电子 B 、配位键是一种特殊的共价键
C、 配位化合物中的配体可以是分子也可以是阴离子
D、共价键的形成条件是成键原子必须有未成对电子
6 、0.01mol氯化铬CrCl ·6H O) 在水溶液中用过量的硝酸银溶液处理,
产生0.02molAgCl沉淀。此氯化铬最可能是 (B)
A.[Cr(H O) ]Cl
B.[Cr(H O) Cl]Cl ·H O
C.[Cr(H O) Cl ]Cl-2H O
D.[Cr(H O) Cl ]·3H O
7. 回答下列问题:
(1)配合物[Ag(NH ) ]OH 的中心离子 是Ag+, 配位原子 是N, 配位数 是2 》
它的电离方程式 是[Ag(NH ) ]OH===[Ag(NH ) ]++OH。
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO 溶液,再加入氨水,观察 到的现象 是先产生白色沉淀,加入氨水后,白色沉淀溶解 0
(3)Zn的氯化物与氨水反应可形成配合物[Zn(NH ) ]Cl ,1 mol该配合物中 含有σ键的数目 为16NA 0
(4)关于配合物[Zn(NH ) ]Cl 的说法正确的是 0
A. 配位数为6 B. 配体为NH 和Cl-
C.[Zn(NH ) ] +为内界 D.Zn + 和NH 以离子键结合
