高中化学人教版(2019)选择性必修2课件第1章第2节基础课时4元素周期律(共66张PPT)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修2课件第1章第2节基础课时4元素周期律(共66张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 305.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 00:00:00 | ||
图片预览











文档简介
(共66张PPT)
第一章原子结构与性质
第二节 原子结构与元素的性质
基础课时4 元素周期律
学 习 任 务
1.能从原子结构的角度理解原子半径、电离能、电负性的
递变规律。
2.通过原子半径、电离能、电负性递变规律的学习,建立 “结构决定性质”的认知模型,并能利用该认知模型解释 元素性质的规律性和特殊性。
N0.1
必备知识 · 自主预习储备
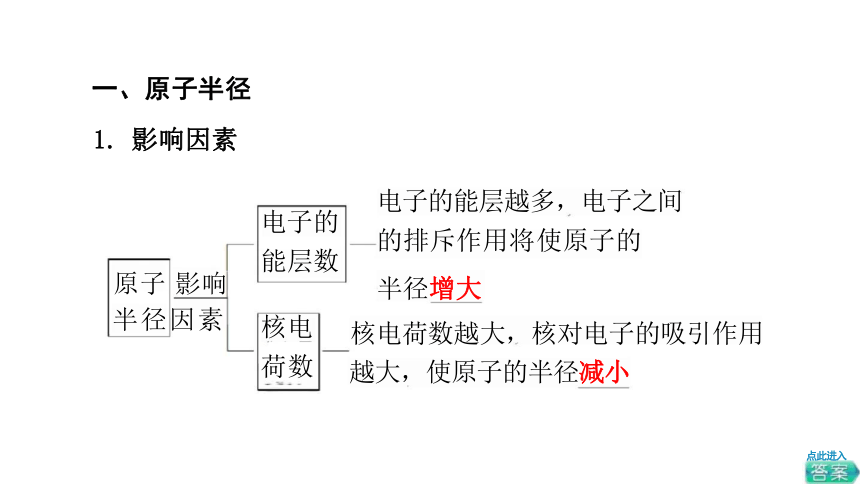
电子的能层越多,电子之间
的排斥作用将使原子的
半径增大
核电荷数越大,核对电子的吸引作用 越大,使原子的半径减小
电子的
能层数
核电
荷数
一、原子半径
1. 影响因素
原子 影响 半径因素
点此进入
2. 递变规律
(1)同周期:从左到右,核电荷数越大,半径越小(稀有气体除
外)。
(2)同主族:从上到下,电 子 层 数越多,半径越大。
点此进入
提示:①不同周期不同主族元素原子半径比较,先看周期再看
主族。②对于离子的半径比较,要借助于电子层结构相同的离子半 径变化规律和元素周期律进行判断。③同一元素的阳离子半径小于 原子半径;阴离子半径大于原子半径。
分析粒子半径大小比较的关键是什么
想一想
A.K>Na>Li B.Na+>Mg +>AI +
C.Mg +>Na+>F- D.CI~>F~>F
C [同一主族元素的原子,从上到下原子半径逐渐增大,A 项 正确;核外电子排布相同的离子,核电荷数越大,半径越小,B项 正确;半径大小应为Mg +F~;F- 比F多一个电子,故半径:F >F,D 项 正确。]
点此进入
解析答案
下列有关粒子半径的大小比较错误的是( )
练 一 练
二、电离能
1. 电离能的概念
气态电中性基态原子失去一个电子转化为气态基态正离子所需
要的最低能量叫做第一电离能。
点此进入
2. 元素的第一电离能变化规律
(1)对同一周期的元素而言,第 一种(碱金属和氢) 元素的第一 电离能最小,最后 一种(稀有气体)元素的第一电离能最大;从左 到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示 元素原子越来越难失去电子。
(2)同族元素,自上而下第一电离能变小,表明自上而下原子越 来越易失去电子。
点此进入
3. 电离能的应用
可以衡量元素的原子失去一个电子的难易程度。第一电离能数
值 越小,原子越容易失去一个电子,元素金属性越强。
点此进入
练一练 下列各组原子中,前者第一电离能大于后者第一电
离能的是( )
A.S 和P B.Mg 和Al
C.Na 和Mg D.Ne 和He
点此进入
B [S和P的价层电子排布式分别为3s 3p 和3s 3p ,由于P原子
的3p能级处于半充满状态,较稳定,所以I (S)I (He)>I (Ne) 。]
三、电负性
1. 键合电子和电负性的含义
(1)键合电子:元素相互化合时,原子中用于形成化学键的电 子。
(2)电负性:用来描述不同元素的原子对键合电子吸引力的大 小。电负性越大的原子,对键合电子的吸引力越大。
点此进入
2. 衡量标准
以氟的电负性为4.0 和锂的电负性为1.0_作为相对标准,得出 各元素的电负性(稀有气体未计)。
3. 递变规律(一般情况)
(1)同周期,自左到右,元素的电负性逐渐变大。
(2)同主族,自上到下,元素的电负性逐渐变小。
点此进入
一般大于1.8 元素为非金属元素,且电负性越大,非金属 性越 强
依 一般小于1.8 元素为金属元素,且电负性越小,金属性 据 越 强
1.8左右 一般位于金属元素和非金属元素的交界线
处,它们既有金属性,又有非金属 性
4. 应用:判断金属性、非金属性强弱
点此进入
练一练 下列对电负性的理解不正确的是( )
A. 电负性是人为规定的一个相对数值,不是绝对标准
B. 元素电负性的大小反映了元素原子对键合电子吸引力的大小 C.根据电负性的大小,可判断化合物XY 中两元素化合价的正负 D. 元素的电负性是元素固有的性质,与原子结构无关
点此进入
D [电负性是人为规定的一个相对数值,不是绝对标准,A 项
正确;元素电负性的大小反映了元素原子对键合电子吸引力的大
小 ,B项正确;元素的电负性越大,则元素的非金属性越强,反之 则元素的金属性越强,故在化合物XY中电负性大的元素显负价,电 负性小的元素显正价,C项正确;一般来说,同周期元素从左到
右,元素的电负性逐渐增大,同族元素从上到下,元素的电负性逐 渐减小,因此电负性与原子结构有关,D 项错误。]
关键能力 ·情境探究达成
学习任务1
学习任务2
[情境素材]
前四周期元素第一电离能(I )的变化如图所示。
电离能规律及其应用
学习任务1
[问题1] 据图可知,第ⅡA 族和VA 族元素的第一电离能比同
周期的相邻元素都高,解释原因。
提示:同周期中,第ⅡA 族元素的价层电子排布为ns ,第VA 族元素的价层电子排布为ns np ,np 轨道分别为全空和半充满状
态,比较稳定,所以失去一个电子需要的能量大,所以第一电离能 比同周期相邻元素的要高。
[合作探究]
[问题2]根据Na 、Mg 、Al的电离能数据,回答:
①为什么同一元素的电离能逐级增大
②为什么Na、Mg、Al 的化合价分别为+1、+2、+3
提示:①同一元素的逐级电离能是逐渐增大的,即I < ……这是由于原子失去一个电子变成+1价阳离子后,半径变
小,核电荷数未变而电子数目变少,核对电子的吸引作用增强,因 此第二个电子比第一个电子难失去,失去第二个电子比失去第一个 电子需要更多的能量。同理I >I 、I >I ……In+1>In。
②Na的I 比I 小很多,电离能差值很大,说明失去第一个电子
比失去第二个电子容易得多,所以Na 容易失去一个电子形成+1价 离子;Mg的I 和I 相差不多,而I 比I 小很多,所以Mg容易失去两 个电子形成+2价离子;Al的I 、I 、I 相差不多,而I 比I 小很多, 所以Al容易失去三个电子形成+3价离子。
1. 第一电离能与原子核外电子排布的关系
(1)第一电离能的变化与元素原子的核外电子排布有关。通常情
况下,当原子核外电子排布在能量相等的轨道上形成全空(p 、d 、 f) 、 半 满(p 、d 、f) 和全满(p 、d 0 、fl )结构时,原子的能量较 低,该元素具有较大的第一电离能。例如P的第一电离能比S的大,
Mg 的第一电离能比Al的大。
[归纳总结]
(2)第三周期元素第一电离能的大小关系为I (Ar)>I (Cl)>
I (P)>I (S)>I (Si)>I (Mg)>I (Al)>I (Na)。
2. 电离能的应用
(1)比较元素金属性的强弱。
一般情况下,元素的第一电离能越小,元素的金属性越强。
(2)确定元素原子的核外电子层排布。
由于电子是分层排布的,内层电子比外层电子难失去,因此当 元素原子失去不同能层的电子时电离能会发生突变。
(3)确定元素的化合价。
如果电离能在In与In+1之间发生突变,则元素的原子易形成+n 价 离子,或主族元素的最高化合价为+n价。某元素的逐级电离能 若I >I , 则该元素通常显+1价;若I >I >I , 则该元素通常显十2 价;若I >I >I >I , 则该元素通常显+3价。
1. 某主族元素的第一、二、三、四电离能依次为899 kJ·mol- 、
17 57 kJ·mol- 、14840 kJ·mol- 、18025 kJ·mol- ,则该元素在元素 周期表中位于( )
A. 第 I A族 B. 第ⅡA族 C. 第 ⅢA族 D. 第 IVA族
B [该元素的第一、二电离能较小,第三电离能剧增,说明该
元素原子易失去2个电子,其最外层电子数为2,该元素位于第ⅡA 族。]
点此进入
解析答案
[能力达成]
2.不同元素的气态原子失去最外层一个电子所需要的最低能
量,设其为E,如图所示。试根据元素在周期表中的位置,分析图 中曲线的变化特点,并完成下列问题。
E/kJ-mol-1
2500
2000
1500
1000
500
0
357911131517192123 原子序数
1012
738
496
2372
899
500
2084
1504
999
485
(1)同主族内不同元素的E 值的变化特点是 ---0
(2)同一周期内,随着原子序数的增大,E 值增大,但个别元素 的E值出现反常现象。试预测下列关系式中正确的是 (填编 号)。
①E(砷)>E(硒) ②E(砷)E( 硒 ) ④E(溴)< E(硒)
(3)估计1 mol气态钙原子失去最外层一个电子所需最低能量E值 的范围:(4)10号元素E值较大的原因是
[解析] 本题主要考查元素第一电离能的变化规律。
(1)从 H、3Li、11Na、19K等同主族元素可以看出,同主族元素 随着原子序数增大,E 值变小。(2)从第二、三周期看,第ⅢA族和 VIA 族元素比同周期相邻两元素E 值都低,可以推出E(砷)>E(硒)、 E(溴)>E(硒)。(3)据同主族、同周期元素E值变化规律可知,E(K)[答案] (1)随着原子序数增大,E 值变小
(2)①③
(3)485 738
(4)10号元素为氖,该元素原子的最外层电子排布已达到8电子 稳定结构
在化学中有一个概念,全世界的化学家和材料学家几乎每天都
会用到,它常被视为元素周期表中的“第三个维度”。研究人员已 经无数次地将它用于分子和材料的设计上。它衡量的是不同原子吸 引电子的能力。可以说,它是解释元素之间为什么会发生化学反
应,以及为何能形成具有不同性质的材料的重要基础。化学家曾无
电负性规律及其应用
[情境素材]
学习任务2
数次地尝试用不同的方法来定义和量化这一概念。瑞典化学家永
斯 · 贝采利乌斯在19世纪对它进行了研究。美国化学家莱纳斯 ·鲍林 将其定义为分子中原子吸引电子的能力,并提出了一个基于键能的 公式,这一定义至今仍然适用。
[问题1] “第三个维度”是什么
提示:电负性。根据材料可知,“第三个维度”衡量的是不同
原子吸引电子的能力,符合概念的是电负性。
[问题2] 根据化合物SiC、CCl 判 断 ,Si、C、Cl的“第三个维 度”由大到小的顺序是什么
提示:Cl>C>Si。
[合作探究]
[问题3] 根据铝元素和氯元素的“第三个维度”差值判断,
AICl 是离子化合物还是共价化合物 为什么
提示:共价化合物。Cl元素的电负性为3.0,Al 元素的电负性为 1.5,二者电负性的差值小于1.7,形成共价键,故AICl 是共价化合 物。
电负性的应用
1. 判断元素的金属性和非金属性
(1)金属元素的电负性一般小于1.8,非金属元素的电负性一般大 于1.8,而位于金属、非金属界线两侧的元素的电负性则在1.8左
右,它们既有金属性,又有非金属性。
(2)金属元素的电负性越小,金属元素越活泼;非金属元素的电 负性越大,非金属元素越活泼。
[归纳总结]
2. 判断元素的化合价
(1)电负性数值小的元素在化合物中吸引电子的能力弱,元素的 化合价为正值。
(2)电负性数值大的元素在化合物中吸引电子的能力强,元素的 化合价为负值。
3. 判断化学键的类型 一般认为:
(1)如果两个成键元素原子间的电负性差值大于1.7,它们之间通 常形成离子键。
(2)如果两个成键元素原子间的电负性差值小于1.7,它们之间通 常形成共价键。
在元素周期表中,某些主族元素与其右下方的主族元素(如图所
示)的有些性质是相似的,被称为“对角线规则”。
Li Be B
Mg Al
Si
4. 解释元素“对角线”规则
这可以由元素的电负性得到解释:Li、Mg 的电负性分别为
1.0 、1.2;Be 、Al 的电负性分别为1.5、1.5;B 、Si的电负性分别为 2.0、1.8。它们的电负性接近,说明它们对键合电子的吸引力相
当,它们表现出的性质相似,如Li 、Mg在空气中燃烧的产物分别为 Li O和MgO;Be(OH) 、Al(OH) 均属于难溶的两性氢氧化物;B、
Si的含氧酸都是弱酸等。
3 . (2021 ·福建漳州月考)下列各组元素按电负性大小排列正确
的是( )
A.F>N>0 B.0>Cl>F
C.As>P>N D.Cl>S>As
点此进入
解析答案
[能力达成]
D [电负性用来描述不同元素的原子对键合电子吸引力的大
小,它是一个相对数值,元素的电负性也有周期性变化。一般来 说,同周期元素从左到右(稀有气体元素除外),元素的电负性逐渐 增大;同族元素从上到下,元素的电负性逐渐减小。]
4. 碳、氧、硅、锗、氟、氯、溴、镍元素在化学中占有极其 重要的地位。
(1)第二周期中基态原子未成对电子数与Ni 相同且电负性较小的 元素是
(2)从电负性角度分析,碳、氧和硅元素的非金属性由强到弱的 顺序为
(3)CH 中共用电子对偏向C,SiH 中共用电子对偏向H, 则 C、
Si、H 的电负性由大到小的顺序为 。
( 4 ) 基 态 锗(Ge) 原 子 的 核 外 电 子 排 在 式 是 ,Ge 的最高
价氯化物的分子式是 。该元素可能的性质或应用有
(填标号)。
A. 是一种活泼的金属元素
B. 其电负性大于硫
C. 其单质可用作半导体材料
D. 锗的第一 电离能大于碳而电负性小于碳
(5)溴与氯以 (填“离子”或“共价”)键结合成BrCl,
BrC1分子中, 显正电性。BrCl 与水发生反应的化学方程 式为
[解析] (1)基态Ni原子的价层电子排布式为3d 4s ,原子中含有
2个未成对电子,第二周期元素基态原子中含有2个未成对电子的元 素有C和O, 而 O的电负性大于C。
(2)一般来说,同周期元素从左到右,元素的电负性逐渐变大,
同族元素从上到下,元素的电负性逐渐变小可知,电负性由大到小 的顺序为O>C>Si, 电负性越大,非金属性越强,则非金属性由强 到弱的顺序为O>C>Si。
(3)元素电负性越大,吸引键合电子能力越强,键合电子偏向于
该原子,根据题给分子中共用电子对偏向情况可推知电负性由大到 小的顺序为C>H>Si。
(4)锗是32号元素,其基态原子的核外电子排布式为
1s 2s 2p 3s 3p 3d 4s 4p 或[Ar]3d 4s 4p ;Ge的价层电子数为4, 则 最高价为+4,其氯化物分子式是GeCl 。Ge 是一种金属元素,但最 外层电子数为4,金属性不强,A 项错误;硫是较活泼的非金属元
素,电负性:S>Si>Ge, 故锗的电负性小于硫,B项错误;锗单质是 一种半导体材料,C 项正确;锗的电负性和第一电离能均小于碳,D 项错误。
(5)电负性:Br共价键,且Br显正电性;BrCl与水反应的化学方程式为BrCl十
H O===HCl+HBrO。
[答案](1)碳(或C)
(2)O>C>Si
(3)C>H>Si
(4)1s 2s 2p 3s 3p 3d 04s 4p 或[Ar]3d 04s 4p GeCl C
(5)共价 Br BrCl+H O===HCl+HBrO
规律总结
电负性是不同元素的原子对键合电子吸引力大小的量度,电负
性越大,非金属性越强。电负性的大小能用来判断元素之间的成键 类型,也可以用来判断元素化合价的正负。电负性相同或差值小的 非金属元素的原子之间形成的化学键主要是共价键,当电负性差值 为零时通常形成非极性共价键;差值不为零时,形成极性共价键; 而且差值越小,形成的共价键极性越弱。
内容 原子半径 第一电离能 电负性 元素 性质 决定
反映
内容:元素性质随原子序 数的递增呈周期性变化
知识脉络
元素性质
的周期性
变化
元素周期律
(表中位置)
反映
总结
结 构
学习效果 ·随堂评估自测
1. 下列化合物中阳离子半径和阴离子半径之比最大的是( )
A.LiI B.NaBr C.KCl D.CsF
D [若阳离子半径最大,阴离子半径最小,则化合物中阳离子 半径和阴离子半径之比最大。四种化合物中,阴离子中F- 半径最
小,而阳离子中Cs+半径最大,所以四种化合物中阳离子半径和阴 离子半径之比最大的是CsF。]
1 2 3 4 5
点此进入
解析答案
2.具有下列价层电子排布的同周期元素原子中,第一电离能
最小的是( )
A.ns np B.ns np C.ns np D.ns np
B [ns np 中np轨道处于半充满状态,ns np 中np轨道处于全 充满状态,均是能量较低的状态,不易失去电子;ns np 和ns np 比 较 ,ns np 更容易失去一个电子变成ns np ,因此其第一电离能最 小,故B项正确。]
点此进入
解析答案
3 4 5
2
1
3.下列是几种基态原子的电子排布式,电负性最大的原子是( )
A.1s 2s 2p
B.1s 2s 2p 3s 3p
C.1s 2s 2p 3s 3p
D.1s 2s 2p 3s 3p 4s
点此进入
解析答案
3
4 5
1 2
A [不同元素的原子吸引电子的能力大小可用电负性表示,元
素的非金属性越强其电负性越大。同一周期中的主族元素,电负性 随着原子序数的增大而增大;同一主族中,元素的电负性随着原子 序数的增大而减小。A是0元素,B 是P元 素 ,C是Si 元素,D是Ca元 素,非金属性最强的元素是0元素,即电负性最大的元素是O 元
素,故选A 。]
1 2 3 4 5
4.如图是第三周期11~17号元素某些性质变化趋势的柱形图,
下列有关说法中正确的是( )
A.y 轴表示的可能是基态的原子失去一个电子
所需要的最小能量 原子序数
B.y 轴表示的可能是原子在化合物中吸引电子
的能力
C.y 轴表示的可能是原子半径
D.y 轴表示的可能是形成基态离子转移的电子数
点此进入
解析答案
1 2 3
4
5
B [第三周期Mg (或P)的3p能级为全空(或半充满)状态,较为稳
定 ,Mg (或P)的第一电离能大于Al(或S), 故A 错误;同周期元素从 左到右,电负性逐渐增大,B 正确;同周期元素从左到右,原子序 数逐渐增大,原子半径逐渐减小,C错误;同周期金属元素形成基 态离子转移的电子数逐渐增多,非金属元素形成基态离子所需要的 电子数逐渐减少,D 错误。]
1 2 3 4 5
(1)上表第三周期中第一电离能(I )最大的是 (填字母,
下同),c和f的I 大小关系是 大 于 0
(2)上述元素中,原子中未成对电子数最多的是
写出该元素基态原子的核外电子排布式:
1 2 3 4 5
b
h
a C f i 1
m
e g
d k
5.下表是元素周期表的一部分,表中的字母分别代表一种化
学元素。
Li X
Y
I 519 502
580
12 7296 4570
1820
I 11799 6920
2750
I 9550
11600
(3)根据下表所提供的电离能数据(单位:kJ·mol-1), 回答下列问
题。
1 2 3 4
5
①表 中X可能为以上13种元素中的 元素。用元素符号
表示X和j形成的化合物的化学式: 0
②Y 是周期表中第 族的元素。
③以上13种元素中, 元素原子失去核外第一个电子需
要的能量最多。
1 2 3 4
5
[解析] (1)题给元素周期表中所列13种元素a~m 分别是Na、
H、Mg、Sr、Sc、Al、Ge、C、P、O、Te、Cl、Ar,其中Na、
Mg 、Al 、P 、Cl 、Ar位于第三周期,最稳定的是Ar, 故其I 最大, Mg 、Al的核外电子排布式分别为1s 2s 2p 3s 、1s 2s 2p 3s 3p ,M g 中3s轨道为全满状态,故其I 比Al的I 大。
(2)i元素最外层电子排布为3s 3p ,有3个未成对电子,未成对
电子数最多。
1 2 3 4
5
(3)①由表中数据可以看出,Li 和X 的I1均比I 、I 小很多,说明
X与Li同主族,且X的I 比Li的I 更小,说明X的金属性比Li更强,则 X为Na(即a)。②由 Y的电离能数据可以看出,它的I 、I 、I 比I 小 得多,故Y属于第ⅢA 族元素。③稀有气体元素m的原子最外层已达 到稳定结构,失去核外第一个电子所需能量最多。
[答案] (1)m c f(2)i 1s 2s 2p 3s 3p (3)①a Na O 、 Na O ②ⅢA ③m
1 2 3 4 5
第一章原子结构与性质
第二节 原子结构与元素的性质
基础课时4 元素周期律
学 习 任 务
1.能从原子结构的角度理解原子半径、电离能、电负性的
递变规律。
2.通过原子半径、电离能、电负性递变规律的学习,建立 “结构决定性质”的认知模型,并能利用该认知模型解释 元素性质的规律性和特殊性。
N0.1
必备知识 · 自主预习储备
电子的能层越多,电子之间
的排斥作用将使原子的
半径增大
核电荷数越大,核对电子的吸引作用 越大,使原子的半径减小
电子的
能层数
核电
荷数
一、原子半径
1. 影响因素
原子 影响 半径因素
点此进入
2. 递变规律
(1)同周期:从左到右,核电荷数越大,半径越小(稀有气体除
外)。
(2)同主族:从上到下,电 子 层 数越多,半径越大。
点此进入
提示:①不同周期不同主族元素原子半径比较,先看周期再看
主族。②对于离子的半径比较,要借助于电子层结构相同的离子半 径变化规律和元素周期律进行判断。③同一元素的阳离子半径小于 原子半径;阴离子半径大于原子半径。
分析粒子半径大小比较的关键是什么
想一想
A.K>Na>Li B.Na+>Mg +>AI +
C.Mg +>Na+>F- D.CI~>F~>F
C [同一主族元素的原子,从上到下原子半径逐渐增大,A 项 正确;核外电子排布相同的离子,核电荷数越大,半径越小,B项 正确;半径大小应为Mg +
点此进入
解析答案
下列有关粒子半径的大小比较错误的是( )
练 一 练
二、电离能
1. 电离能的概念
气态电中性基态原子失去一个电子转化为气态基态正离子所需
要的最低能量叫做第一电离能。
点此进入
2. 元素的第一电离能变化规律
(1)对同一周期的元素而言,第 一种(碱金属和氢) 元素的第一 电离能最小,最后 一种(稀有气体)元素的第一电离能最大;从左 到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示 元素原子越来越难失去电子。
(2)同族元素,自上而下第一电离能变小,表明自上而下原子越 来越易失去电子。
点此进入
3. 电离能的应用
可以衡量元素的原子失去一个电子的难易程度。第一电离能数
值 越小,原子越容易失去一个电子,元素金属性越强。
点此进入
练一练 下列各组原子中,前者第一电离能大于后者第一电
离能的是( )
A.S 和P B.Mg 和Al
C.Na 和Mg D.Ne 和He
点此进入
B [S和P的价层电子排布式分别为3s 3p 和3s 3p ,由于P原子
的3p能级处于半充满状态,较稳定,所以I (S)I (He)>I (Ne) 。]
三、电负性
1. 键合电子和电负性的含义
(1)键合电子:元素相互化合时,原子中用于形成化学键的电 子。
(2)电负性:用来描述不同元素的原子对键合电子吸引力的大 小。电负性越大的原子,对键合电子的吸引力越大。
点此进入
2. 衡量标准
以氟的电负性为4.0 和锂的电负性为1.0_作为相对标准,得出 各元素的电负性(稀有气体未计)。
3. 递变规律(一般情况)
(1)同周期,自左到右,元素的电负性逐渐变大。
(2)同主族,自上到下,元素的电负性逐渐变小。
点此进入
一般大于1.8 元素为非金属元素,且电负性越大,非金属 性越 强
依 一般小于1.8 元素为金属元素,且电负性越小,金属性 据 越 强
1.8左右 一般位于金属元素和非金属元素的交界线
处,它们既有金属性,又有非金属 性
4. 应用:判断金属性、非金属性强弱
点此进入
练一练 下列对电负性的理解不正确的是( )
A. 电负性是人为规定的一个相对数值,不是绝对标准
B. 元素电负性的大小反映了元素原子对键合电子吸引力的大小 C.根据电负性的大小,可判断化合物XY 中两元素化合价的正负 D. 元素的电负性是元素固有的性质,与原子结构无关
点此进入
D [电负性是人为规定的一个相对数值,不是绝对标准,A 项
正确;元素电负性的大小反映了元素原子对键合电子吸引力的大
小 ,B项正确;元素的电负性越大,则元素的非金属性越强,反之 则元素的金属性越强,故在化合物XY中电负性大的元素显负价,电 负性小的元素显正价,C项正确;一般来说,同周期元素从左到
右,元素的电负性逐渐增大,同族元素从上到下,元素的电负性逐 渐减小,因此电负性与原子结构有关,D 项错误。]
关键能力 ·情境探究达成
学习任务1
学习任务2
[情境素材]
前四周期元素第一电离能(I )的变化如图所示。
电离能规律及其应用
学习任务1
[问题1] 据图可知,第ⅡA 族和VA 族元素的第一电离能比同
周期的相邻元素都高,解释原因。
提示:同周期中,第ⅡA 族元素的价层电子排布为ns ,第VA 族元素的价层电子排布为ns np ,np 轨道分别为全空和半充满状
态,比较稳定,所以失去一个电子需要的能量大,所以第一电离能 比同周期相邻元素的要高。
[合作探究]
[问题2]根据Na 、Mg 、Al的电离能数据,回答:
①为什么同一元素的电离能逐级增大
②为什么Na、Mg、Al 的化合价分别为+1、+2、+3
提示:①同一元素的逐级电离能是逐渐增大的,即I < ……这是由于原子失去一个电子变成+1价阳离子后,半径变
小,核电荷数未变而电子数目变少,核对电子的吸引作用增强,因 此第二个电子比第一个电子难失去,失去第二个电子比失去第一个 电子需要更多的能量。同理I >I 、I >I ……In+1>In。
②Na的I 比I 小很多,电离能差值很大,说明失去第一个电子
比失去第二个电子容易得多,所以Na 容易失去一个电子形成+1价 离子;Mg的I 和I 相差不多,而I 比I 小很多,所以Mg容易失去两 个电子形成+2价离子;Al的I 、I 、I 相差不多,而I 比I 小很多, 所以Al容易失去三个电子形成+3价离子。
1. 第一电离能与原子核外电子排布的关系
(1)第一电离能的变化与元素原子的核外电子排布有关。通常情
况下,当原子核外电子排布在能量相等的轨道上形成全空(p 、d 、 f) 、 半 满(p 、d 、f) 和全满(p 、d 0 、fl )结构时,原子的能量较 低,该元素具有较大的第一电离能。例如P的第一电离能比S的大,
Mg 的第一电离能比Al的大。
[归纳总结]
(2)第三周期元素第一电离能的大小关系为I (Ar)>I (Cl)>
I (P)>I (S)>I (Si)>I (Mg)>I (Al)>I (Na)。
2. 电离能的应用
(1)比较元素金属性的强弱。
一般情况下,元素的第一电离能越小,元素的金属性越强。
(2)确定元素原子的核外电子层排布。
由于电子是分层排布的,内层电子比外层电子难失去,因此当 元素原子失去不同能层的电子时电离能会发生突变。
(3)确定元素的化合价。
如果电离能在In与In+1之间发生突变,则元素的原子易形成+n 价 离子,或主族元素的最高化合价为+n价。某元素的逐级电离能 若I >I , 则该元素通常显+1价;若I >I >I , 则该元素通常显十2 价;若I >I >I >I , 则该元素通常显+3价。
1. 某主族元素的第一、二、三、四电离能依次为899 kJ·mol- 、
17 57 kJ·mol- 、14840 kJ·mol- 、18025 kJ·mol- ,则该元素在元素 周期表中位于( )
A. 第 I A族 B. 第ⅡA族 C. 第 ⅢA族 D. 第 IVA族
B [该元素的第一、二电离能较小,第三电离能剧增,说明该
元素原子易失去2个电子,其最外层电子数为2,该元素位于第ⅡA 族。]
点此进入
解析答案
[能力达成]
2.不同元素的气态原子失去最外层一个电子所需要的最低能
量,设其为E,如图所示。试根据元素在周期表中的位置,分析图 中曲线的变化特点,并完成下列问题。
E/kJ-mol-1
2500
2000
1500
1000
500
0
357911131517192123 原子序数
1012
738
496
2372
899
500
2084
1504
999
485
(1)同主族内不同元素的E 值的变化特点是 ---0
(2)同一周期内,随着原子序数的增大,E 值增大,但个别元素 的E值出现反常现象。试预测下列关系式中正确的是 (填编 号)。
①E(砷)>E(硒) ②E(砷)
(3)估计1 mol气态钙原子失去最外层一个电子所需最低能量E值 的范围:
[解析] 本题主要考查元素第一电离能的变化规律。
(1)从 H、3Li、11Na、19K等同主族元素可以看出,同主族元素 随着原子序数增大,E 值变小。(2)从第二、三周期看,第ⅢA族和 VIA 族元素比同周期相邻两元素E 值都低,可以推出E(砷)>E(硒)、 E(溴)>E(硒)。(3)据同主族、同周期元素E值变化规律可知,E(K)
(2)①③
(3)485 738
(4)10号元素为氖,该元素原子的最外层电子排布已达到8电子 稳定结构
在化学中有一个概念,全世界的化学家和材料学家几乎每天都
会用到,它常被视为元素周期表中的“第三个维度”。研究人员已 经无数次地将它用于分子和材料的设计上。它衡量的是不同原子吸 引电子的能力。可以说,它是解释元素之间为什么会发生化学反
应,以及为何能形成具有不同性质的材料的重要基础。化学家曾无
电负性规律及其应用
[情境素材]
学习任务2
数次地尝试用不同的方法来定义和量化这一概念。瑞典化学家永
斯 · 贝采利乌斯在19世纪对它进行了研究。美国化学家莱纳斯 ·鲍林 将其定义为分子中原子吸引电子的能力,并提出了一个基于键能的 公式,这一定义至今仍然适用。
[问题1] “第三个维度”是什么
提示:电负性。根据材料可知,“第三个维度”衡量的是不同
原子吸引电子的能力,符合概念的是电负性。
[问题2] 根据化合物SiC、CCl 判 断 ,Si、C、Cl的“第三个维 度”由大到小的顺序是什么
提示:Cl>C>Si。
[合作探究]
[问题3] 根据铝元素和氯元素的“第三个维度”差值判断,
AICl 是离子化合物还是共价化合物 为什么
提示:共价化合物。Cl元素的电负性为3.0,Al 元素的电负性为 1.5,二者电负性的差值小于1.7,形成共价键,故AICl 是共价化合 物。
电负性的应用
1. 判断元素的金属性和非金属性
(1)金属元素的电负性一般小于1.8,非金属元素的电负性一般大 于1.8,而位于金属、非金属界线两侧的元素的电负性则在1.8左
右,它们既有金属性,又有非金属性。
(2)金属元素的电负性越小,金属元素越活泼;非金属元素的电 负性越大,非金属元素越活泼。
[归纳总结]
2. 判断元素的化合价
(1)电负性数值小的元素在化合物中吸引电子的能力弱,元素的 化合价为正值。
(2)电负性数值大的元素在化合物中吸引电子的能力强,元素的 化合价为负值。
3. 判断化学键的类型 一般认为:
(1)如果两个成键元素原子间的电负性差值大于1.7,它们之间通 常形成离子键。
(2)如果两个成键元素原子间的电负性差值小于1.7,它们之间通 常形成共价键。
在元素周期表中,某些主族元素与其右下方的主族元素(如图所
示)的有些性质是相似的,被称为“对角线规则”。
Li Be B
Mg Al
Si
4. 解释元素“对角线”规则
这可以由元素的电负性得到解释:Li、Mg 的电负性分别为
1.0 、1.2;Be 、Al 的电负性分别为1.5、1.5;B 、Si的电负性分别为 2.0、1.8。它们的电负性接近,说明它们对键合电子的吸引力相
当,它们表现出的性质相似,如Li 、Mg在空气中燃烧的产物分别为 Li O和MgO;Be(OH) 、Al(OH) 均属于难溶的两性氢氧化物;B、
Si的含氧酸都是弱酸等。
3 . (2021 ·福建漳州月考)下列各组元素按电负性大小排列正确
的是( )
A.F>N>0 B.0>Cl>F
C.As>P>N D.Cl>S>As
点此进入
解析答案
[能力达成]
D [电负性用来描述不同元素的原子对键合电子吸引力的大
小,它是一个相对数值,元素的电负性也有周期性变化。一般来 说,同周期元素从左到右(稀有气体元素除外),元素的电负性逐渐 增大;同族元素从上到下,元素的电负性逐渐减小。]
4. 碳、氧、硅、锗、氟、氯、溴、镍元素在化学中占有极其 重要的地位。
(1)第二周期中基态原子未成对电子数与Ni 相同且电负性较小的 元素是
(2)从电负性角度分析,碳、氧和硅元素的非金属性由强到弱的 顺序为
(3)CH 中共用电子对偏向C,SiH 中共用电子对偏向H, 则 C、
Si、H 的电负性由大到小的顺序为 。
( 4 ) 基 态 锗(Ge) 原 子 的 核 外 电 子 排 在 式 是 ,Ge 的最高
价氯化物的分子式是 。该元素可能的性质或应用有
(填标号)。
A. 是一种活泼的金属元素
B. 其电负性大于硫
C. 其单质可用作半导体材料
D. 锗的第一 电离能大于碳而电负性小于碳
(5)溴与氯以 (填“离子”或“共价”)键结合成BrCl,
BrC1分子中, 显正电性。BrCl 与水发生反应的化学方程 式为
[解析] (1)基态Ni原子的价层电子排布式为3d 4s ,原子中含有
2个未成对电子,第二周期元素基态原子中含有2个未成对电子的元 素有C和O, 而 O的电负性大于C。
(2)一般来说,同周期元素从左到右,元素的电负性逐渐变大,
同族元素从上到下,元素的电负性逐渐变小可知,电负性由大到小 的顺序为O>C>Si, 电负性越大,非金属性越强,则非金属性由强 到弱的顺序为O>C>Si。
(3)元素电负性越大,吸引键合电子能力越强,键合电子偏向于
该原子,根据题给分子中共用电子对偏向情况可推知电负性由大到 小的顺序为C>H>Si。
(4)锗是32号元素,其基态原子的核外电子排布式为
1s 2s 2p 3s 3p 3d 4s 4p 或[Ar]3d 4s 4p ;Ge的价层电子数为4, 则 最高价为+4,其氯化物分子式是GeCl 。Ge 是一种金属元素,但最 外层电子数为4,金属性不强,A 项错误;硫是较活泼的非金属元
素,电负性:S>Si>Ge, 故锗的电负性小于硫,B项错误;锗单质是 一种半导体材料,C 项正确;锗的电负性和第一电离能均小于碳,D 项错误。
(5)电负性:Br
H O===HCl+HBrO。
[答案](1)碳(或C)
(2)O>C>Si
(3)C>H>Si
(4)1s 2s 2p 3s 3p 3d 04s 4p 或[Ar]3d 04s 4p GeCl C
(5)共价 Br BrCl+H O===HCl+HBrO
规律总结
电负性是不同元素的原子对键合电子吸引力大小的量度,电负
性越大,非金属性越强。电负性的大小能用来判断元素之间的成键 类型,也可以用来判断元素化合价的正负。电负性相同或差值小的 非金属元素的原子之间形成的化学键主要是共价键,当电负性差值 为零时通常形成非极性共价键;差值不为零时,形成极性共价键; 而且差值越小,形成的共价键极性越弱。
内容 原子半径 第一电离能 电负性 元素 性质 决定
反映
内容:元素性质随原子序 数的递增呈周期性变化
知识脉络
元素性质
的周期性
变化
元素周期律
(表中位置)
反映
总结
结 构
学习效果 ·随堂评估自测
1. 下列化合物中阳离子半径和阴离子半径之比最大的是( )
A.LiI B.NaBr C.KCl D.CsF
D [若阳离子半径最大,阴离子半径最小,则化合物中阳离子 半径和阴离子半径之比最大。四种化合物中,阴离子中F- 半径最
小,而阳离子中Cs+半径最大,所以四种化合物中阳离子半径和阴 离子半径之比最大的是CsF。]
1 2 3 4 5
点此进入
解析答案
2.具有下列价层电子排布的同周期元素原子中,第一电离能
最小的是( )
A.ns np B.ns np C.ns np D.ns np
B [ns np 中np轨道处于半充满状态,ns np 中np轨道处于全 充满状态,均是能量较低的状态,不易失去电子;ns np 和ns np 比 较 ,ns np 更容易失去一个电子变成ns np ,因此其第一电离能最 小,故B项正确。]
点此进入
解析答案
3 4 5
2
1
3.下列是几种基态原子的电子排布式,电负性最大的原子是( )
A.1s 2s 2p
B.1s 2s 2p 3s 3p
C.1s 2s 2p 3s 3p
D.1s 2s 2p 3s 3p 4s
点此进入
解析答案
3
4 5
1 2
A [不同元素的原子吸引电子的能力大小可用电负性表示,元
素的非金属性越强其电负性越大。同一周期中的主族元素,电负性 随着原子序数的增大而增大;同一主族中,元素的电负性随着原子 序数的增大而减小。A是0元素,B 是P元 素 ,C是Si 元素,D是Ca元 素,非金属性最强的元素是0元素,即电负性最大的元素是O 元
素,故选A 。]
1 2 3 4 5
4.如图是第三周期11~17号元素某些性质变化趋势的柱形图,
下列有关说法中正确的是( )
A.y 轴表示的可能是基态的原子失去一个电子
所需要的最小能量 原子序数
B.y 轴表示的可能是原子在化合物中吸引电子
的能力
C.y 轴表示的可能是原子半径
D.y 轴表示的可能是形成基态离子转移的电子数
点此进入
解析答案
1 2 3
4
5
B [第三周期Mg (或P)的3p能级为全空(或半充满)状态,较为稳
定 ,Mg (或P)的第一电离能大于Al(或S), 故A 错误;同周期元素从 左到右,电负性逐渐增大,B 正确;同周期元素从左到右,原子序 数逐渐增大,原子半径逐渐减小,C错误;同周期金属元素形成基 态离子转移的电子数逐渐增多,非金属元素形成基态离子所需要的 电子数逐渐减少,D 错误。]
1 2 3 4 5
(1)上表第三周期中第一电离能(I )最大的是 (填字母,
下同),c和f的I 大小关系是 大 于 0
(2)上述元素中,原子中未成对电子数最多的是
写出该元素基态原子的核外电子排布式:
1 2 3 4 5
b
h
a C f i 1
m
e g
d k
5.下表是元素周期表的一部分,表中的字母分别代表一种化
学元素。
Li X
Y
I 519 502
580
12 7296 4570
1820
I 11799 6920
2750
I 9550
11600
(3)根据下表所提供的电离能数据(单位:kJ·mol-1), 回答下列问
题。
1 2 3 4
5
①表 中X可能为以上13种元素中的 元素。用元素符号
表示X和j形成的化合物的化学式: 0
②Y 是周期表中第 族的元素。
③以上13种元素中, 元素原子失去核外第一个电子需
要的能量最多。
1 2 3 4
5
[解析] (1)题给元素周期表中所列13种元素a~m 分别是Na、
H、Mg、Sr、Sc、Al、Ge、C、P、O、Te、Cl、Ar,其中Na、
Mg 、Al 、P 、Cl 、Ar位于第三周期,最稳定的是Ar, 故其I 最大, Mg 、Al的核外电子排布式分别为1s 2s 2p 3s 、1s 2s 2p 3s 3p ,M g 中3s轨道为全满状态,故其I 比Al的I 大。
(2)i元素最外层电子排布为3s 3p ,有3个未成对电子,未成对
电子数最多。
1 2 3 4
5
(3)①由表中数据可以看出,Li 和X 的I1均比I 、I 小很多,说明
X与Li同主族,且X的I 比Li的I 更小,说明X的金属性比Li更强,则 X为Na(即a)。②由 Y的电离能数据可以看出,它的I 、I 、I 比I 小 得多,故Y属于第ⅢA 族元素。③稀有气体元素m的原子最外层已达 到稳定结构,失去核外第一个电子所需能量最多。
[答案] (1)m c f(2)i 1s 2s 2p 3s 3p (3)①a Na O 、 Na O ②ⅢA ③m
1 2 3 4 5
