【高中化学】物质的聚集状态与晶体常识课件 人教版(2019)选择性必修2(共42张PPT)
文档属性
| 名称 | 【高中化学】物质的聚集状态与晶体常识课件 人教版(2019)选择性必修2(共42张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 17:33:58 | ||
图片预览





文档简介
(共42张PPT)
第三章 晶体结构与性质
第一节 物质的聚集状态与晶体的常识
第2课时
非晶态二氧化硅
晶态二氧化硅
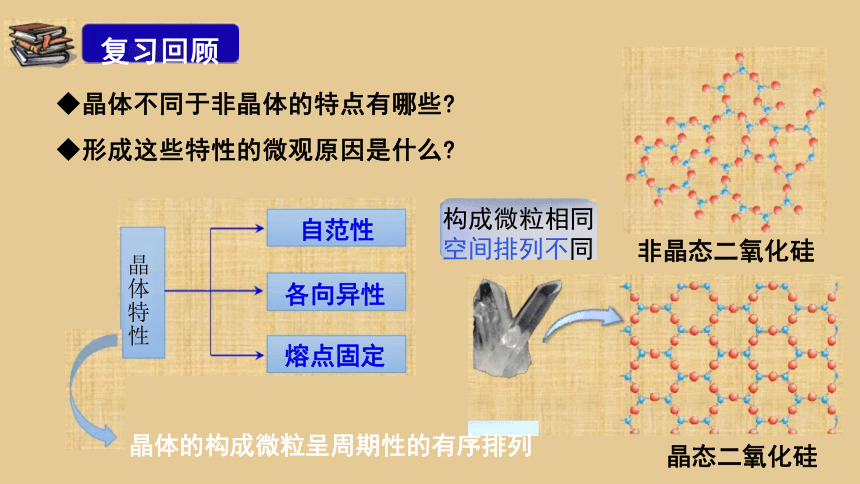
◆晶体不同于非晶体的特点有哪些
◆形成这些特性的微观原因是什么
自范性
各向异性
熔点固定
晶体的构成微粒呈周期性的有序排列
构成微粒相同 空间排列不同
复习回顾
晶体特性
铜晶体 CaF 晶体 金刚石晶体 苯晶体
◆宏观可见的整块晶体是由大量微粒聚集而成的。
◆晶体的构成微粒在空间周期性重复排列,呈现高度对称性。
思考 观察如下晶体的微观结构模型,体会微粒的空间排列特点。
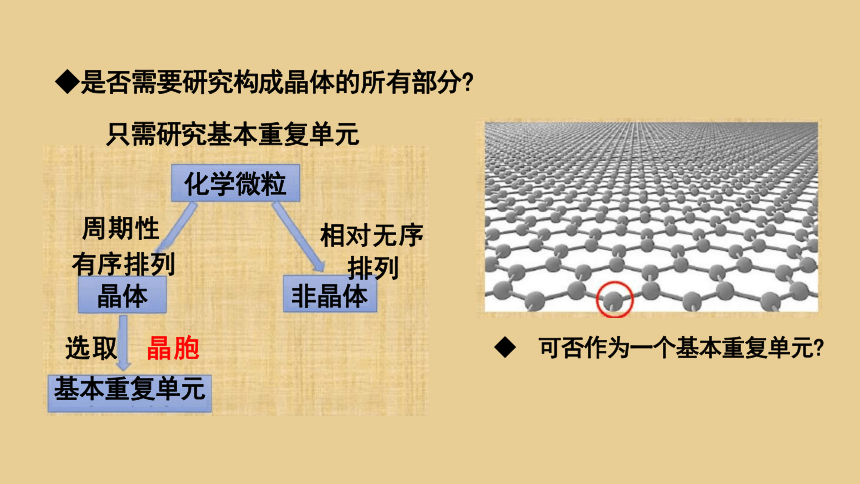
要研究晶体的结构,应当如何入手呢
只需研究基本重复单元
化学微粒
周期性 相对无序
有序排列 排列
晶体 非晶体
选取 晶胞
基本重复单元
◆是否需要研究构成晶体的所有部分
◆ 可否作为一个基本重复单元
一、晶胞
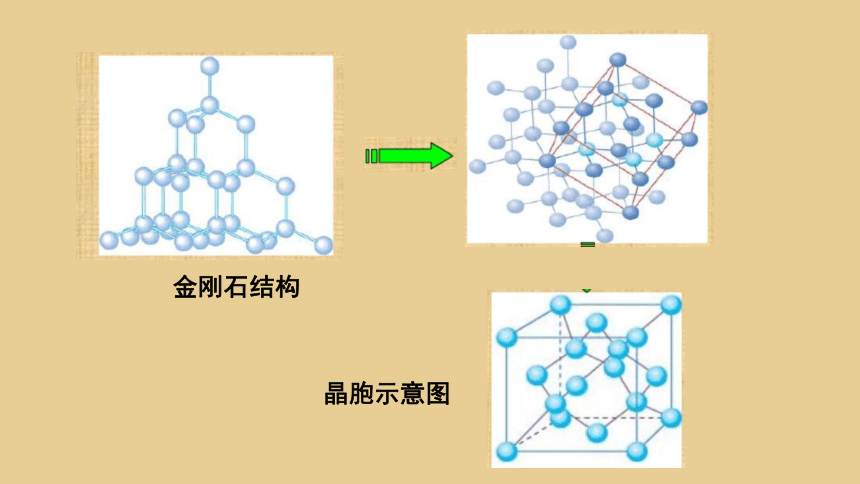
1.晶胞:描述晶体结构的基本单元,即晶体中最小的结构重复单元.
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的, 晶胞是无形的,是人为划定的。
蜂巢与蜂室 铜晶体 铜晶胞
金刚石结构
晶胞示意图
平行六面体
2.晶体与晶胞的关系
一般来说,晶胞都是平行六面体,晶体可以看作是数量巨大的晶胞 “无隙并置”而成
①无隙:指相邻的晶胞之间没有任何间隙;一个晶胞与相邻的晶胞 完全共顶点、共棱边、共面
②并置:指所有晶胞都是平行排列的,取向相同。一个晶胞到另一 个晶胞只需平移,不需转动
③完全等同:指所有晶胞的形状、内部的原子种类、个数及几何排 列完全相同。
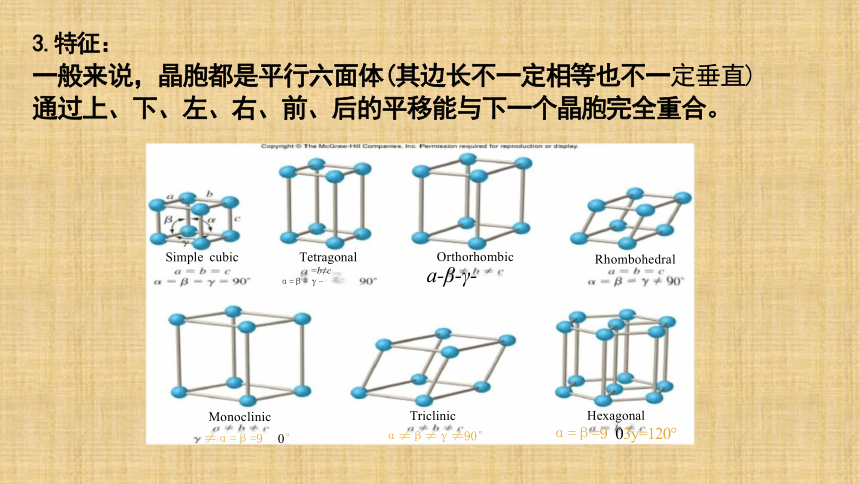
3.特征:
一般来说,晶胞都是平行六面体(其边长不一定相等也不一定垂直) 通过上、下、左、右、前、后的平移能与下一个晶胞完全重合。
Simple cubic Tetragonal
=b≠c
α=β- γ-
Monoclinic
≠α=β=9 0°
Orthorhombic
Triclinic
α≠β≠γ≠90°
Rhombohedral
Hexagonal
α=β=9 03y=120°
a-β-γ- 90
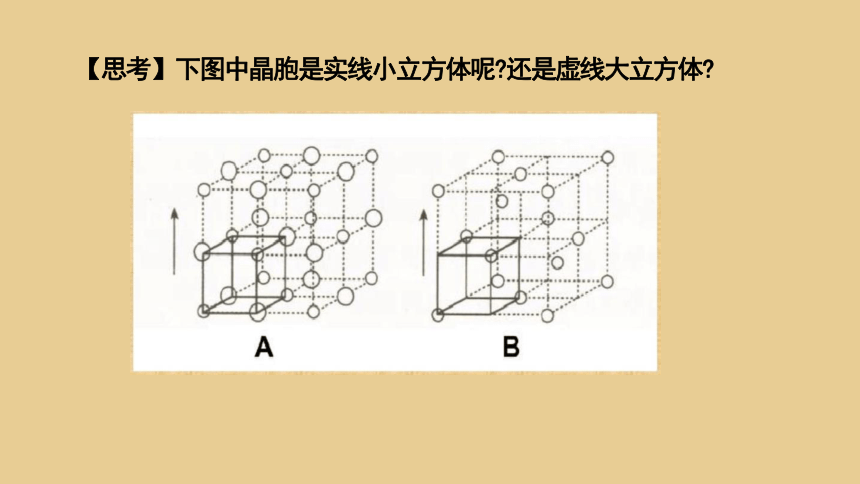
【思考】下图中晶胞是实线小立方体呢 还是虚线大立方体
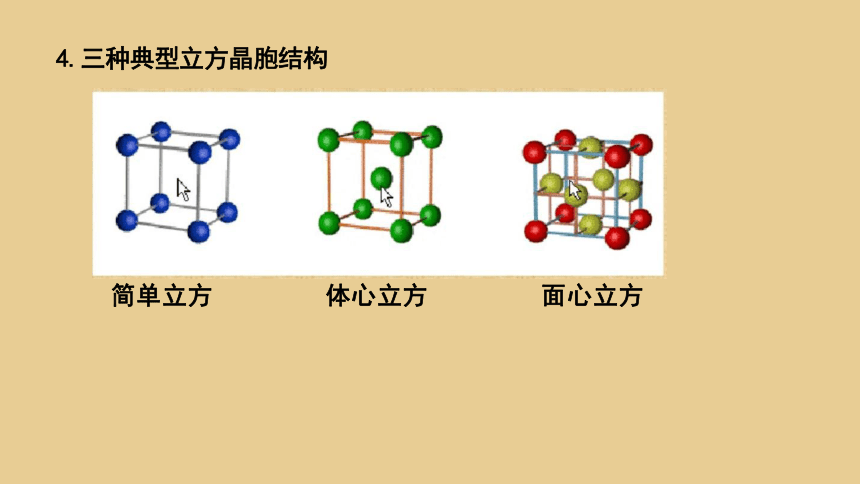
简单立方 体心立方 面心立方
4.三种典型立方晶胞结构
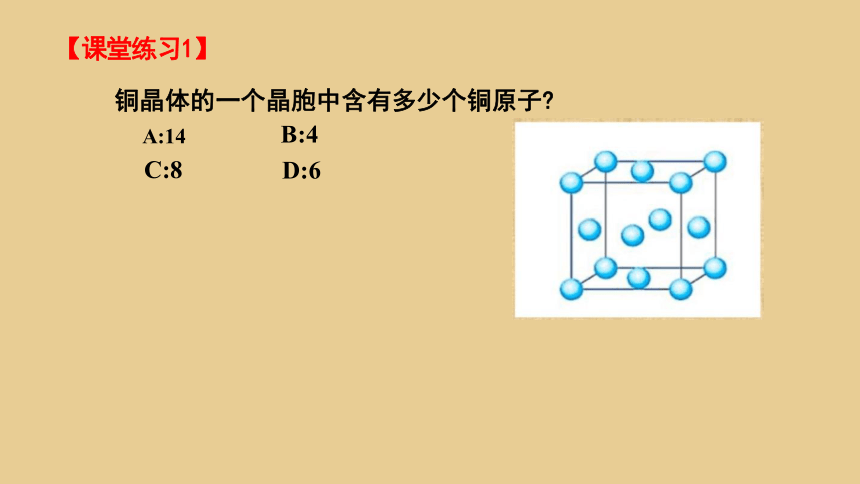
【课堂练习1】
铜晶体的一个晶胞中含有多少个铜原子
A:14
C:8
B:4
D:6
顶点:1/8
棱边:1/4
面心:1/2
体心:1
晶胞 顶角 棱边 面心
体心
立方体 1/8 1/4 1/2
1
顶角
棱边
面心
二、晶胞中粒子数目的计算
1.立方晶胞
均摊法:如某个粒子为x个晶胞所共有,则该粒子有1/x属于一个晶胞。
顶点 棱边 面心 体心
【课堂练习T1】
铜晶体的一个晶胞中含有多少个铜原子
A:14
C:8
B:4
D:6
【课堂练习T2】下图依次是金属钠(Na)、金属锌(Zn)、碘 (I )、金 刚石(C)晶胞的示意图,数一数,它们分别平均含有几个原子
Cl- 各1/2个
一个大NaCl 晶胞包含4个NaCl
氯化钠的化学式用“NaCl”来表示,原因何在 能否把“NaCl”称为分子式
【课堂练习T3】 Na+:Cl-=1:1
●
Na+
O
Cl-
每个C Cl晶 胞 中 有 1 个Cs+, 有 1 个CI。
一个CsCl 晶胞包含1个CsCl
氯化铯化学式推导
A 与B离子的个数比等于 1 : ,该物质化学式可表示为 AB 。
【课堂练习T4】
A+
B-
【课堂练习T5】
石墨晶体的层状结构,层内为平面正六边形结 构(如图),试回答下列问题:
(1)图中平均每个正六边形占有C原子数为
2 个、占有的碳碳键数为_3 个。
碳原子数目与碳碳化学键数目之比为 2:3 。
【课堂练习T6】
钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音 器中都有应用。钛酸钡晶体的结构示意图为下图,它的化学式是
( D)
A.BaTi O 2
C.BaTi O
B.BaTi O
D.BaTiO
【课堂练习T7】
现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数 比为1:1 ;乙晶体的化学式为C D ; 丙晶体的化学式为EF ; 丁 晶体的化学式为x Y Z 。
8.最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所 示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子, 它的化学式是Ti C 。
解析:由于本题团簇分子指的是一个分子的具 体结构,并不是晶体中的最小的一个重复单位, 不能采用均摊法分析,所以只需数出该结构内 两种原子的数目就可以了。
晶胞有几套平行棱 有几套平行面
晶胞的结构特点:
①8个顶点相同
②三套各4根平行的棱相同
③三套各2个平行的面相同
顶点 1/12
棱边水平1/4竖1/6
面心1/2
体心 1
2.三方晶胞
三棱柱
顶点 1/6
棱边 水平1/4竖1/3 面心 1/2
体心 1
3.六方晶胞
六棱柱
【课堂练习2】
某晶体的一部分如图所示,这种晶体中A、B、C 三种粒子数之比是( B )
A.3:9:4
C.2:9:4
B.1:4:2
D.3:8:4
顶点1/12
棱边水平1/4
三棱柱 竖1/6
面心1/2
体心1
顶点1/8
棱边 1/4 面心 1/2 体心 1
常见晶胞中微粒数的计算
面心 1/2
体心1
水平1/4 竖1/3
顶点1/6
六棱柱
立方体
棱边
从衍射图中经计算可获取晶体的结构信息,如晶胞的形状、 大小,微粒空间对称性类型,原子的数目和位置等。
三、晶体结构的测定——X射线衍射法
根据晶胞结构确定各种粒子的数目
晶胞质量
晶胞体积
根据晶胞的边长或微粒间的距离
四、晶体密度p求算
= m/
求
求
该晶胞中,若Na+和C1-间的最近距离为0.5a×10-10m,则晶体的密度d=
【课堂练习3】
1.如图是CsCl晶体的晶胞(晶体中最小的重复单元)已知晶体中2个 最近的Cs+核间距离为acm, 氯化铯的相对分子质量为M,NA 为阿佛 加德罗常数,则CsCl晶体的密度为( C ) (单位:克/cm )
B.a M/8NA
D.a M/NA
A.8M/a NA
C.M/a NA
顶点一Cs+
中 心 -c1-
2.已知CsCl晶体的密度为p g·cm-3,NA为阿伏加德罗常数,相邻
的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量
可以表示为( A )
A.NA·a ·p B.
. D.
五、晶胞某原子周围与其等距离且最近的原子数目(称为配位数 )
【方法】晶体配位数计算:
①先确定并观察中心原子,观察一个晶胞,再向空间延伸
②考虑是否重复计算
1.①NaCl晶体中,每个Na+周围最近距离的Cl-有 6 个 ,
每个Cl-周围最近距离的Na+有 6 个。
②每个Na+周围最近距离的Na+有12 _ 个 。
2.如图所示,CsCl晶体具有立方体结构,
①每个Cs+周围最近距离的Cs+有 6 个 ,每个Cl-周围最近距离的Cl-有 6个。
②每个Cs+周围最近距离的Cl-有 8 个 ,每个Cl-周围最近距离的Cs+有8 个。
3.①CO 晶体结构,CO 分子处于立方体的 面心 位置,一个立方体中含 有4 个CO 分子。②在同一平面上与一个CO 分子距离最近的CO 分子有
个。③三维立体中,与一个CO 分子距离最近的CO 有4 个。
12
距离最近的分子的位置
2
8
12个
0○
0○
○
○
O
》
4.Cu晶胞中与铜原子最近且等距离的铜原子有12 个。
六、计算晶胞微粒间的距离
【例题】若CaTiO 的相对分子质量为M, 密度为 A g/cm ,阿伏加德罗常数
【题型5】原子坐标参数
【方法】①由已知坐标确定晶胞参数值和坐标原点
②由原子在晶胞中的相对位置确定原子与坐标原点的距离
③确定原子在晶胞中的坐标【例】系统集成 P71: 探究题目T4 P72:T5
第三章 晶体结构与性质
第一节 物质的聚集状态与晶体的常识
第2课时
非晶态二氧化硅
晶态二氧化硅
◆晶体不同于非晶体的特点有哪些
◆形成这些特性的微观原因是什么
自范性
各向异性
熔点固定
晶体的构成微粒呈周期性的有序排列
构成微粒相同 空间排列不同
复习回顾
晶体特性
铜晶体 CaF 晶体 金刚石晶体 苯晶体
◆宏观可见的整块晶体是由大量微粒聚集而成的。
◆晶体的构成微粒在空间周期性重复排列,呈现高度对称性。
思考 观察如下晶体的微观结构模型,体会微粒的空间排列特点。
要研究晶体的结构,应当如何入手呢
只需研究基本重复单元
化学微粒
周期性 相对无序
有序排列 排列
晶体 非晶体
选取 晶胞
基本重复单元
◆是否需要研究构成晶体的所有部分
◆ 可否作为一个基本重复单元
一、晶胞
1.晶胞:描述晶体结构的基本单元,即晶体中最小的结构重复单元.
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的, 晶胞是无形的,是人为划定的。
蜂巢与蜂室 铜晶体 铜晶胞
金刚石结构
晶胞示意图
平行六面体
2.晶体与晶胞的关系
一般来说,晶胞都是平行六面体,晶体可以看作是数量巨大的晶胞 “无隙并置”而成
①无隙:指相邻的晶胞之间没有任何间隙;一个晶胞与相邻的晶胞 完全共顶点、共棱边、共面
②并置:指所有晶胞都是平行排列的,取向相同。一个晶胞到另一 个晶胞只需平移,不需转动
③完全等同:指所有晶胞的形状、内部的原子种类、个数及几何排 列完全相同。
3.特征:
一般来说,晶胞都是平行六面体(其边长不一定相等也不一定垂直) 通过上、下、左、右、前、后的平移能与下一个晶胞完全重合。
Simple cubic Tetragonal
=b≠c
α=β- γ-
Monoclinic
≠α=β=9 0°
Orthorhombic
Triclinic
α≠β≠γ≠90°
Rhombohedral
Hexagonal
α=β=9 03y=120°
a-β-γ- 90
【思考】下图中晶胞是实线小立方体呢 还是虚线大立方体
简单立方 体心立方 面心立方
4.三种典型立方晶胞结构
【课堂练习1】
铜晶体的一个晶胞中含有多少个铜原子
A:14
C:8
B:4
D:6
顶点:1/8
棱边:1/4
面心:1/2
体心:1
晶胞 顶角 棱边 面心
体心
立方体 1/8 1/4 1/2
1
顶角
棱边
面心
二、晶胞中粒子数目的计算
1.立方晶胞
均摊法:如某个粒子为x个晶胞所共有,则该粒子有1/x属于一个晶胞。
顶点 棱边 面心 体心
【课堂练习T1】
铜晶体的一个晶胞中含有多少个铜原子
A:14
C:8
B:4
D:6
【课堂练习T2】下图依次是金属钠(Na)、金属锌(Zn)、碘 (I )、金 刚石(C)晶胞的示意图,数一数,它们分别平均含有几个原子
Cl- 各1/2个
一个大NaCl 晶胞包含4个NaCl
氯化钠的化学式用“NaCl”来表示,原因何在 能否把“NaCl”称为分子式
【课堂练习T3】 Na+:Cl-=1:1
●
Na+
O
Cl-
每个C Cl晶 胞 中 有 1 个Cs+, 有 1 个CI。
一个CsCl 晶胞包含1个CsCl
氯化铯化学式推导
A 与B离子的个数比等于 1 : ,该物质化学式可表示为 AB 。
【课堂练习T4】
A+
B-
【课堂练习T5】
石墨晶体的层状结构,层内为平面正六边形结 构(如图),试回答下列问题:
(1)图中平均每个正六边形占有C原子数为
2 个、占有的碳碳键数为_3 个。
碳原子数目与碳碳化学键数目之比为 2:3 。
【课堂练习T6】
钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音 器中都有应用。钛酸钡晶体的结构示意图为下图,它的化学式是
( D)
A.BaTi O 2
C.BaTi O
B.BaTi O
D.BaTiO
【课堂练习T7】
现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数 比为1:1 ;乙晶体的化学式为C D ; 丙晶体的化学式为EF ; 丁 晶体的化学式为x Y Z 。
8.最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所 示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子, 它的化学式是Ti C 。
解析:由于本题团簇分子指的是一个分子的具 体结构,并不是晶体中的最小的一个重复单位, 不能采用均摊法分析,所以只需数出该结构内 两种原子的数目就可以了。
晶胞有几套平行棱 有几套平行面
晶胞的结构特点:
①8个顶点相同
②三套各4根平行的棱相同
③三套各2个平行的面相同
顶点 1/12
棱边水平1/4竖1/6
面心1/2
体心 1
2.三方晶胞
三棱柱
顶点 1/6
棱边 水平1/4竖1/3 面心 1/2
体心 1
3.六方晶胞
六棱柱
【课堂练习2】
某晶体的一部分如图所示,这种晶体中A、B、C 三种粒子数之比是( B )
A.3:9:4
C.2:9:4
B.1:4:2
D.3:8:4
顶点1/12
棱边水平1/4
三棱柱 竖1/6
面心1/2
体心1
顶点1/8
棱边 1/4 面心 1/2 体心 1
常见晶胞中微粒数的计算
面心 1/2
体心1
水平1/4 竖1/3
顶点1/6
六棱柱
立方体
棱边
从衍射图中经计算可获取晶体的结构信息,如晶胞的形状、 大小,微粒空间对称性类型,原子的数目和位置等。
三、晶体结构的测定——X射线衍射法
根据晶胞结构确定各种粒子的数目
晶胞质量
晶胞体积
根据晶胞的边长或微粒间的距离
四、晶体密度p求算
= m/
求
求
该晶胞中,若Na+和C1-间的最近距离为0.5a×10-10m,则晶体的密度d=
【课堂练习3】
1.如图是CsCl晶体的晶胞(晶体中最小的重复单元)已知晶体中2个 最近的Cs+核间距离为acm, 氯化铯的相对分子质量为M,NA 为阿佛 加德罗常数,则CsCl晶体的密度为( C ) (单位:克/cm )
B.a M/8NA
D.a M/NA
A.8M/a NA
C.M/a NA
顶点一Cs+
中 心 -c1-
2.已知CsCl晶体的密度为p g·cm-3,NA为阿伏加德罗常数,相邻
的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量
可以表示为( A )
A.NA·a ·p B.
. D.
五、晶胞某原子周围与其等距离且最近的原子数目(称为配位数 )
【方法】晶体配位数计算:
①先确定并观察中心原子,观察一个晶胞,再向空间延伸
②考虑是否重复计算
1.①NaCl晶体中,每个Na+周围最近距离的Cl-有 6 个 ,
每个Cl-周围最近距离的Na+有 6 个。
②每个Na+周围最近距离的Na+有12 _ 个 。
2.如图所示,CsCl晶体具有立方体结构,
①每个Cs+周围最近距离的Cs+有 6 个 ,每个Cl-周围最近距离的Cl-有 6个。
②每个Cs+周围最近距离的Cl-有 8 个 ,每个Cl-周围最近距离的Cs+有8 个。
3.①CO 晶体结构,CO 分子处于立方体的 面心 位置,一个立方体中含 有4 个CO 分子。②在同一平面上与一个CO 分子距离最近的CO 分子有
个。③三维立体中,与一个CO 分子距离最近的CO 有4 个。
12
距离最近的分子的位置
2
8
12个
0○
0○
○
○
O
》
4.Cu晶胞中与铜原子最近且等距离的铜原子有12 个。
六、计算晶胞微粒间的距离
【例题】若CaTiO 的相对分子质量为M, 密度为 A g/cm ,阿伏加德罗常数
【题型5】原子坐标参数
【方法】①由已知坐标确定晶胞参数值和坐标原点
②由原子在晶胞中的相对位置确定原子与坐标原点的距离
③确定原子在晶胞中的坐标【例】系统集成 P71: 探究题目T4 P72:T5
