1.1.1反应热——中和热 -化学人教版(2019)高二上学期选择性必修1(共15张PPT)
文档属性
| 名称 | 1.1.1反应热——中和热 -化学人教版(2019)高二上学期选择性必修1(共15张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 17:38:38 | ||
图片预览






文档简介
(共15张PPT)
解密中和热
高中 化学
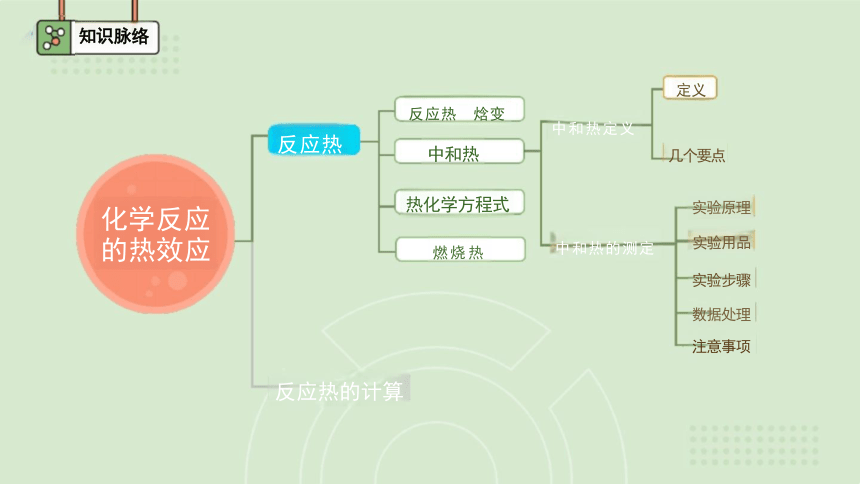
知识脉络
中和热
中和热
1、概念:在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时的反应热。
2、注意几个限定词:
① 稀溶液;
②产物是1mol液态H O;
③用离子方程式可表示为OH-(aq)+H+(aq)==H O(1)△H=-57.3 kJ ·mol-1。
知识脉络
化学反应 的热效应
定义
几个要点
实验原理
实验用品
实验步骤
数据处理
注意事项
反应热 焓变
中和热
热化学方程式
燃烧热
中和热定义
中和热的测定
反应热的计算
反应热
解读 几个限定词
溶液的浓度 ·稀溶液
常温常压下,在稀溶液中,1 mol H+和1 mol
OH- 发生中和反应生成1 mol H O(1)时所释
放出来的热量为中和热。 △H=-57.3 kJ/mol
知 识 精 讲
中和热
定义
解读 几个限定词
溶液的浓度 · 稀溶液
量 · 产物H O 的物质的量为1 mol
常温常压下,在稀溶液中,1 mol H+和1 mol
OH- 发生中和反应生成1 molH O(1) 时所释
放出来的热量为中和热。 △H=-57.3 kJ/mol
知 识 精 讲
中和热
定义
解读 几个限定词
溶液的浓度· 稀溶液
量 · 产物H O 的物质的量为1 mol
离子方程式的表示· H+(ag)+OH-(a)=H O(1)
常温常压下,在稀溶液中,1 mol H+和1 mol
OH- 发生中和反应生成1 mol H O(1) 时 所 释
放出来的热量为中和热。 △H=-57.3 kJ/mol
知识精讲
中和热
定义
HCl和NaOH反应的中和热为-57.3 kJ/mol,则 1mol的H SO 和 1mol Ba(OH)
陷 阱 1 H SO +Ba(OH) = BaSO+1+ 2 H O
陷阱2 大多难溶盐电离是吸热的。
总结提升
反应的中和热△H=2×(-57.3)kJ/mol。
中和热概念题设陷阱
知识精讲
1
已知中和热为△H=-57.3 kJ/mol,则1 mol 稀硫酸与足量稀NaOH 溶液 反应的反应热就是中和热。
陷阱1 H SO =2H++SO -
陷阱2 中和热属于反应热,但是,不是所有的反应热都是中和热。
知识精讲
2
总结提升
中和热概念题设陷阱
3 在稀溶液中:H++OH-=H O(1)△H=-57.3 kJ/mol,含0.5mol H SO 的 浓硫酸与含1 molNaOH 的溶液混合,放出的热量等于57.3 kJ。
陷 阱 浓溶液在反应时伴随稀释过程,并放出能量。
总结提升
中和热概念题设陷阱
知识精讲
放热反应
△H=-57.3kJ·mol-1
强酸和强碱
稀 溶 液
1mol 的液态水
无沉淀或微溶物
记 忆 数轴
总结提升
中和热概念强化记忆
知识精讲
中和热
典例精析
强酸与强碱的稀溶液发生中和反应的热效应为H+(aqg)+OH-(aq)=H O(1)△H =-57.3 kJ:mol-1。分 别 向 1L0.5 mol-L- 的NaOH 溶液中加入①浓硫酸、②稀硫酸、③稀盐酸,恰好完全反应的热效应分别为△H 、△H 、△H ,下列关系正确的 是( C )
A.△H >△H >△H B. △H <△H <△H C. △H <△H =△H D. △H =△H <△H
(T) 的关系如图所示,下列说法不正确的是( D )
A. 该实验表明化学能可以转化为热能
B.NaOH 溶液的浓度大于1.00 mol L-1
C.V=50 mL时,混合溶液显碱性
D. 该实验表明有水生成的反应都是放热反应
典例精析
向盛有50 mL 1.00mol-L-1盐酸的绝热容器中加入NaOH 溶 液 ,NaOH 溶液的体积(V) 与所得混合溶液的最高测量温度
典例精析
试回答下列中和热测定的有关问题:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、环形玻璃搅拌棒、0.50 mol-L-1盐酸、0.55mol-L- NaOH 溶液,尚缺少的实验用品是 ;
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒(填“能”或“不能”)___ _,其原因是_
;
(3)实验时所用盐酸及NaOH 溶液的体积均为50- 核心考点
始温度为20℃,终止温度为23.2℃。试计算该反 ① 中和热测定常用实验用品
> 仪器:量筒、烧杯、温度计、环形玻璃搅拌棒、泡沫塑料、泡沫塑料板
> 药品:0.50 mol L-1盐酸、0.55 mol-L- NaOH 溶液
② 中和热计算公式
在稀溶液中,强酸与强碱发生中和反应生成1 mol H O(1)时的反应热
口 诀 一稀二强一个1
关键 装置具备良好的保温效果 温度计:测量反应前后温度的变化
环形玻璃搅拌棒:使溶液混合均匀
泡沫塑料板
隔热、防止热量损失
泡沫塑料
归纳总结
中和热 概念
中和热 测定实验
高中 化学
0
解密中和热
高中 化学
知识脉络
中和热
中和热
1、概念:在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时的反应热。
2、注意几个限定词:
① 稀溶液;
②产物是1mol液态H O;
③用离子方程式可表示为OH-(aq)+H+(aq)==H O(1)△H=-57.3 kJ ·mol-1。
知识脉络
化学反应 的热效应
定义
几个要点
实验原理
实验用品
实验步骤
数据处理
注意事项
反应热 焓变
中和热
热化学方程式
燃烧热
中和热定义
中和热的测定
反应热的计算
反应热
解读 几个限定词
溶液的浓度 ·稀溶液
常温常压下,在稀溶液中,1 mol H+和1 mol
OH- 发生中和反应生成1 mol H O(1)时所释
放出来的热量为中和热。 △H=-57.3 kJ/mol
知 识 精 讲
中和热
定义
解读 几个限定词
溶液的浓度 · 稀溶液
量 · 产物H O 的物质的量为1 mol
常温常压下,在稀溶液中,1 mol H+和1 mol
OH- 发生中和反应生成1 molH O(1) 时所释
放出来的热量为中和热。 △H=-57.3 kJ/mol
知 识 精 讲
中和热
定义
解读 几个限定词
溶液的浓度· 稀溶液
量 · 产物H O 的物质的量为1 mol
离子方程式的表示· H+(ag)+OH-(a)=H O(1)
常温常压下,在稀溶液中,1 mol H+和1 mol
OH- 发生中和反应生成1 mol H O(1) 时 所 释
放出来的热量为中和热。 △H=-57.3 kJ/mol
知识精讲
中和热
定义
HCl和NaOH反应的中和热为-57.3 kJ/mol,则 1mol的H SO 和 1mol Ba(OH)
陷 阱 1 H SO +Ba(OH) = BaSO+1+ 2 H O
陷阱2 大多难溶盐电离是吸热的。
总结提升
反应的中和热△H=2×(-57.3)kJ/mol。
中和热概念题设陷阱
知识精讲
1
已知中和热为△H=-57.3 kJ/mol,则1 mol 稀硫酸与足量稀NaOH 溶液 反应的反应热就是中和热。
陷阱1 H SO =2H++SO -
陷阱2 中和热属于反应热,但是,不是所有的反应热都是中和热。
知识精讲
2
总结提升
中和热概念题设陷阱
3 在稀溶液中:H++OH-=H O(1)△H=-57.3 kJ/mol,含0.5mol H SO 的 浓硫酸与含1 molNaOH 的溶液混合,放出的热量等于57.3 kJ。
陷 阱 浓溶液在反应时伴随稀释过程,并放出能量。
总结提升
中和热概念题设陷阱
知识精讲
放热反应
△H=-57.3kJ·mol-1
强酸和强碱
稀 溶 液
1mol 的液态水
无沉淀或微溶物
记 忆 数轴
总结提升
中和热概念强化记忆
知识精讲
中和热
典例精析
强酸与强碱的稀溶液发生中和反应的热效应为H+(aqg)+OH-(aq)=H O(1)△H =-57.3 kJ:mol-1。分 别 向 1L0.5 mol-L- 的NaOH 溶液中加入①浓硫酸、②稀硫酸、③稀盐酸,恰好完全反应的热效应分别为△H 、△H 、△H ,下列关系正确的 是( C )
A.△H >△H >△H B. △H <△H <△H C. △H <△H =△H D. △H =△H <△H
(T) 的关系如图所示,下列说法不正确的是( D )
A. 该实验表明化学能可以转化为热能
B.NaOH 溶液的浓度大于1.00 mol L-1
C.V=50 mL时,混合溶液显碱性
D. 该实验表明有水生成的反应都是放热反应
典例精析
向盛有50 mL 1.00mol-L-1盐酸的绝热容器中加入NaOH 溶 液 ,NaOH 溶液的体积(V) 与所得混合溶液的最高测量温度
典例精析
试回答下列中和热测定的有关问题:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、环形玻璃搅拌棒、0.50 mol-L-1盐酸、0.55mol-L- NaOH 溶液,尚缺少的实验用品是 ;
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒(填“能”或“不能”)___ _,其原因是_
;
(3)实验时所用盐酸及NaOH 溶液的体积均为50- 核心考点
始温度为20℃,终止温度为23.2℃。试计算该反 ① 中和热测定常用实验用品
> 仪器:量筒、烧杯、温度计、环形玻璃搅拌棒、泡沫塑料、泡沫塑料板
> 药品:0.50 mol L-1盐酸、0.55 mol-L- NaOH 溶液
② 中和热计算公式
在稀溶液中,强酸与强碱发生中和反应生成1 mol H O(1)时的反应热
口 诀 一稀二强一个1
关键 装置具备良好的保温效果 温度计:测量反应前后温度的变化
环形玻璃搅拌棒:使溶液混合均匀
泡沫塑料板
隔热、防止热量损失
泡沫塑料
归纳总结
中和热 概念
中和热 测定实验
高中 化学
0
