3.2 金属材料 课件【新教材】人教版(2019)高中化学必修一高中化学精品资源(共31张PPT)
文档属性
| 名称 | 3.2 金属材料 课件【新教材】人教版(2019)高中化学必修一高中化学精品资源(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 17:39:22 | ||
图片预览









文档简介
(共31张PPT)
第三章铁金属材料
金属材料
导热性 延展性 导电性
合金是由两种或两种以上的 金属(或金属和非金属) 熔合
而成的具有 金 属特性的物质。
1、大多数金属为银白色(铜:紫红色,金:黄色)固体(汞:液体)。
2、有金属光泽。
3、具有导电性、导热性和延展性。
金属材料:包括纯金属和合金
Cu
实际生活中却使用的最多的是合金,很少使用纯金属。
纯金属材料
Pt
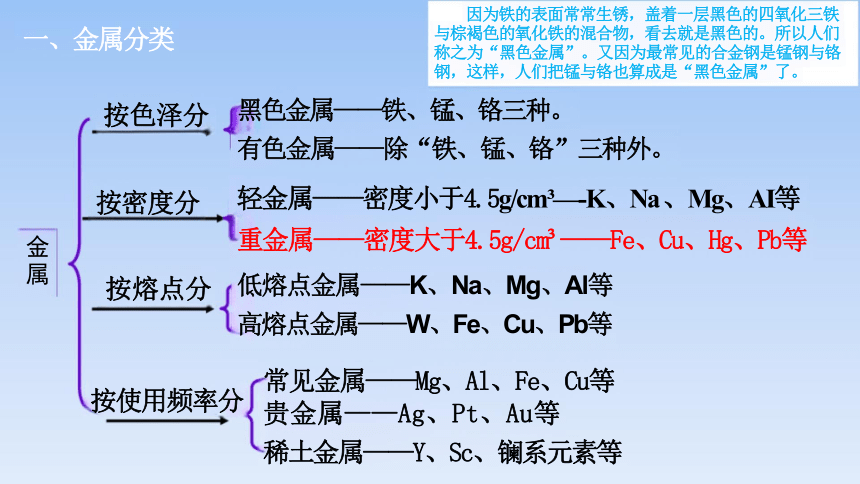
因为铁的表面常常生锈,盖着一层黑色的四氧化三铁 与棕褐色的氧化铁的混合物,看去就是黑色的。所以人们 称之为“黑色金属”。又因为最常见的合金钢是锰钢与铬 钢,这样,人们把锰与铬也算成是“黑色金属”了。
黑色金属——铁、锰、铬三种。
有色金属——除“铁、锰、铬”三种外。
轻金属——密度小于4.5g/cm —-K、Na 、Mg、AI等
重金属——密度大于4.5g/cm ——Fe、Cu、Hg、Pb等
低熔点金属——K、Na、Mg、Al等
高熔点金属——W、Fe、Cu、Pb等
一、金属分类
按色泽分
按密度分
按熔点分
常见金属——Mg、Al、Fe、Cu等 贵金属——Ag、Pt、Au等
稀土金属——Y、Sc、镧系元素等
按使用频率分
金属
稀土元素。
包含元素:镧系元素(从镧到镥,原子序数从57~71的
15种元素)及 钪、钇共17种元素。
图 3 - 2 2 稀 土 元 素
镝 (Dy)
常用于制
造 硬 盘 驱
动器
二、合金
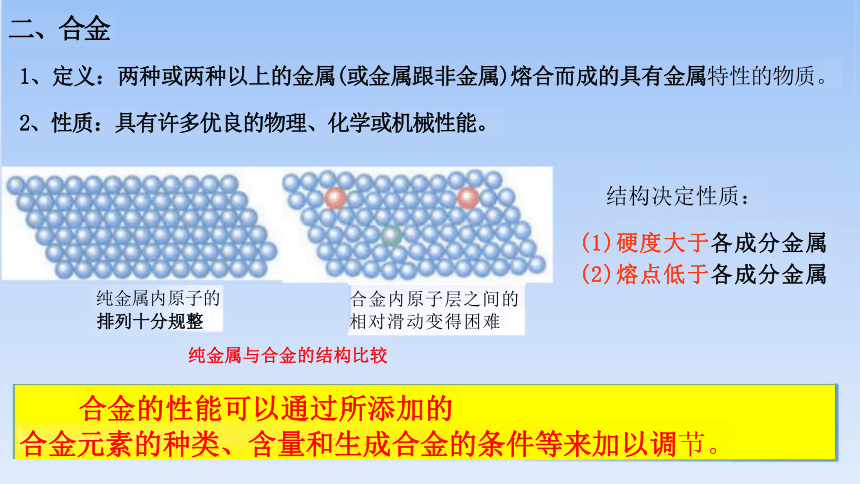
1、定义:两种或两种以上的金属(或金属跟非金属)熔合而成的具有金属特性的物质。
2、性质:具有许多优良的物理、化学或机械性能。
合金的性能可以通过所添加的
合金元素的种类、含量和生成合金的条件等来加以调节。
结构决定性质:
(1)硬度大于各成分金属
(2)熔点低于各成分金属
合金内原子层之间的 相对滑动变得困难
纯金属内原子的
排列十分规整
纯金属与合金的结构比较
[提醒]
(1)合金是混合物而不是纯净物。
(2)不锈钢的抗腐蚀能力比纯铁强。
(3)合金在许多方面不同于各成分金属,不是简单加合;
但在化学性质上,一般认为合金体现的是各成分金属的化学性质。
(4)并非所有的金属都能形成合金,两种金属形成合金,其前提是两种金属在同一温度 范围内都能熔化,若一种金属的熔点高于另一金属的沸点,则二者不能形成合金。
低 碳 钢 韧性、焊接性好,但强度低,用于制造钢板、钢丝和钢管等 (含碳0.03%~0.3%)
中 碳 钢 强度高,韧性及加工性好,用于制造钢轨、车轮和建材等 (含碳0.3%~0.6%)
高 碳 钢 硬而脆,热处理后弹性好,用于制造器械、弹簧和刀具等 (含碳0.6%~2%)
不 锈钢 它的合金元素主要是铬(Cr)和镍(Ni), 具有很强的抗腐蚀能力。 超 级 钢 具有优异的强度和延展性的结合。
生铁(含碳量在2%~4 . 3%之间,还含硅锰及少量磷)
性能:硬度大、抗压,性脆、可以铸造成型。
用途:是制造机座、管道的重要材料。
合金钢也叫特种钢,是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变 化,从而使钢具有各种特殊性能,如强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀等等。
碳素钢
钢
合金钢
(特种钢)
三、铁合金
图3-14 下水井盖是由生铁特造的
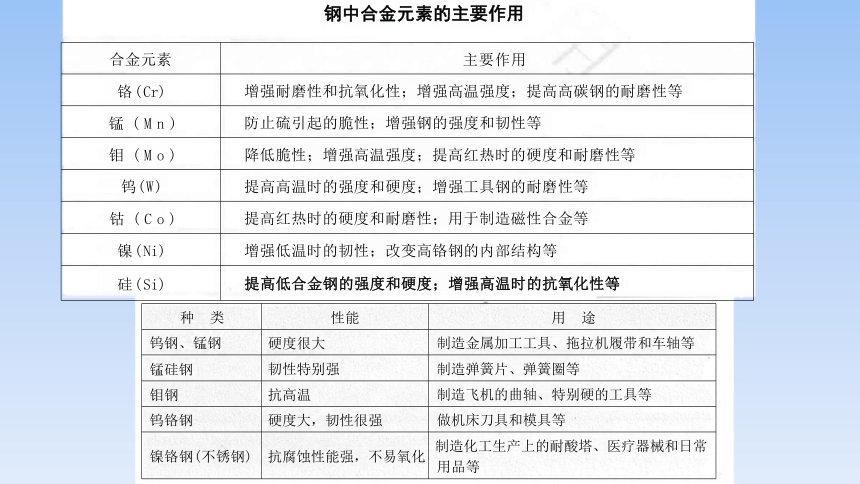
合金元素
主要作用
铬(Cr)
增强耐磨性和抗氧化性;增强高温强度;提高高碳钢的耐磨性等
锰 ( M n )
防止硫引起的脆性;增强钢的强度和韧性等
钼 ( M o )
降低脆性;增强高温强度;提高红热时的硬度和耐磨性等
钨(W)
提高高温时的强度和硬度;增强工具钢的耐磨性等
钴 ( C o )
提高红热时的硬度和耐磨性;用于制造磁性合金等
镍(Ni)
增强低温时的韧性;改变高铬钢的内部结构等
硅(Si)
提高低合金钢的强度和硬度;增强高温时的抗氧化性等
种 类 性能
用 途
钨钢、锰钢 硬度很大
制造金属加工工具、拖拉机履带和车轴等
锰硅钢 韧性特别强
制造弹簧片、弹簧圈等
钼钢 抗高温
制造飞机的曲轴、特别硬的工具等
钨铬钢 硬度大,韧性很强
做机床刀具和模具等
镍铬钢(不锈钢) 抗腐蚀性能强,不易氧化
制造化工生产上的耐酸塔、医疗器械和日常 用品等
钢中合金元素的主要作用
练一练
1.生铁的熔点是1100 ℃~1200 ℃,则可推断纯铁的熔点是 ( D )
A.1085 ℃ B.1160 ℃ C.1200 ℃ D.1535 ℃
2.下列有关铁和铁合金的说法错误的是 ( A)
A. 生铁比铁软 B. 铁有良好的导热性
C. 钢是铁的合金 D. 铁在潮湿的空气中容易生锈
3.生铁和钢组成上有什么不同
(1)钢的含碳量越低,韧性越好,硬度越低;
(2)含碳量越高,韧性越差,硬度越高。
(3)不同合金具有不同的性能。与钢铁相比,主要表现在机械强度、韧性、硬度、可 塑性、耐腐蚀性等方面
4.工业生产中常将两种金属在同一容器中加热使其熔化,冷却后得
到具有金属特性的熔合物—一合金。试根据下表所列金属的熔点和 沸点的数据(其它条件均已满足),判断哪种金属不易跟其它金属 制得合金 (填代号,双选)。
金属 Fe Cu Zn Ag Au
W
熔 点 ( ℃ ) 1535 1083 419.5 960.8 1063
3380
沸 点 ( ℃ ) 3000 2595 907 2212 2707
5637
A.Zn B.Fe C.W D.Ag
【答案】AC
【思考与讨论】
1、碳素钢的含碳量的高低与其硬度、韧性有何关系
【答】碳素钢的含碳量越高,硬度越大;
含碳量越低,韧性越好。
2、在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很 大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合金钢。这 对你有什么启示
启示:
1、合金元素不同,其性能不同
2、结构决定性能,性能决定其用途
3、改变合金元素来开发新功能的金属材料
四 、铜合金
(1)青铜是我国最早的合金,主要含铜和锡,有良好的强度和塑性、 耐磨、耐腐蚀,主要用于制机器零件如轴承、齿轮等。
(2)黄铜,主要含铜和锌,有良好的强度和塑性、易加工、耐腐蚀, 主要用于制机器零件、仪表和日用品。
(3)白铜,主要含铜和镍,它不容易生铜绿,常用于制造精密仪器和 装饰品。
五、铝和铝合金
1、铝的物理性质 氧48.60%
银白色金属、密度小、质软,熔点低、
良好的导电导热性和延展性。
2、铝的原子结构与化学性质
钾2.47% 镁2.00%
画出铝的原子结构示意图为: 氢0.76%
其他1.20%-
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg ..
Al的化学性质活泼,具有较强的还原性。
硅26.30%
铝7.73% 铁4.75% 钙3.45% 钠2.74%
问题3:Al的化学性质活泼,为什么不易被氧化呢
阅读课本P76第一段
资料卡片
铝制品的表面处理
在空气中,铝的表面自然形成的氧化膜很薄,耐磨性和抗 蚀性还不够强。为了使铝制品适应于不同的用途,常采用化学 方法对铝的表面进行处理,如增加膜的厚度,对氧化膜进行着 色等。例如,化学氧化(用铬酸作氧化剂)可以使氧化膜产生 美丽的颜色等。市场上有不少铝制品是经过这种方法处理的。
感受铝的氧化膜的存在
加热铝箔
实验现象:
铝箔熔化,表面失去光泽,熔化的铝并不滴落,
好象有一层膜兜着
活泼的金属在空气中易与氧气反应,生有一层 氧化物。有的氧化膜疏松,不能保护内层金属, 如铁和钠等。有的氧化物致密,可以保护内层金 属不被继续氧化,如镁和铝等。
【实验3-4】在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过
一段时间后,将点燃的木条放在试管口,你观察到什么现象
实验现象:铝片表面开始没有气泡,随后有大量气泡产生,试管壁有发热现象。 一段时间后,将点燃的木条放在试管口可观察到淡蓝色火焰。
实验结论:铝表 面 的保护膜和铝均能与盐酸发生反应。
Al O +6HCl===2AICl +3H O,
化学方程式:
2Al+6HCl===2AICl +3H 个
想象实验: 把一小块铝片分别与2mol/L的盐酸和1mol/L的硫酸反应,哪个反应
现象更明显、反应更剧烈
氯离子会破坏氧化膜的结构。
活泼金属铝的保护衣---氧化铝
为什么氯离子会破坏铝表面的氧化膜
成相膜理论的观点认为,由于氯离子半径小,穿透能力强,故它最 容易穿透氧化膜内极小的孔隙,到达金属表面,并与金属相互作用形成 了可溶性化合物,使氧化膜的结构发生变化,金属产生腐蚀。
吸附理论则认为,氯离子破坏氧化膜的根本原因是由于氯离子有很强 的可被金属吸附的能力,它们优先被金属吸附,并从金属表面把氧排 掉。因为氧决定着金属的钝化状态,氯离子和氧争夺金属表面上的吸 附点,甚至可以取代吸附中的钝化离子与金属形成氯化物,氯化物与金 属表面的吸附并不稳定,形成了可溶性物质,这样导致了腐蚀的加速。
实验3-5 实验现象 反应方程式
铝片与NaOH溶液 反应 开始没有气泡, 一段时 间后产生气泡,将点燃 的木条放在试管口可观 察到淡蓝色火焰。 ①Al O +2NaOH=2NaAl0 +H O
偏铝酸钠
②2Al+2NaOH+2H O=2NaAl0 +3H
铝片(打磨过) 与NaOH溶液反应 立即产生气泡,将点燃 的木条放在试管口可观 察到淡蓝色火焰。
2Al+2NaOH+2H O=2NaAl0 +3H A
【实验3-5】在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小 块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。 观察现象。过一段时间后,将点燃的木条分别放在两支试管口,你观察到什么现象
问:通过实验,你对铝和氧化铝的性质有什么认识
Al和A1 O 均能与酸、碱反应。 分别属于两性金属和两性氧化物。
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,例如Al O 。
【应用】由于Al 和A1 O 均能与酸、碱反应,氯离子又会破坏氧化膜的结构,因此 铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
问:氧化铝是两性氧化物,当作为酸性氧化物时,其对应的酸是什么酸 是几元酸
问:作为碱性氧化物时,其对应的碱是什么 Al(OH) = H AlO =HAlO +H O
铝酸 偏铝酸
其中[Al(OH) ]-=AlO +2H O, 因 此NaAlO 也可写成Na[Al(OH) ]。
Al是两性金属,试分析铝跟碱反应的本质
2Al+6H O=2Al(OH) +3H 个
十 Al(OH) +NaOH=NaAlO +2H O
2Al+6H O+2NaOH=2NaAlO +4H O+3H 个
2Al+2H O+2NaOH=2NaAlO +3H 个
问:铝与碱反应氧化剂是什么
名称 组成 主要性质
用途
铝合金 含有 10%-30%镁 硬度和强度都比纯铝和纯镁大
火 箭 、
飞 机 、
轮船等
硬铝 含有 Cu-4% Mg-0.5% Mn-0.5% Si-0.7% 强度和硬度都比纯铝大
铝合金
纯铝的硬度和强度较小,不适合制造机器零件等。
(P80 教材习题3)向一个铝质易拉罐中充满CO ,然后往罐中注人足量的浓NaOH溶液,
立即用胶布封严罐口。 一会儿听到罐内发出“咔、咔”的响声,且易拉罐变瘪;再 过一会儿易拉罐又鼓起来恢复原样。请完成下列空白。
(1)易拉罐变瘪的原因
CO 和NaOH 溶液反应,导致易拉罐内压强变小 _,反应的离子方程式
为 CO +2OH-==CO -+H O
(2)易拉罐又鼓起来的原因是
Al和NaOH溶液反应产生H , 导致易拉罐内压强又变大,反应的离子方程式为
2Al+20H-+2H O==2AlO -+3H 个
六 、新型合金
1、储氢合金
阅读教材P77-78, 思考以下问题:
(1)氢能的利用关键要解决什么问题
安全储存和运输问题
(2)储氢合金的储氢原理是什么
储氢合金是一类能够大量吸收H ,并 与
H 结合成金属氢化物的材料。
要求:储氢量大,金属氢化物既容易形成,稍稍 加热又容易分解,室温下吸、放氢的速率快。
2、钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、
生物工程和电子工业等领域。
钛合金 镍钴合金
图3-20 我国“蛟龙”号载人潜水器最关 键的部件——供人活动的耐压球 壳是用钛合金制造的
课堂练习
(P80教材习题9)我国发行的第五套人民币中,1元、5角和1角硬币的材 质分别为钢芯镀镍(1元)、钢芯镀铜(5角)和铝合金(1角)。请查阅资
料,讨论选择铸造硬币的金属材料时应考虑哪些因素。
(提示:选择铸造硬币的金属材料时,应该考虑的因素有硬度、
价格、光泽、耐磨性、耐腐蚀性、易加工程度等)
1、镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等 领域。下列关于镁铝合金性质的叙述中,不正确的是( C )
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
2、判断正误(正确的打“ √”,错误的打“×”)。
(1)合金中只存在金属元素,不可能有非金属元素。
( × )
(2)生铁的熔点比铁低,但机械强度和硬度比铁高。
( √ )
(3)生铁中的铁与纯铁的化学性质不同。
( × )
(4)硬铝、钢铁、水银均属于合金。
( × )
(5)镁铝熔合成合金的过程发生了化学变化。
( × )
(6)熔化烧碱可在氧化铝坩埚中进行。
( × )
(7)Al O 与少量的氢氧化钠溶液反应生成A1(OH) 沉淀。
( × )
(8)硬铝、生铁均属于混合物。
( √ )
3、将等物质的量的Na和A1两种金属加入足量的水中,生成26.88 L(标准状况下)
的气体,则下列描述错误的是 ( B )
A.金属Na无剩余 B.金属A1有剩余
C.所得溶液溶质为NaA10 D.Na的物质的量是0.6 mol
2Al+2NaOH+2H O=2NaAlO +3H 个
4、等体积、等物质的量浓度的稀硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加 入等质量的铝,生成氢气的体积之比为5:6,则甲、乙两烧杯中的反应情况是( B )
A. 甲、乙中都是铝过量 B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量 D.甲中酸过量,乙中碱过量
2Al+3H SO =Al (SO ) +3H 个
2Al+2NaOH+2H O=2NaAlO +3H 个
(3)A与Cl 混合光照可能发生爆炸,生成__HCl (填化学式) ,A 在该反应中 作为_ 还原剂 _ (填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有 AlO ,溶 液D中存在的金属离子为 Fe +。
气体A
Fe 、A 加入 OH溶液 →溶液B
→固体C-加入稀盐酸
X
a
操作
足量N
合物进行如下实验:
(1)操作X的名称是过滤。
(2)气体A是 H (或氢气)
5、铁和铝是科技、生产、生活中应用最广泛的金属材料。现有铁、铝的混
气体A
→溶液D
6、Al(OH)3既能与酸反应,生成铝盐(Al +), 又能与碱反应生成
偏铝酸盐(AIO - ),属于两性氢氧化物,试写出Al(OH) 与盐酸、 氢氧化钠溶液反应的离子方程式。
Al(OH) +3H+=Al ++3H O
Al(OH) +OH-=AlO -+2H O
第三章铁金属材料
金属材料
导热性 延展性 导电性
合金是由两种或两种以上的 金属(或金属和非金属) 熔合
而成的具有 金 属特性的物质。
1、大多数金属为银白色(铜:紫红色,金:黄色)固体(汞:液体)。
2、有金属光泽。
3、具有导电性、导热性和延展性。
金属材料:包括纯金属和合金
Cu
实际生活中却使用的最多的是合金,很少使用纯金属。
纯金属材料
Pt
因为铁的表面常常生锈,盖着一层黑色的四氧化三铁 与棕褐色的氧化铁的混合物,看去就是黑色的。所以人们 称之为“黑色金属”。又因为最常见的合金钢是锰钢与铬 钢,这样,人们把锰与铬也算成是“黑色金属”了。
黑色金属——铁、锰、铬三种。
有色金属——除“铁、锰、铬”三种外。
轻金属——密度小于4.5g/cm —-K、Na 、Mg、AI等
重金属——密度大于4.5g/cm ——Fe、Cu、Hg、Pb等
低熔点金属——K、Na、Mg、Al等
高熔点金属——W、Fe、Cu、Pb等
一、金属分类
按色泽分
按密度分
按熔点分
常见金属——Mg、Al、Fe、Cu等 贵金属——Ag、Pt、Au等
稀土金属——Y、Sc、镧系元素等
按使用频率分
金属
稀土元素。
包含元素:镧系元素(从镧到镥,原子序数从57~71的
15种元素)及 钪、钇共17种元素。
图 3 - 2 2 稀 土 元 素
镝 (Dy)
常用于制
造 硬 盘 驱
动器
二、合金
1、定义:两种或两种以上的金属(或金属跟非金属)熔合而成的具有金属特性的物质。
2、性质:具有许多优良的物理、化学或机械性能。
合金的性能可以通过所添加的
合金元素的种类、含量和生成合金的条件等来加以调节。
结构决定性质:
(1)硬度大于各成分金属
(2)熔点低于各成分金属
合金内原子层之间的 相对滑动变得困难
纯金属内原子的
排列十分规整
纯金属与合金的结构比较
[提醒]
(1)合金是混合物而不是纯净物。
(2)不锈钢的抗腐蚀能力比纯铁强。
(3)合金在许多方面不同于各成分金属,不是简单加合;
但在化学性质上,一般认为合金体现的是各成分金属的化学性质。
(4)并非所有的金属都能形成合金,两种金属形成合金,其前提是两种金属在同一温度 范围内都能熔化,若一种金属的熔点高于另一金属的沸点,则二者不能形成合金。
低 碳 钢 韧性、焊接性好,但强度低,用于制造钢板、钢丝和钢管等 (含碳0.03%~0.3%)
中 碳 钢 强度高,韧性及加工性好,用于制造钢轨、车轮和建材等 (含碳0.3%~0.6%)
高 碳 钢 硬而脆,热处理后弹性好,用于制造器械、弹簧和刀具等 (含碳0.6%~2%)
不 锈钢 它的合金元素主要是铬(Cr)和镍(Ni), 具有很强的抗腐蚀能力。 超 级 钢 具有优异的强度和延展性的结合。
生铁(含碳量在2%~4 . 3%之间,还含硅锰及少量磷)
性能:硬度大、抗压,性脆、可以铸造成型。
用途:是制造机座、管道的重要材料。
合金钢也叫特种钢,是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变 化,从而使钢具有各种特殊性能,如强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀等等。
碳素钢
钢
合金钢
(特种钢)
三、铁合金
图3-14 下水井盖是由生铁特造的
合金元素
主要作用
铬(Cr)
增强耐磨性和抗氧化性;增强高温强度;提高高碳钢的耐磨性等
锰 ( M n )
防止硫引起的脆性;增强钢的强度和韧性等
钼 ( M o )
降低脆性;增强高温强度;提高红热时的硬度和耐磨性等
钨(W)
提高高温时的强度和硬度;增强工具钢的耐磨性等
钴 ( C o )
提高红热时的硬度和耐磨性;用于制造磁性合金等
镍(Ni)
增强低温时的韧性;改变高铬钢的内部结构等
硅(Si)
提高低合金钢的强度和硬度;增强高温时的抗氧化性等
种 类 性能
用 途
钨钢、锰钢 硬度很大
制造金属加工工具、拖拉机履带和车轴等
锰硅钢 韧性特别强
制造弹簧片、弹簧圈等
钼钢 抗高温
制造飞机的曲轴、特别硬的工具等
钨铬钢 硬度大,韧性很强
做机床刀具和模具等
镍铬钢(不锈钢) 抗腐蚀性能强,不易氧化
制造化工生产上的耐酸塔、医疗器械和日常 用品等
钢中合金元素的主要作用
练一练
1.生铁的熔点是1100 ℃~1200 ℃,则可推断纯铁的熔点是 ( D )
A.1085 ℃ B.1160 ℃ C.1200 ℃ D.1535 ℃
2.下列有关铁和铁合金的说法错误的是 ( A)
A. 生铁比铁软 B. 铁有良好的导热性
C. 钢是铁的合金 D. 铁在潮湿的空气中容易生锈
3.生铁和钢组成上有什么不同
(1)钢的含碳量越低,韧性越好,硬度越低;
(2)含碳量越高,韧性越差,硬度越高。
(3)不同合金具有不同的性能。与钢铁相比,主要表现在机械强度、韧性、硬度、可 塑性、耐腐蚀性等方面
4.工业生产中常将两种金属在同一容器中加热使其熔化,冷却后得
到具有金属特性的熔合物—一合金。试根据下表所列金属的熔点和 沸点的数据(其它条件均已满足),判断哪种金属不易跟其它金属 制得合金 (填代号,双选)。
金属 Fe Cu Zn Ag Au
W
熔 点 ( ℃ ) 1535 1083 419.5 960.8 1063
3380
沸 点 ( ℃ ) 3000 2595 907 2212 2707
5637
A.Zn B.Fe C.W D.Ag
【答案】AC
【思考与讨论】
1、碳素钢的含碳量的高低与其硬度、韧性有何关系
【答】碳素钢的含碳量越高,硬度越大;
含碳量越低,韧性越好。
2、在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很 大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合金钢。这 对你有什么启示
启示:
1、合金元素不同,其性能不同
2、结构决定性能,性能决定其用途
3、改变合金元素来开发新功能的金属材料
四 、铜合金
(1)青铜是我国最早的合金,主要含铜和锡,有良好的强度和塑性、 耐磨、耐腐蚀,主要用于制机器零件如轴承、齿轮等。
(2)黄铜,主要含铜和锌,有良好的强度和塑性、易加工、耐腐蚀, 主要用于制机器零件、仪表和日用品。
(3)白铜,主要含铜和镍,它不容易生铜绿,常用于制造精密仪器和 装饰品。
五、铝和铝合金
1、铝的物理性质 氧48.60%
银白色金属、密度小、质软,熔点低、
良好的导电导热性和延展性。
2、铝的原子结构与化学性质
钾2.47% 镁2.00%
画出铝的原子结构示意图为: 氢0.76%
其他1.20%-
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg ..
Al的化学性质活泼,具有较强的还原性。
硅26.30%
铝7.73% 铁4.75% 钙3.45% 钠2.74%
问题3:Al的化学性质活泼,为什么不易被氧化呢
阅读课本P76第一段
资料卡片
铝制品的表面处理
在空气中,铝的表面自然形成的氧化膜很薄,耐磨性和抗 蚀性还不够强。为了使铝制品适应于不同的用途,常采用化学 方法对铝的表面进行处理,如增加膜的厚度,对氧化膜进行着 色等。例如,化学氧化(用铬酸作氧化剂)可以使氧化膜产生 美丽的颜色等。市场上有不少铝制品是经过这种方法处理的。
感受铝的氧化膜的存在
加热铝箔
实验现象:
铝箔熔化,表面失去光泽,熔化的铝并不滴落,
好象有一层膜兜着
活泼的金属在空气中易与氧气反应,生有一层 氧化物。有的氧化膜疏松,不能保护内层金属, 如铁和钠等。有的氧化物致密,可以保护内层金 属不被继续氧化,如镁和铝等。
【实验3-4】在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过
一段时间后,将点燃的木条放在试管口,你观察到什么现象
实验现象:铝片表面开始没有气泡,随后有大量气泡产生,试管壁有发热现象。 一段时间后,将点燃的木条放在试管口可观察到淡蓝色火焰。
实验结论:铝表 面 的保护膜和铝均能与盐酸发生反应。
Al O +6HCl===2AICl +3H O,
化学方程式:
2Al+6HCl===2AICl +3H 个
想象实验: 把一小块铝片分别与2mol/L的盐酸和1mol/L的硫酸反应,哪个反应
现象更明显、反应更剧烈
氯离子会破坏氧化膜的结构。
活泼金属铝的保护衣---氧化铝
为什么氯离子会破坏铝表面的氧化膜
成相膜理论的观点认为,由于氯离子半径小,穿透能力强,故它最 容易穿透氧化膜内极小的孔隙,到达金属表面,并与金属相互作用形成 了可溶性化合物,使氧化膜的结构发生变化,金属产生腐蚀。
吸附理论则认为,氯离子破坏氧化膜的根本原因是由于氯离子有很强 的可被金属吸附的能力,它们优先被金属吸附,并从金属表面把氧排 掉。因为氧决定着金属的钝化状态,氯离子和氧争夺金属表面上的吸 附点,甚至可以取代吸附中的钝化离子与金属形成氯化物,氯化物与金 属表面的吸附并不稳定,形成了可溶性物质,这样导致了腐蚀的加速。
实验3-5 实验现象 反应方程式
铝片与NaOH溶液 反应 开始没有气泡, 一段时 间后产生气泡,将点燃 的木条放在试管口可观 察到淡蓝色火焰。 ①Al O +2NaOH=2NaAl0 +H O
偏铝酸钠
②2Al+2NaOH+2H O=2NaAl0 +3H
铝片(打磨过) 与NaOH溶液反应 立即产生气泡,将点燃 的木条放在试管口可观 察到淡蓝色火焰。
2Al+2NaOH+2H O=2NaAl0 +3H A
【实验3-5】在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小 块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。 观察现象。过一段时间后,将点燃的木条分别放在两支试管口,你观察到什么现象
问:通过实验,你对铝和氧化铝的性质有什么认识
Al和A1 O 均能与酸、碱反应。 分别属于两性金属和两性氧化物。
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,例如Al O 。
【应用】由于Al 和A1 O 均能与酸、碱反应,氯离子又会破坏氧化膜的结构,因此 铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
问:氧化铝是两性氧化物,当作为酸性氧化物时,其对应的酸是什么酸 是几元酸
问:作为碱性氧化物时,其对应的碱是什么 Al(OH) = H AlO =HAlO +H O
铝酸 偏铝酸
其中[Al(OH) ]-=AlO +2H O, 因 此NaAlO 也可写成Na[Al(OH) ]。
Al是两性金属,试分析铝跟碱反应的本质
2Al+6H O=2Al(OH) +3H 个
十 Al(OH) +NaOH=NaAlO +2H O
2Al+6H O+2NaOH=2NaAlO +4H O+3H 个
2Al+2H O+2NaOH=2NaAlO +3H 个
问:铝与碱反应氧化剂是什么
名称 组成 主要性质
用途
铝合金 含有 10%-30%镁 硬度和强度都比纯铝和纯镁大
火 箭 、
飞 机 、
轮船等
硬铝 含有 Cu-4% Mg-0.5% Mn-0.5% Si-0.7% 强度和硬度都比纯铝大
铝合金
纯铝的硬度和强度较小,不适合制造机器零件等。
(P80 教材习题3)向一个铝质易拉罐中充满CO ,然后往罐中注人足量的浓NaOH溶液,
立即用胶布封严罐口。 一会儿听到罐内发出“咔、咔”的响声,且易拉罐变瘪;再 过一会儿易拉罐又鼓起来恢复原样。请完成下列空白。
(1)易拉罐变瘪的原因
CO 和NaOH 溶液反应,导致易拉罐内压强变小 _,反应的离子方程式
为 CO +2OH-==CO -+H O
(2)易拉罐又鼓起来的原因是
Al和NaOH溶液反应产生H , 导致易拉罐内压强又变大,反应的离子方程式为
2Al+20H-+2H O==2AlO -+3H 个
六 、新型合金
1、储氢合金
阅读教材P77-78, 思考以下问题:
(1)氢能的利用关键要解决什么问题
安全储存和运输问题
(2)储氢合金的储氢原理是什么
储氢合金是一类能够大量吸收H ,并 与
H 结合成金属氢化物的材料。
要求:储氢量大,金属氢化物既容易形成,稍稍 加热又容易分解,室温下吸、放氢的速率快。
2、钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、
生物工程和电子工业等领域。
钛合金 镍钴合金
图3-20 我国“蛟龙”号载人潜水器最关 键的部件——供人活动的耐压球 壳是用钛合金制造的
课堂练习
(P80教材习题9)我国发行的第五套人民币中,1元、5角和1角硬币的材 质分别为钢芯镀镍(1元)、钢芯镀铜(5角)和铝合金(1角)。请查阅资
料,讨论选择铸造硬币的金属材料时应考虑哪些因素。
(提示:选择铸造硬币的金属材料时,应该考虑的因素有硬度、
价格、光泽、耐磨性、耐腐蚀性、易加工程度等)
1、镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等 领域。下列关于镁铝合金性质的叙述中,不正确的是( C )
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
2、判断正误(正确的打“ √”,错误的打“×”)。
(1)合金中只存在金属元素,不可能有非金属元素。
( × )
(2)生铁的熔点比铁低,但机械强度和硬度比铁高。
( √ )
(3)生铁中的铁与纯铁的化学性质不同。
( × )
(4)硬铝、钢铁、水银均属于合金。
( × )
(5)镁铝熔合成合金的过程发生了化学变化。
( × )
(6)熔化烧碱可在氧化铝坩埚中进行。
( × )
(7)Al O 与少量的氢氧化钠溶液反应生成A1(OH) 沉淀。
( × )
(8)硬铝、生铁均属于混合物。
( √ )
3、将等物质的量的Na和A1两种金属加入足量的水中,生成26.88 L(标准状况下)
的气体,则下列描述错误的是 ( B )
A.金属Na无剩余 B.金属A1有剩余
C.所得溶液溶质为NaA10 D.Na的物质的量是0.6 mol
2Al+2NaOH+2H O=2NaAlO +3H 个
4、等体积、等物质的量浓度的稀硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加 入等质量的铝,生成氢气的体积之比为5:6,则甲、乙两烧杯中的反应情况是( B )
A. 甲、乙中都是铝过量 B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量 D.甲中酸过量,乙中碱过量
2Al+3H SO =Al (SO ) +3H 个
2Al+2NaOH+2H O=2NaAlO +3H 个
(3)A与Cl 混合光照可能发生爆炸,生成__HCl (填化学式) ,A 在该反应中 作为_ 还原剂 _ (填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有 AlO ,溶 液D中存在的金属离子为 Fe +。
气体A
Fe 、A 加入 OH溶液 →溶液B
→固体C-加入稀盐酸
X
a
操作
足量N
合物进行如下实验:
(1)操作X的名称是过滤。
(2)气体A是 H (或氢气)
5、铁和铝是科技、生产、生活中应用最广泛的金属材料。现有铁、铝的混
气体A
→溶液D
6、Al(OH)3既能与酸反应,生成铝盐(Al +), 又能与碱反应生成
偏铝酸盐(AIO - ),属于两性氢氧化物,试写出Al(OH) 与盐酸、 氢氧化钠溶液反应的离子方程式。
Al(OH) +3H+=Al ++3H O
Al(OH) +OH-=AlO -+2H O
