4.1.1 原子结构与元素周期表 教学课件(共28张PPT) —高中化学人教版(2019)必修一
文档属性
| 名称 | 4.1.1 原子结构与元素周期表 教学课件(共28张PPT) —高中化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 20:17:32 | ||
图片预览





文档简介
(共28张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第一课时 原子结构
原子结构发展史
春秋战国时期,墨子、惠子等哲学家同样从不同角度提出了物质有不能再分的最小单位的观点。
公元前450年以前,古希腊哲学家德谟克利特提出,宇宙万物都是由最微小、坚硬、不可入,不可分割的物质粒子所构成的。这种粒子就是原子。
原子结构发展史
现代电子云模型
道尔顿——
实心球模型
汤姆生——
“葡萄干布丁”模型
卢瑟福——
行星模型
玻尔——
量子轨道模型
原子结构发展史
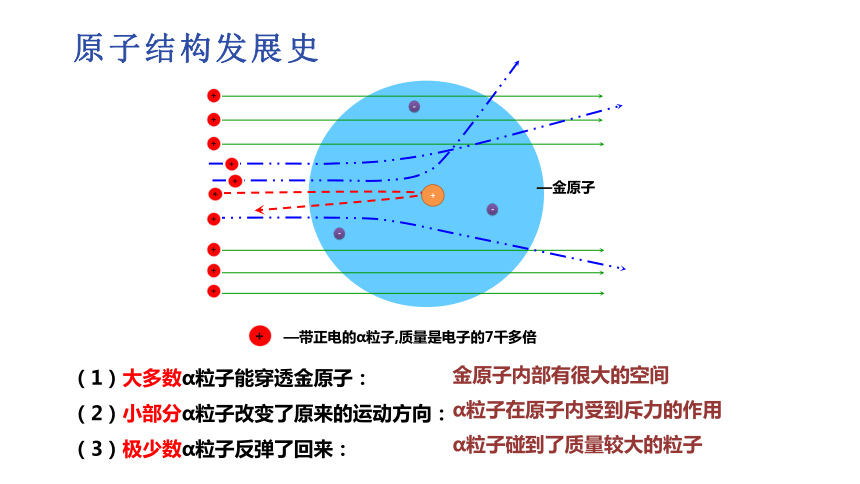
1909年至1911年,英国物理学家卢瑟福和他的合作者通过α粒子的散射实验,提出了原子结构的核式结构学说。
原子结构发展史
原子结构发展史
金原子
α粒子束(带正电)
原子结构发展史
—金原子
+
-
-
-
—带正电的α粒子,质量是电子的7千多倍
(1)大多数α粒子能穿透金原子:
(2)小部分α粒子改变了原来的运动方向:
(3)极少数α粒子反弹了回来:
α粒子碰到了质量较大的粒子
α粒子在原子内受到斥力的作用
金原子内部有很大的空间
原子结构
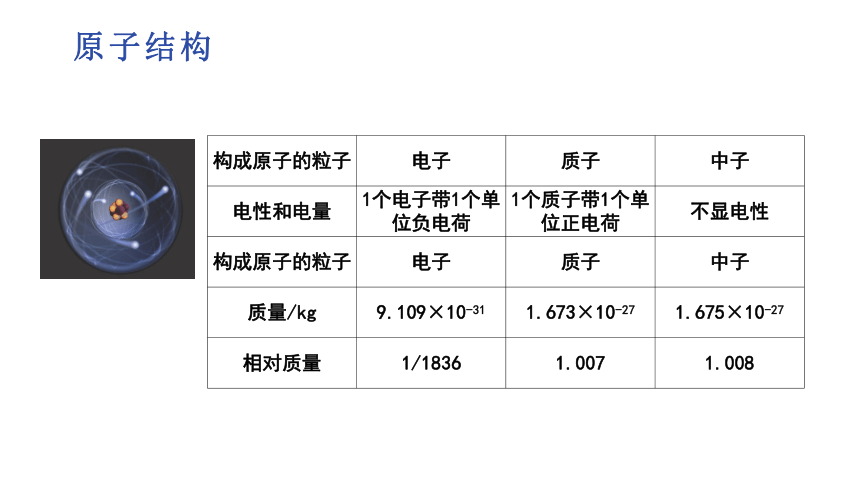
构成原子的粒子 电子 质子 中子
电性和电量 1个电子带1个单位负电荷 1个质子带1个单位正电荷 不显电性
构成原子的粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 1/1836 1.007 1.008
原子结构
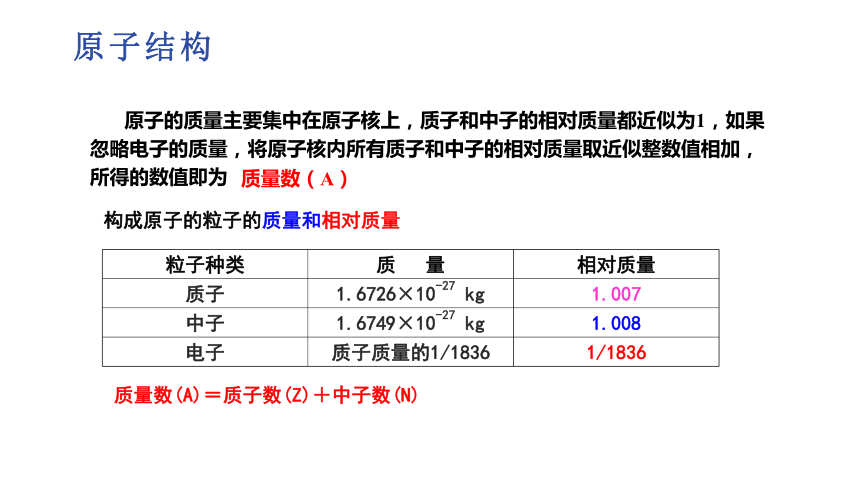
原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值即为
质量数(A)
构成原子的粒子的质量和相对质量
粒子种类 质 量 相对质量
质子 1.6726×10-27 kg 1.007
中子 1.6749×10-27 kg 1.008
电子 质子质量的1/1836 1/1836
质量数(A)=质子数(Z)+中子数(N)
原子结构
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
将几种原子的质子数和中子数之和(质量数)填入上表,
19
23
27
质量数与原子的相对原子质量作比较,你能得出什么结论
相对原子质量≈质量数
原子结构
质量数(A) = 质子数(Z) + 中子数(N)
原子:核电荷数= 核内质子数= 核外电子数
阳离子:核电荷数=核内质子数> 核外电子数
阴离子:核电荷数=核内质子数< 核外电子数
X
质量数
元素符号
质子数
符号表征
表示的意义是质子数为Z,质量数为A的X元素的一种_____。
原子
核外电子排布
K
L
M
N
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由近到远 能量高低 由低到高 核外电子排布
研究、思考与讨论表格中数据:
能量规律:离核由近到远,电子能量由低到高
数量规律:
每层最多容纳的电子数为2n2个
最外层不超过8个(K层为最外层时不超过2个)
次外层不超过18个,倒数第三层不超过32个
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
②Ca_______,Ca2+_______。
核外电子排布
1.将Na、K的原子结构示意图分别写成 正确吗?若不正确,请说明原因。
2.画出下列原子或离子的结构示意图。
①S______, S2-_______;
3.请同学们课下画出1-20号元素原子结构示意图
元素周期表
法国化学家拉瓦锡
(1743-1794)
1789年在《化学概要》中提出了第一张元素分类表。
法国化学家拉瓦锡
1789年在《化学概要》中提出了第一个元素分类表。
德国化学家德贝莱纳
(1780-1849)
1829年提出“三素组”的概念。
(1743-1794)
元素周期表
法国化学家拉瓦锡
(1743-1794)
1789年在《化学概要》中提出了第一个元素分类表。
德国化学家德贝莱纳
(1780-1849)
1829年提出“三素组”的概念。
俄国化学家门捷列夫
(1834-1907)
1869年2月编制了第一张元素周期表。
元素周期表
1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大的顺序排列,将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。
元素周期表
(1866-1919)
瑞士化学家维尔纳
1905年制成了现代形式的元素周期表。
英国物理学家莫塞莱
(1887-1915)
1913年发现并证明元素的原子序数等于原子的核电荷数。
元素周期表
按照元素在周期表中的顺序给元素编号,得到原子序数。
结合1-18号元素原子的结构示意图和元素周期表中1-18号元素的排列,分析一下我们现在使用的元素周期表的排列规律。
原子序数=核电荷数=质子数=核外电子数
编排原则
把__________相同的元素,按___________递增顺序从左到右排列
电子层数
原子序数
把_______________相同的元素,按_____________递增的顺序由上而下排列
最外层电子数
电子层数
元素周期表
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
第六周期:32 种元素
第七周期:32种元素
周期数=电子层数
元素周期表
类别 周期序数 起止元素 包括元 素种数 核外电 子层数 稀有气体 原子序数 位置与结
构的关系
短周期 1 H~He 周期序数___电子层数
2 3 长周期 4 5 6 7 Fr~Og(118号) Li~Ne
Na~Ar
K~Kr
Rb~Xe
Cs~Rn
2
8
8
18
18
32
32
1
2
2
10
3
18
4
36
5
54
6
86
7
118
=
元素周期表
主族:由长周期元素和短周期元素共同组成的族 大写罗马数字加A
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族:完全由长周期元素组成的族 大写罗马数字加B(第Ⅷ族以外)
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
稀有气体元素化学性质不活泼,其化合价定为0,统称0族
0族
碱金属元素
卤族元素
随堂练习
1.判断正误,正确的打“√”,错误的打“×”。
(1)原子是由质子和中子组成的。( )
(2)离核越近的电子能量越高。( )
(3)M层是最外层时,可以排布18个电子。( )
(4)元素周期表中共有18个纵行,16个族。( )
(5)原子的最外层有2个电子的元素一定是第ⅡA族元素。( )
(6)同主族元素的最外层电子数一定相同。( )
×
×
×
√
√
×
随堂练习
2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数
B
随堂练习
3.下列选项各截取了元素周期表的一部分,数字为原子序数,其中M的原子序数为37的是
C
随堂练习
4. 前18号元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
A.C>D>B>A B.D>B>A>C
C.A>D>C>B D.B>A>C>D
A
随堂练习
谢谢观看
THANK YOU
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第一课时 原子结构
原子结构发展史
春秋战国时期,墨子、惠子等哲学家同样从不同角度提出了物质有不能再分的最小单位的观点。
公元前450年以前,古希腊哲学家德谟克利特提出,宇宙万物都是由最微小、坚硬、不可入,不可分割的物质粒子所构成的。这种粒子就是原子。
原子结构发展史
现代电子云模型
道尔顿——
实心球模型
汤姆生——
“葡萄干布丁”模型
卢瑟福——
行星模型
玻尔——
量子轨道模型
原子结构发展史
1909年至1911年,英国物理学家卢瑟福和他的合作者通过α粒子的散射实验,提出了原子结构的核式结构学说。
原子结构发展史
原子结构发展史
金原子
α粒子束(带正电)
原子结构发展史
—金原子
+
-
-
-
—带正电的α粒子,质量是电子的7千多倍
(1)大多数α粒子能穿透金原子:
(2)小部分α粒子改变了原来的运动方向:
(3)极少数α粒子反弹了回来:
α粒子碰到了质量较大的粒子
α粒子在原子内受到斥力的作用
金原子内部有很大的空间
原子结构
构成原子的粒子 电子 质子 中子
电性和电量 1个电子带1个单位负电荷 1个质子带1个单位正电荷 不显电性
构成原子的粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 1/1836 1.007 1.008
原子结构
原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值即为
质量数(A)
构成原子的粒子的质量和相对质量
粒子种类 质 量 相对质量
质子 1.6726×10-27 kg 1.007
中子 1.6749×10-27 kg 1.008
电子 质子质量的1/1836 1/1836
质量数(A)=质子数(Z)+中子数(N)
原子结构
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
将几种原子的质子数和中子数之和(质量数)填入上表,
19
23
27
质量数与原子的相对原子质量作比较,你能得出什么结论
相对原子质量≈质量数
原子结构
质量数(A) = 质子数(Z) + 中子数(N)
原子:核电荷数= 核内质子数= 核外电子数
阳离子:核电荷数=核内质子数> 核外电子数
阴离子:核电荷数=核内质子数< 核外电子数
X
质量数
元素符号
质子数
符号表征
表示的意义是质子数为Z,质量数为A的X元素的一种_____。
原子
核外电子排布
K
L
M
N
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由近到远 能量高低 由低到高 核外电子排布
研究、思考与讨论表格中数据:
能量规律:离核由近到远,电子能量由低到高
数量规律:
每层最多容纳的电子数为2n2个
最外层不超过8个(K层为最外层时不超过2个)
次外层不超过18个,倒数第三层不超过32个
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
②Ca_______,Ca2+_______。
核外电子排布
1.将Na、K的原子结构示意图分别写成 正确吗?若不正确,请说明原因。
2.画出下列原子或离子的结构示意图。
①S______, S2-_______;
3.请同学们课下画出1-20号元素原子结构示意图
元素周期表
法国化学家拉瓦锡
(1743-1794)
1789年在《化学概要》中提出了第一张元素分类表。
法国化学家拉瓦锡
1789年在《化学概要》中提出了第一个元素分类表。
德国化学家德贝莱纳
(1780-1849)
1829年提出“三素组”的概念。
(1743-1794)
元素周期表
法国化学家拉瓦锡
(1743-1794)
1789年在《化学概要》中提出了第一个元素分类表。
德国化学家德贝莱纳
(1780-1849)
1829年提出“三素组”的概念。
俄国化学家门捷列夫
(1834-1907)
1869年2月编制了第一张元素周期表。
元素周期表
1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大的顺序排列,将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。
元素周期表
(1866-1919)
瑞士化学家维尔纳
1905年制成了现代形式的元素周期表。
英国物理学家莫塞莱
(1887-1915)
1913年发现并证明元素的原子序数等于原子的核电荷数。
元素周期表
按照元素在周期表中的顺序给元素编号,得到原子序数。
结合1-18号元素原子的结构示意图和元素周期表中1-18号元素的排列,分析一下我们现在使用的元素周期表的排列规律。
原子序数=核电荷数=质子数=核外电子数
编排原则
把__________相同的元素,按___________递增顺序从左到右排列
电子层数
原子序数
把_______________相同的元素,按_____________递增的顺序由上而下排列
最外层电子数
电子层数
元素周期表
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
第六周期:32 种元素
第七周期:32种元素
周期数=电子层数
元素周期表
类别 周期序数 起止元素 包括元 素种数 核外电 子层数 稀有气体 原子序数 位置与结
构的关系
短周期 1 H~He 周期序数___电子层数
2 3 长周期 4 5 6 7 Fr~Og(118号) Li~Ne
Na~Ar
K~Kr
Rb~Xe
Cs~Rn
2
8
8
18
18
32
32
1
2
2
10
3
18
4
36
5
54
6
86
7
118
=
元素周期表
主族:由长周期元素和短周期元素共同组成的族 大写罗马数字加A
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族:完全由长周期元素组成的族 大写罗马数字加B(第Ⅷ族以外)
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
稀有气体元素化学性质不活泼,其化合价定为0,统称0族
0族
碱金属元素
卤族元素
随堂练习
1.判断正误,正确的打“√”,错误的打“×”。
(1)原子是由质子和中子组成的。( )
(2)离核越近的电子能量越高。( )
(3)M层是最外层时,可以排布18个电子。( )
(4)元素周期表中共有18个纵行,16个族。( )
(5)原子的最外层有2个电子的元素一定是第ⅡA族元素。( )
(6)同主族元素的最外层电子数一定相同。( )
×
×
×
√
√
×
随堂练习
2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数
B
随堂练习
3.下列选项各截取了元素周期表的一部分,数字为原子序数,其中M的原子序数为37的是
C
随堂练习
4. 前18号元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
A.C>D>B>A B.D>B>A>C
C.A>D>C>B D.B>A>C>D
A
随堂练习
谢谢观看
THANK YOU
