实验活动4 简单的电镀实验 课件(共22张PPT)高中化学人教版(2019)选择性必修一
文档属性
| 名称 | 实验活动4 简单的电镀实验 课件(共22张PPT)高中化学人教版(2019)选择性必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 126.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 21:07:03 | ||
图片预览






文档简介
(共21张PPT)
第四章 化学反应与电能
实验活动4 简单的电镀实验
电镀
电镀
【实验目的】
1.认识电解原理及其在工业生产中的应用。
2.了解电镀的原理。
【实验用品】
烧杯、砂纸、导线、2~3 V的直流电源。
铁制镀件、铜片、电镀液(以CuSO4溶液为主配制)、1 mol·L-1 NaOH溶液、20%盐酸。
电镀
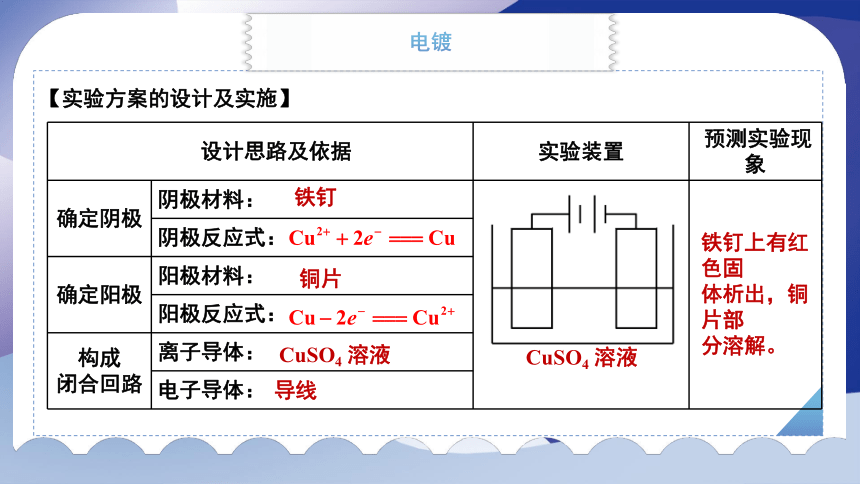
【实验方案的设计及实施】
设计思路及依据 实验装置 预测实验现象
确定阴极 阴极材料:
阴极反应式: 确定阳极 阳极材料: 阳极反应式: 构成 闭合回路 离子导体: 电子导体: 铁钉
铜片
CuSO4 溶液
导线
铁钉上有红色固
体析出,铜片部
分溶解。
CuSO4 溶液
电镀
【实验步骤】
1.把铁制镀件用砂纸打磨干净,放入1 mol·L-1 NaOH溶液中除去油污,然后用蒸馏水洗净。再放入20%盐酸中除锈,几分钟后取出,
并用蒸馏水洗净。
2.把铁制镀件与2~3 V的直流电源的负极相连,铜片与
直流电源的正极相连(如图S4-1所示)。将两极平行浸
入电镀液中。两极间距约5 cm,5~10 min后取出,观察
铁制镀件 。
表面出现一层光亮的红色物质
电镀
电镀
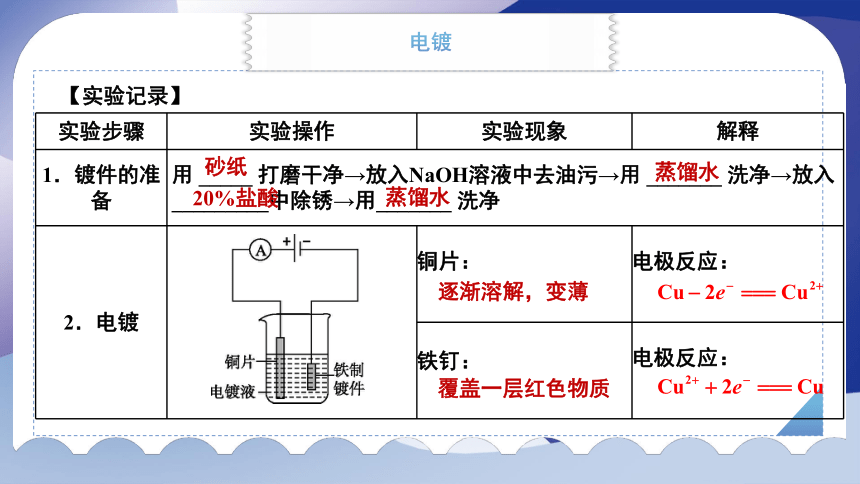
实验步骤 实验操作 实验现象 解释
1.镀件的准备 用 _____ 打磨干净→放入NaOH溶液中去油污→用 _______ 洗净→放入 _________中除锈→用_______ 洗净 2.电镀 铜片: 电极反应:
铁钉: 电极反应:
【实验记录】
砂纸
蒸馏水
20%盐酸
蒸馏水
逐渐溶解,变薄
覆盖一层红色物质
电镀
【问题和讨论】
1.电镀前,如果将铜片与直流电源的负极相连,铁制镀件与直流电源的正极相连,通电后观察到的现象是什么 阳极和阴极发生的反应分别是什么
铁制镀件逐渐溶解,铜片逐渐增粗。
阳极发生的反应:Fe-2e-= Fe2+
阴极发生的反应:Cu2++2e-= Cu
2.电镀后,电解质溶液中的离子浓度如何变化?
基本保持不变。
扩展延伸
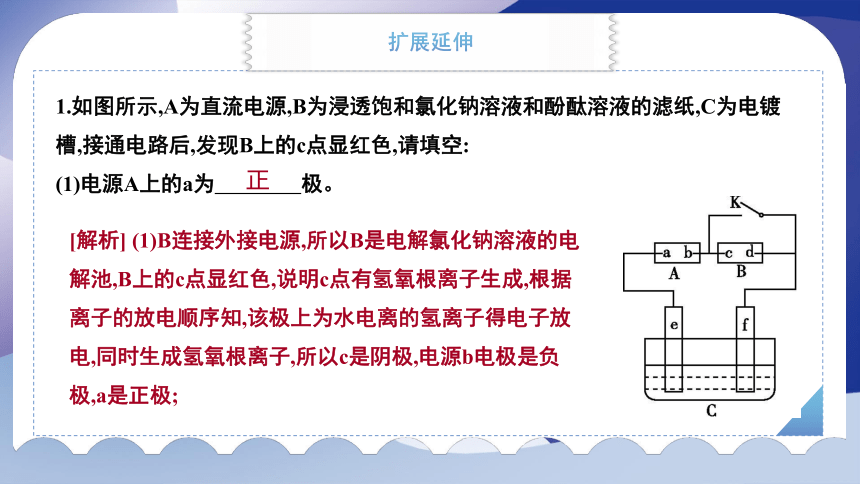
1.如图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为 极。
正
[解析] (1)B连接外接电源,所以B是电解氯化钠溶液的电解池,B上的c点显红色,说明c点有氢氧根离子生成,根据离子的放电顺序知,该极上为水电离的氢离子得电子放电,同时生成氢氧根离子,所以c是阴极,电源b电极是负极,a是正极;
扩展延伸
(2)滤纸B上发生的总化学方程式为
。
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
[解析] (2)电解氯化钠溶液时,溶液中的离子放电顺序为:氢离子放电能力大于钠离子,氯离子放电能力大于氢氧根离子,所以电解氯化钠溶液时生成物是氯气、氢气、氢氧化钠。
扩展延伸
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为 ,电极f上发生的反应为 ,槽中盛放的镀液可以是 溶液。
Zn-2e-=Zn2+
Zn2++2e-=Zn
ZnCl2(ZnSO4)(合理即可)
[解析] (3)电镀时,e是阳极,f是阴极,镀层锌作阳极,镀件铁作阴极,阳极上Zn失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质,所以阳极e上电极反应式为Zn-2e-=Zn2+;阴极f上的电极反应式为Zn2++2e-=Zn;电镀液的选取:用含有镀层金属离子的溶液作电镀液,所以可选ZnCl2(ZnSO4)溶液作电镀液。
扩展延伸
2.电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
①Y电极上的电极反应式为 。
在X极附近观察到的现象是 。
②电解总反应离子方程式为
。
2Cl-+2H2O 2OH-+Cl2↑+H2↑
2Cl--2e-=Cl2↑
有气泡产生,溶液变红
扩展延伸
[解析] (1)①Y为阳极,阴离子在阳极得到电子,电解食盐水时阳极电极反应式为2Cl--2e-=Cl2↑,X为阴极,阴极电极反应式为2H++2e-=H2↑,c(H+)减小,溶液显碱性,所以在X极可以看到有气泡产生,溶液变红。
扩展延伸
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
①Y电极的材料是 (选填“纯铁”“纯铜”或“纯锌”),
电极反应式是 。电解液a选用 溶液,
电解过程中其浓度 (选填“增大”“减小”或“不变”)。
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为 mol。
纯铜
Cu-2e-=Cu2+
CuSO4
不变
0.08
扩展延伸
随堂训练
1.用铁棒和铜棒做电极,模拟在铁棒上镀铜,实验装置如图所示,下列判断正确的是( )
A.溶液中阳离子移向 b 极发生还原反应
B.铜棒的材质必须用纯铜
C.电解一段时间后加 Cu(OH)2 固体使溶液恢复原来的浓度
D.该实验过程中电解质溶液的 pH 会不断减小
A
随堂训练
2.目前市面上的很多银纪念币材料为铜芯镀银,依据你所掌握的电镀原理,你认为
这种银纪念币制作时,铜芯应作( )
A.阳极 B.阴极
C.正极 D.负极
B
随堂训练
3.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
A.通电后,Ag+ 向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
C
随堂训练
4.依据甲、乙、丙三图,判断下列叙述中不正确的是( )
甲 乙 丙
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙装置中,铜极因发生氧化反应而溶解
D.乙装置中,c(Cu2+) 不变,丙装置中, c(Cu2+) 减小
B
随堂训练
5.如图所示,甲为电镀银装置,下列对该装置的有关叙述中正确的是
( )
甲 乙 丙
A.P 是电源的正极
B.F 极上发生的反应为
C.电解时,甲、乙、丙三池中,除 E、F 两极外,其余电极均参加了反应
D.通电后,甲池溶液的 pH 减小,而乙、丙两池溶液的 pH 不变
B
谢谢观看SHUAN Q for watching!
第四章 化学反应与电能
实验活动4 简单的电镀实验
电镀
电镀
【实验目的】
1.认识电解原理及其在工业生产中的应用。
2.了解电镀的原理。
【实验用品】
烧杯、砂纸、导线、2~3 V的直流电源。
铁制镀件、铜片、电镀液(以CuSO4溶液为主配制)、1 mol·L-1 NaOH溶液、20%盐酸。
电镀
【实验方案的设计及实施】
设计思路及依据 实验装置 预测实验现象
确定阴极 阴极材料:
阴极反应式: 确定阳极 阳极材料: 阳极反应式: 构成 闭合回路 离子导体: 电子导体: 铁钉
铜片
CuSO4 溶液
导线
铁钉上有红色固
体析出,铜片部
分溶解。
CuSO4 溶液
电镀
【实验步骤】
1.把铁制镀件用砂纸打磨干净,放入1 mol·L-1 NaOH溶液中除去油污,然后用蒸馏水洗净。再放入20%盐酸中除锈,几分钟后取出,
并用蒸馏水洗净。
2.把铁制镀件与2~3 V的直流电源的负极相连,铜片与
直流电源的正极相连(如图S4-1所示)。将两极平行浸
入电镀液中。两极间距约5 cm,5~10 min后取出,观察
铁制镀件 。
表面出现一层光亮的红色物质
电镀
电镀
实验步骤 实验操作 实验现象 解释
1.镀件的准备 用 _____ 打磨干净→放入NaOH溶液中去油污→用 _______ 洗净→放入 _________中除锈→用_______ 洗净 2.电镀 铜片: 电极反应:
铁钉: 电极反应:
【实验记录】
砂纸
蒸馏水
20%盐酸
蒸馏水
逐渐溶解,变薄
覆盖一层红色物质
电镀
【问题和讨论】
1.电镀前,如果将铜片与直流电源的负极相连,铁制镀件与直流电源的正极相连,通电后观察到的现象是什么 阳极和阴极发生的反应分别是什么
铁制镀件逐渐溶解,铜片逐渐增粗。
阳极发生的反应:Fe-2e-= Fe2+
阴极发生的反应:Cu2++2e-= Cu
2.电镀后,电解质溶液中的离子浓度如何变化?
基本保持不变。
扩展延伸
1.如图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为 极。
正
[解析] (1)B连接外接电源,所以B是电解氯化钠溶液的电解池,B上的c点显红色,说明c点有氢氧根离子生成,根据离子的放电顺序知,该极上为水电离的氢离子得电子放电,同时生成氢氧根离子,所以c是阴极,电源b电极是负极,a是正极;
扩展延伸
(2)滤纸B上发生的总化学方程式为
。
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
[解析] (2)电解氯化钠溶液时,溶液中的离子放电顺序为:氢离子放电能力大于钠离子,氯离子放电能力大于氢氧根离子,所以电解氯化钠溶液时生成物是氯气、氢气、氢氧化钠。
扩展延伸
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为 ,电极f上发生的反应为 ,槽中盛放的镀液可以是 溶液。
Zn-2e-=Zn2+
Zn2++2e-=Zn
ZnCl2(ZnSO4)(合理即可)
[解析] (3)电镀时,e是阳极,f是阴极,镀层锌作阳极,镀件铁作阴极,阳极上Zn失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质,所以阳极e上电极反应式为Zn-2e-=Zn2+;阴极f上的电极反应式为Zn2++2e-=Zn;电镀液的选取:用含有镀层金属离子的溶液作电镀液,所以可选ZnCl2(ZnSO4)溶液作电镀液。
扩展延伸
2.电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
①Y电极上的电极反应式为 。
在X极附近观察到的现象是 。
②电解总反应离子方程式为
。
2Cl-+2H2O 2OH-+Cl2↑+H2↑
2Cl--2e-=Cl2↑
有气泡产生,溶液变红
扩展延伸
[解析] (1)①Y为阳极,阴离子在阳极得到电子,电解食盐水时阳极电极反应式为2Cl--2e-=Cl2↑,X为阴极,阴极电极反应式为2H++2e-=H2↑,c(H+)减小,溶液显碱性,所以在X极可以看到有气泡产生,溶液变红。
扩展延伸
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
①Y电极的材料是 (选填“纯铁”“纯铜”或“纯锌”),
电极反应式是 。电解液a选用 溶液,
电解过程中其浓度 (选填“增大”“减小”或“不变”)。
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为 mol。
纯铜
Cu-2e-=Cu2+
CuSO4
不变
0.08
扩展延伸
随堂训练
1.用铁棒和铜棒做电极,模拟在铁棒上镀铜,实验装置如图所示,下列判断正确的是( )
A.溶液中阳离子移向 b 极发生还原反应
B.铜棒的材质必须用纯铜
C.电解一段时间后加 Cu(OH)2 固体使溶液恢复原来的浓度
D.该实验过程中电解质溶液的 pH 会不断减小
A
随堂训练
2.目前市面上的很多银纪念币材料为铜芯镀银,依据你所掌握的电镀原理,你认为
这种银纪念币制作时,铜芯应作( )
A.阳极 B.阴极
C.正极 D.负极
B
随堂训练
3.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
A.通电后,Ag+ 向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
C
随堂训练
4.依据甲、乙、丙三图,判断下列叙述中不正确的是( )
甲 乙 丙
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙装置中,铜极因发生氧化反应而溶解
D.乙装置中,c(Cu2+) 不变,丙装置中, c(Cu2+) 减小
B
随堂训练
5.如图所示,甲为电镀银装置,下列对该装置的有关叙述中正确的是
( )
甲 乙 丙
A.P 是电源的正极
B.F 极上发生的反应为
C.电解时,甲、乙、丙三池中,除 E、F 两极外,其余电极均参加了反应
D.通电后,甲池溶液的 pH 减小,而乙、丙两池溶液的 pH 不变
B
谢谢观看SHUAN Q for watching!
