氧化还原反应高一化学人教版(2019)必修第一册(共20张PPT)
文档属性
| 名称 | 氧化还原反应高一化学人教版(2019)必修第一册(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 13.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-23 11:58:53 | ||
图片预览






文档简介
(共20张PPT)
银针试毒的原理:
4Ag+O +2H S===2Ag S+2H O
银白色 黑色
第三节氧化还原反应
在这个反应里,氧化铜失去氧而变成单质铜。这种含氧化合物里的氧被
夺去的反应,叫做还原反应。木炭是使氧化铜还原为铜的物质,它具有还原 性。碳的还原性可用于冶金工业。例如,焦炭可以把铁从它的氧化物矿石里 还原出来。
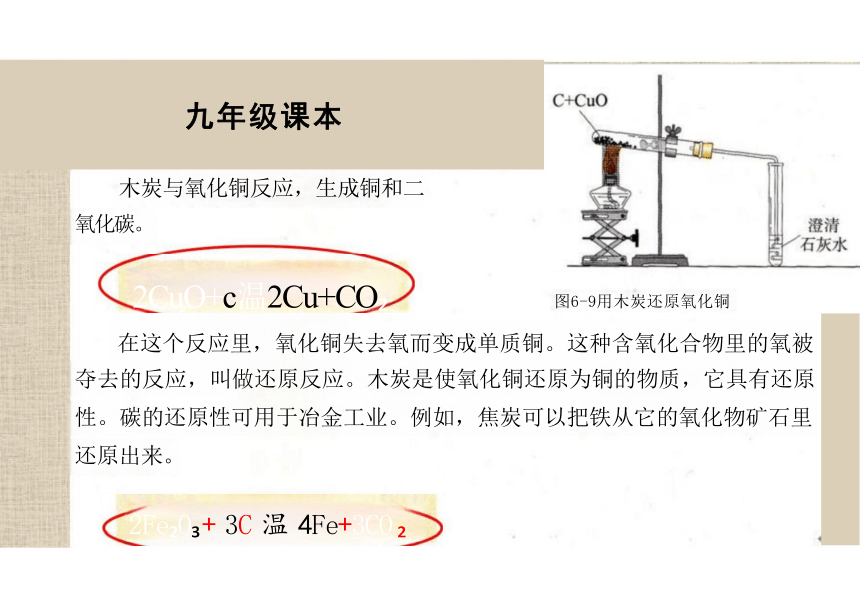
九年级课本
木炭与氧化铜反应,生成铜和二
氧化碳。
2CuO+c温2Cu+CO
2Fe O + 3C 温 4Fe+3CO
图6-9用木炭还原氧化铜
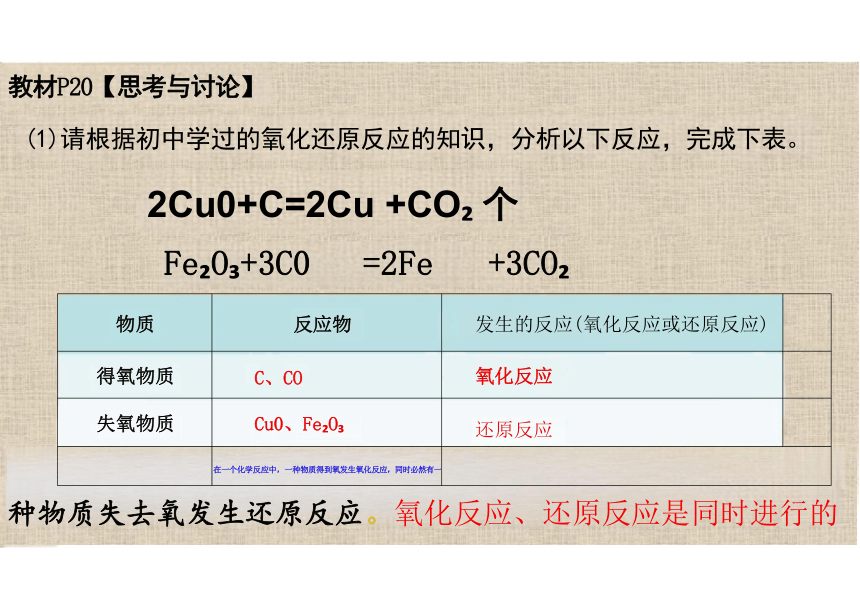
教材P20【思考与讨论】
(1)请根据初中学过的氧化还原反应的知识,分析以下反应,完成下表。
2Cu0+C=2Cu +CO 个
Fe O +3C0 =2Fe +3CO
种物质失去氧发生还原反应。氧化反应、还原反应是同时进行的
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质 C、CO 氧化反应
失氧物质 Cu0、Fe O 还原反应
在一个化学反应中,一种物质得到氧发生氧化反应,同时必然有一
反应类型
得失氧
氧化反应
得到氧元素的反应
还原反应
失去氧元素的反应
氧化还原 反应
有氧得失的反应
一 、氧化还原反应的概念及其本质
1、从得失氧的角度认识(表观)
元素化合价升高的物质发生氧化反应,化合价降低物质发生还原反应
0 +2
Fe +CuSO ==Cu+FeSO
有元素的化合价在反应前后发生变化 (判断依据)
2CuO +C二 二 2Cu+CO 个
Fe O +3CO
2Fe+3CO
高温
==
高温
反应类型
化合价变化
氧化反应
所含元素化合价升高的反应
还原反应
所含元素化合价降低的反应
氧化还原 反应
凡有元素化合价升降的反应 (特征)
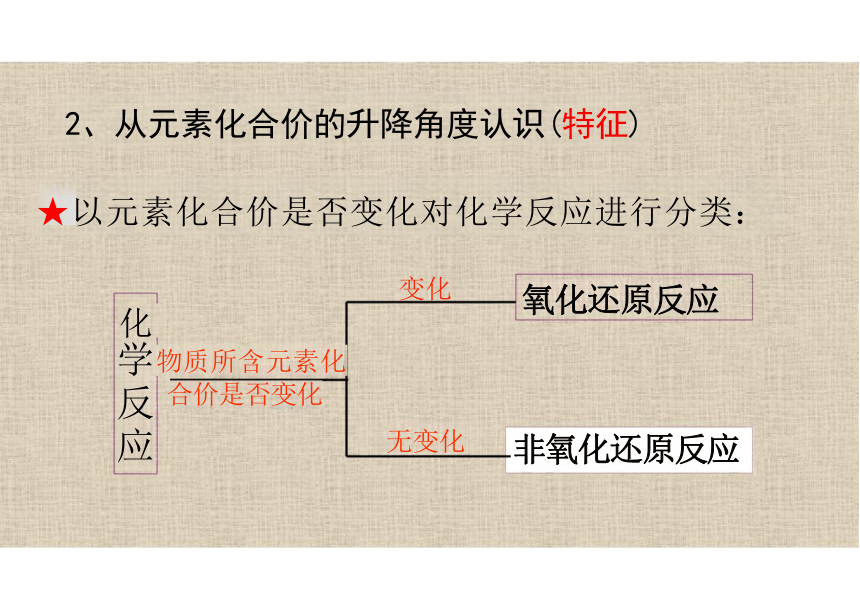
2、从元素化合价的升降角度认识(特征)
2、从元素化合价的升降角度认识(特征)
★以元素化合价是否变化对化学反应进行分类:
变化
化
物质所含元素化
合价是否变化
无变化
氧化还原反应
非氧化还原反应
学反应
4Ag+O +2H S==2Ag S+2H O
化合价升高,被氧化
在古代,由于生产技术落后,致使砒 霜(三氧化二砷)中伴有少量的硫和 硫化物,所以可以用银针验毒。
化合价降低,被还原
-2
+1
元素为什么会发生化合价变化 化合价的升降是什
么原因引起的
化合价的升降
实质
电子的转移
化合价的升降
实质
电子的得失
失2×e-, 化合价升高,被氧化
0 0 +1 -1
2Na +Cl =2NaCl
得2×e-, 化合价降低,被还原
Na+
Na Cl-
Na Cl
化合物NaCl的形成过程
Cl-
电子对偏离,化合价升高,被氧化
0 0 - 1
2H +Cl =2HCI
电子对偏向,化合价降低,被还原
化合价的升降
实 质
共用电子对的偏移
化合物HCl的形成过程
H +1 Cl
HCl
CI
H: C
反应类型
化合价变化
氧化反应
有电子失去( 或偏离)的反应
还原反应
有电子得到( 或偏向)的反应
氧化还原 反应
有电子转移(得失或偏移)的反应
3、从电子转移的角度认识(本质)
--- 失-- -氧化- - - 还原剂
--- 得--- 还原- - - 氧 化 剂
化合价降低
还原反应
( 特 征 )
某元素得到电子 (或电子对偏向)
(本质)
【小结】
某元素失去 电 子 (或电子对偏离)
氧化反应
升 降
化合价升高
化合价升高,失去电子,被氧化
0 +1 +2 0
Zn +HC1 ZnCl 十 H
还原剂 氧化剂 氧化产物 还原产物
化合价降低,得到电子,被还原
所含元素化合价升高的物质是 还 原 剂
所含元素化合价降低的物质是 氧 化 剂
在氧化还原反应中一种元素被氧化,则一定有另一种元素 被还原,这句话对吗
不对。可以是同一种元素既被氧化、又还原。如:
Cl2+2NaOH =NaCl +NaC10+H O
氧化剂
还原剂
氧化剂、还原剂可以为同一物质,同样,氧化产 物、还原产物也可以为同一物质。如:
2Mg +0 =2Mg0
氧化产物 还原产物
二、氧化还原反应中电子转移的表示方法
失去2×e-,化合价升高,被氧化(发生氧化反应)
281
得到2×e-,化合价降低,被还原(发生还原反应) NaCI
你的电子
借我用用
点燃
286
H +Cl ===2HCI
CI
双线桥表示法
288
Cl
288
NaCI Cl
你的电子
借我用用
286
CI
单线桥表示法
2 e-
281
借
点燃
H +Cl ===2H Cl
-
2Na +Cl = △=2NaCl
氧化还原反应
置换反应
复分解反应 有单质参加的反应一定是氧化还原反应
吗 不是,例如20 ==30
三 、氧化还原反应与四大基本反应类型关系
分解反应 有单质
化合反应 有单质
表示电子转移的方法 单线桥法
6e-
Fe O +3C02re+3CO
化合反应 分解反应
氧化反应和还原反应同时发生的反应
元素的化合价在反应前后发生变化
电子的转移(得失或偏移) 得2×3e
小结
四种基本反映类型与氧化还原反应的关系
定义
特征
本质
Fe O +3CO 2 Fe+3CO
失3×2e
氧化还原反应
置换反应
双线桥法
+3 0 十4
复分解反应
银针试毒的原理:
4Ag+O +2H S===2Ag S+2H O
银白色 黑色
第三节氧化还原反应
在这个反应里,氧化铜失去氧而变成单质铜。这种含氧化合物里的氧被
夺去的反应,叫做还原反应。木炭是使氧化铜还原为铜的物质,它具有还原 性。碳的还原性可用于冶金工业。例如,焦炭可以把铁从它的氧化物矿石里 还原出来。
九年级课本
木炭与氧化铜反应,生成铜和二
氧化碳。
2CuO+c温2Cu+CO
2Fe O + 3C 温 4Fe+3CO
图6-9用木炭还原氧化铜
教材P20【思考与讨论】
(1)请根据初中学过的氧化还原反应的知识,分析以下反应,完成下表。
2Cu0+C=2Cu +CO 个
Fe O +3C0 =2Fe +3CO
种物质失去氧发生还原反应。氧化反应、还原反应是同时进行的
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质 C、CO 氧化反应
失氧物质 Cu0、Fe O 还原反应
在一个化学反应中,一种物质得到氧发生氧化反应,同时必然有一
反应类型
得失氧
氧化反应
得到氧元素的反应
还原反应
失去氧元素的反应
氧化还原 反应
有氧得失的反应
一 、氧化还原反应的概念及其本质
1、从得失氧的角度认识(表观)
元素化合价升高的物质发生氧化反应,化合价降低物质发生还原反应
0 +2
Fe +CuSO ==Cu+FeSO
有元素的化合价在反应前后发生变化 (判断依据)
2CuO +C二 二 2Cu+CO 个
Fe O +3CO
2Fe+3CO
高温
==
高温
反应类型
化合价变化
氧化反应
所含元素化合价升高的反应
还原反应
所含元素化合价降低的反应
氧化还原 反应
凡有元素化合价升降的反应 (特征)
2、从元素化合价的升降角度认识(特征)
2、从元素化合价的升降角度认识(特征)
★以元素化合价是否变化对化学反应进行分类:
变化
化
物质所含元素化
合价是否变化
无变化
氧化还原反应
非氧化还原反应
学反应
4Ag+O +2H S==2Ag S+2H O
化合价升高,被氧化
在古代,由于生产技术落后,致使砒 霜(三氧化二砷)中伴有少量的硫和 硫化物,所以可以用银针验毒。
化合价降低,被还原
-2
+1
元素为什么会发生化合价变化 化合价的升降是什
么原因引起的
化合价的升降
实质
电子的转移
化合价的升降
实质
电子的得失
失2×e-, 化合价升高,被氧化
0 0 +1 -1
2Na +Cl =2NaCl
得2×e-, 化合价降低,被还原
Na+
Na Cl-
Na Cl
化合物NaCl的形成过程
Cl-
电子对偏离,化合价升高,被氧化
0 0 - 1
2H +Cl =2HCI
电子对偏向,化合价降低,被还原
化合价的升降
实 质
共用电子对的偏移
化合物HCl的形成过程
H +1 Cl
HCl
CI
H: C
反应类型
化合价变化
氧化反应
有电子失去( 或偏离)的反应
还原反应
有电子得到( 或偏向)的反应
氧化还原 反应
有电子转移(得失或偏移)的反应
3、从电子转移的角度认识(本质)
--- 失-- -氧化- - - 还原剂
--- 得--- 还原- - - 氧 化 剂
化合价降低
还原反应
( 特 征 )
某元素得到电子 (或电子对偏向)
(本质)
【小结】
某元素失去 电 子 (或电子对偏离)
氧化反应
升 降
化合价升高
化合价升高,失去电子,被氧化
0 +1 +2 0
Zn +HC1 ZnCl 十 H
还原剂 氧化剂 氧化产物 还原产物
化合价降低,得到电子,被还原
所含元素化合价升高的物质是 还 原 剂
所含元素化合价降低的物质是 氧 化 剂
在氧化还原反应中一种元素被氧化,则一定有另一种元素 被还原,这句话对吗
不对。可以是同一种元素既被氧化、又还原。如:
Cl2+2NaOH =NaCl +NaC10+H O
氧化剂
还原剂
氧化剂、还原剂可以为同一物质,同样,氧化产 物、还原产物也可以为同一物质。如:
2Mg +0 =2Mg0
氧化产物 还原产物
二、氧化还原反应中电子转移的表示方法
失去2×e-,化合价升高,被氧化(发生氧化反应)
281
得到2×e-,化合价降低,被还原(发生还原反应) NaCI
你的电子
借我用用
点燃
286
H +Cl ===2HCI
CI
双线桥表示法
288
Cl
288
NaCI Cl
你的电子
借我用用
286
CI
单线桥表示法
2 e-
281
借
点燃
H +Cl ===2H Cl
-
2Na +Cl = △=2NaCl
氧化还原反应
置换反应
复分解反应 有单质参加的反应一定是氧化还原反应
吗 不是,例如20 ==30
三 、氧化还原反应与四大基本反应类型关系
分解反应 有单质
化合反应 有单质
表示电子转移的方法 单线桥法
6e-
Fe O +3C02re+3CO
化合反应 分解反应
氧化反应和还原反应同时发生的反应
元素的化合价在反应前后发生变化
电子的转移(得失或偏移) 得2×3e
小结
四种基本反映类型与氧化还原反应的关系
定义
特征
本质
Fe O +3CO 2 Fe+3CO
失3×2e
氧化还原反应
置换反应
双线桥法
+3 0 十4
复分解反应
