化学人教版(2019)必修第一册3.2.2铝及其化合物(共20张PPT)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.2.2铝及其化合物(共20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 964.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-23 12:04:11 | ||
图片预览







文档简介
(共20张PPT)
铝及其化合物的性质
温故
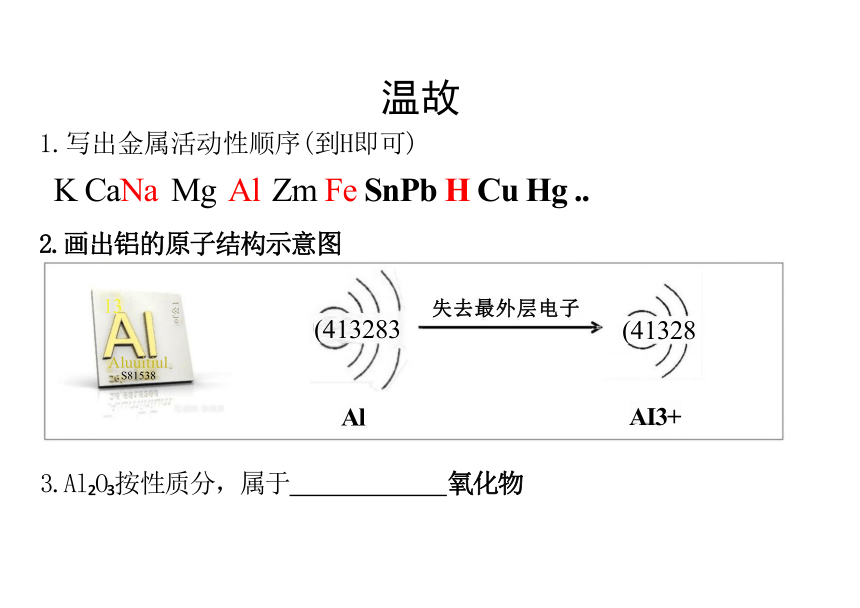
1.写出金属活动性顺序(到H即可)
K CaNa Mg Al Zm Fe SnPb H Cu Hg ..
2.画出铝的原子结构示意图
Aluuitiul
S81538
Al AI3+
3.Al O 按性质分,属于 氧化物
失去最外层电子
(41328
(413283
13
of公1
资料
1、熔点:Al:660℃ Al O :2050℃ 白色固体,硬度大,用于制
造耐火材料—耐火坩埚、耐高温的实验仪器。
合成人造宝石,刚 玉(主要成分Al 0 )
2.铝元素在溶液中存在形态A13+和[Al(OH) ]- (四羟基合铝酸根)
Al +存在于 性环境和[Al(OH) ] - 存在于 性环境
3.碱性:氨水大于A1(OH) 酸性:H CO 大于A1(OH)
铝是地壳中含量最多的金属元素,以化合态的形式存在于各种岩石或
矿石里,如铝土矿、长石、云母、高岭石、明矾石等等
铝 的 存 在
1.1
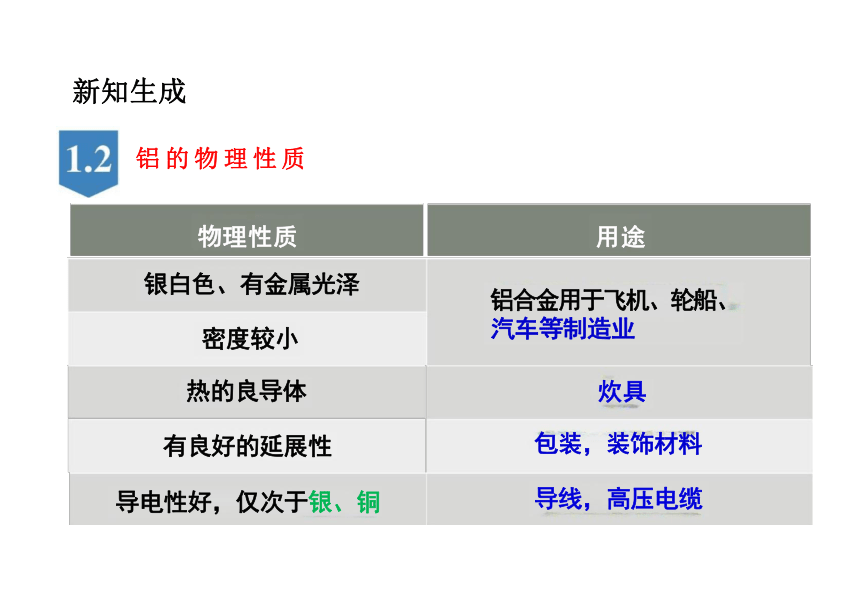
物理性质
银白色、有金属光泽
密度较小
热的良导体
有良好的延展性
导电性好,仅次于银、铜
用途
铝合金用于飞机、轮船、
汽车等制造业
炊具
包装,装饰材料
导线,高压电缆
新知生成
铝的物理性质
氧化铝薄膜(Al O )
铝的化学性质 铝具有较强的还原性!!!
常温下,在空气中铝与氧气反应,其表面生成一层 致密氧化铝薄膜,从而阻止铝进一步氧化。
氧化铝膜和氧化铁膜的微观形态
致密的氧化膜
新知生成
实验探究:
(1)铝与氧气反应
1.用坩埚钳夹住一小块铝,在酒精灯上加热至熔化, 轻轻晃动,仔细观察,你看到了什么现象 为什么会 有这种现象
现 象 :铝箔熔化,失去光泽,熔化的铝并不滴落; 好像有一层膜兜着。
结论:铝箔表面有致密的氧化物保护膜,氧化铝熔点高,不易熔化
在一支试管中加入5mL 盐酸,再向试管中放入一小块铝片。观察现
象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
在一支试管中加入5mL 盐酸,再向试管中放入一小块
铝片。观察现象。过一段时间后,将点燃的木条放在试管
口,你观察到什么现象
实验探究:
实验现象
铝片逐渐溶解,一段时间后产生气泡,试管壁有发热 现象;将点燃的木条放在试管口,观察到淡蓝色火焰,
爆鸣声。
实验原理
Al O +6H+=2AI ++3H O,
2Al+6H+=2AI ++3H 个
铝的化学性质
2.铝与盐酸反应
记住:常温下 ,Al 、Fe遇到浓硫酸、浓硝酸发生钝化
问题:铝 桶能否盛放氢氧化钠等碱性溶液
真实情境:
可以用铝罐和
铁罐存储浓硫
酸、浓硝酸
在两支试管中分别加入少量的NaOH
溶液,然后向其中一支试管中放入一 小块铝,向另一支试管中放入用砂纸 仔细打磨过(除去表面的氧化膜)的 —小块铝片。观察现象。过一段时间 后,将点燃的木条分别放在两支试管 口,你观察到什么现象
3.铝与NaOH 溶液反应
实验3-5
实验探究:
实验操作 NaOH溶液 2 mL 铝片 打磨 过的 铝片
NaOH溶液
2 mL
实验现象 开始没有气泡,一段时间后才产生气泡,铝片逐 渐溶解,将点燃的木条放在试管口有爆鸣声。 立即产生大量气泡,铝片逐渐溶解, 将点燃的木条放在试管口有爆鸣声。 实验原理 两支试管均放出H ,铝、氧化铝均能与NaOH溶液反应。 Al O +2NaOH+3H O=2Na[Al(OH) ] Al Q +2OH-+3H O=2[Al(OH) ]- 2Al+2NaOH+6H O=2Na[Al(OH) ]+3H 个 四羟基合铝酸钠 2Al+20H-+6H O=2[Al(OH) ]-+3H 个
1.3 铝的化学性质
3.铝与NaOH溶液反应
(4)铝与盐反应
铝桶能否用于盛放硫酸铜溶液
2Al+3CuSO = Al (SO ) +3Cu
2AI+3Hg(NO ) —2Al(NO ) +3Hg
三、氢氧化铝
(1)物性:白色胶状物,难溶于水,有强吸附性 (2》化性: ①两性氢氧化物
思考:1mol Al(OH) 最多反应 mol盐酸 最多反应 mol氢氧化钠
与碱反应
酸式电离
Al(OH) = Al ++30H-
Al(OH) +H O I(OH) ]-+H+
碱式电离
与酸反应
讨论:实验室制备Al(OH) 的方法
制取Al(OH ) 适宜用 NH ·H O 与Al +反应,
或者用 CO 与四羟基合铝酸盐反应
1)向铝盐的溶液中加入过量的氨水 Al ++3NH ·H O=Al(OH) ↓+3NH +
2)向四羟基合铝酸盐的溶液中通入过量CO [Al(OH) ]- +CO =Al(OH) ↓+ HCO
【注意】氢氧化铝既能与强酸反应又能与强碱反应, 不溶于比H CO,更弱的酸;不溶于比氨水更弱的碱。
十二水合硫酸铝钾 KAI(SO ) 12H O 俗 名:明矾
用途:净水剂和膨化剂
写出明矾电离方程式 KAI(SO ) · 12H O=K++Al ++2SO -+12H O
压力锅使用说明书:使用后,要及时清洗干净, 以免残留的食物尤其是酸碱性物质腐蚀锅体。
明矾净水:Al ++3 H O 今Al(OH) (胶体)+3H+
用离子方程式解释可以用作胃酸中和剂原因
学以致用
课堂评价(5min 检测)
1. 除去镁粉中的少量铝粉,可选用的试剂是( D )
A. 硫 酸 B. 氨 水
C. 盐酸 D.NaOH 溶液
2.下列用途或说法主要体现铝的物理性质的是
①家用铝锅 ②铝具有还原性 ③制导线 ④铝锅不能长期贮存 碱液 ⑤制包装铝箔⑥做防锈油漆⑦制成合金作制造飞机的 材料
A.①②③④ B.②⑤⑥⑦
C.①③⑤⑦ D.②④⑤⑥
3.下列物质中,既能与盐酸反应,又能与NaOH 溶液反应的是( A )
①NaHCO ②Al ③Al O ④Na CO ⑤(NH ) SO
A.①②③⑤ B.②③④ C.①③④⑤ D.①②④
4、某无色溶液中放入铝片后有氢气产生,则下列离子在该溶液中
一定不能大量存在的是(D )
B.Mg +
D.HCO -
溶液呈强酸性或强碱性
A.Na+
C.OH-
5. (1)等质量的Al 分别与足量盐酸、NaOH 溶液反应,放出
H 的量之比1:1
(2).等物质的量的盐酸和NaOH 溶液分别与足量Al反应,放出 H 的量之比1:3
2AI+6HCl =2AICl +3H 个 2Al+2NaOH+6H O=2Na[Al(OH) ]+3H 个
科学研究发现,老年性痴呆症与铝有密
切关系。同时还发现,铝对人体的脑、心、 肝、肾功能都有损害。因此,世界卫生组 织于1989年正式将铝确定为食品污染物而 加以控制。提出成年人每天允许铝摄入量 为36mg。如经常吃油条等油炸食品,喝 铝罐装饮料等,或是经常食用铝制炊具炒 出的饭菜,都会使人的摄铝量增加,从而 影响脑细胞功能,导致记忆力下降,思 维 能力迟钝。
铝与人体健康
铝及其化合物的性质
温故
1.写出金属活动性顺序(到H即可)
K CaNa Mg Al Zm Fe SnPb H Cu Hg ..
2.画出铝的原子结构示意图
Aluuitiul
S81538
Al AI3+
3.Al O 按性质分,属于 氧化物
失去最外层电子
(41328
(413283
13
of公1
资料
1、熔点:Al:660℃ Al O :2050℃ 白色固体,硬度大,用于制
造耐火材料—耐火坩埚、耐高温的实验仪器。
合成人造宝石,刚 玉(主要成分Al 0 )
2.铝元素在溶液中存在形态A13+和[Al(OH) ]- (四羟基合铝酸根)
Al +存在于 性环境和[Al(OH) ] - 存在于 性环境
3.碱性:氨水大于A1(OH) 酸性:H CO 大于A1(OH)
铝是地壳中含量最多的金属元素,以化合态的形式存在于各种岩石或
矿石里,如铝土矿、长石、云母、高岭石、明矾石等等
铝 的 存 在
1.1
物理性质
银白色、有金属光泽
密度较小
热的良导体
有良好的延展性
导电性好,仅次于银、铜
用途
铝合金用于飞机、轮船、
汽车等制造业
炊具
包装,装饰材料
导线,高压电缆
新知生成
铝的物理性质
氧化铝薄膜(Al O )
铝的化学性质 铝具有较强的还原性!!!
常温下,在空气中铝与氧气反应,其表面生成一层 致密氧化铝薄膜,从而阻止铝进一步氧化。
氧化铝膜和氧化铁膜的微观形态
致密的氧化膜
新知生成
实验探究:
(1)铝与氧气反应
1.用坩埚钳夹住一小块铝,在酒精灯上加热至熔化, 轻轻晃动,仔细观察,你看到了什么现象 为什么会 有这种现象
现 象 :铝箔熔化,失去光泽,熔化的铝并不滴落; 好像有一层膜兜着。
结论:铝箔表面有致密的氧化物保护膜,氧化铝熔点高,不易熔化
在一支试管中加入5mL 盐酸,再向试管中放入一小块铝片。观察现
象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
在一支试管中加入5mL 盐酸,再向试管中放入一小块
铝片。观察现象。过一段时间后,将点燃的木条放在试管
口,你观察到什么现象
实验探究:
实验现象
铝片逐渐溶解,一段时间后产生气泡,试管壁有发热 现象;将点燃的木条放在试管口,观察到淡蓝色火焰,
爆鸣声。
实验原理
Al O +6H+=2AI ++3H O,
2Al+6H+=2AI ++3H 个
铝的化学性质
2.铝与盐酸反应
记住:常温下 ,Al 、Fe遇到浓硫酸、浓硝酸发生钝化
问题:铝 桶能否盛放氢氧化钠等碱性溶液
真实情境:
可以用铝罐和
铁罐存储浓硫
酸、浓硝酸
在两支试管中分别加入少量的NaOH
溶液,然后向其中一支试管中放入一 小块铝,向另一支试管中放入用砂纸 仔细打磨过(除去表面的氧化膜)的 —小块铝片。观察现象。过一段时间 后,将点燃的木条分别放在两支试管 口,你观察到什么现象
3.铝与NaOH 溶液反应
实验3-5
实验探究:
实验操作 NaOH溶液 2 mL 铝片 打磨 过的 铝片
NaOH溶液
2 mL
实验现象 开始没有气泡,一段时间后才产生气泡,铝片逐 渐溶解,将点燃的木条放在试管口有爆鸣声。 立即产生大量气泡,铝片逐渐溶解, 将点燃的木条放在试管口有爆鸣声。 实验原理 两支试管均放出H ,铝、氧化铝均能与NaOH溶液反应。 Al O +2NaOH+3H O=2Na[Al(OH) ] Al Q +2OH-+3H O=2[Al(OH) ]- 2Al+2NaOH+6H O=2Na[Al(OH) ]+3H 个 四羟基合铝酸钠 2Al+20H-+6H O=2[Al(OH) ]-+3H 个
1.3 铝的化学性质
3.铝与NaOH溶液反应
(4)铝与盐反应
铝桶能否用于盛放硫酸铜溶液
2Al+3CuSO = Al (SO ) +3Cu
2AI+3Hg(NO ) —2Al(NO ) +3Hg
三、氢氧化铝
(1)物性:白色胶状物,难溶于水,有强吸附性 (2》化性: ①两性氢氧化物
思考:1mol Al(OH) 最多反应 mol盐酸 最多反应 mol氢氧化钠
与碱反应
酸式电离
Al(OH) = Al ++30H-
Al(OH) +H O I(OH) ]-+H+
碱式电离
与酸反应
讨论:实验室制备Al(OH) 的方法
制取Al(OH ) 适宜用 NH ·H O 与Al +反应,
或者用 CO 与四羟基合铝酸盐反应
1)向铝盐的溶液中加入过量的氨水 Al ++3NH ·H O=Al(OH) ↓+3NH +
2)向四羟基合铝酸盐的溶液中通入过量CO [Al(OH) ]- +CO =Al(OH) ↓+ HCO
【注意】氢氧化铝既能与强酸反应又能与强碱反应, 不溶于比H CO,更弱的酸;不溶于比氨水更弱的碱。
十二水合硫酸铝钾 KAI(SO ) 12H O 俗 名:明矾
用途:净水剂和膨化剂
写出明矾电离方程式 KAI(SO ) · 12H O=K++Al ++2SO -+12H O
压力锅使用说明书:使用后,要及时清洗干净, 以免残留的食物尤其是酸碱性物质腐蚀锅体。
明矾净水:Al ++3 H O 今Al(OH) (胶体)+3H+
用离子方程式解释可以用作胃酸中和剂原因
学以致用
课堂评价(5min 检测)
1. 除去镁粉中的少量铝粉,可选用的试剂是( D )
A. 硫 酸 B. 氨 水
C. 盐酸 D.NaOH 溶液
2.下列用途或说法主要体现铝的物理性质的是
①家用铝锅 ②铝具有还原性 ③制导线 ④铝锅不能长期贮存 碱液 ⑤制包装铝箔⑥做防锈油漆⑦制成合金作制造飞机的 材料
A.①②③④ B.②⑤⑥⑦
C.①③⑤⑦ D.②④⑤⑥
3.下列物质中,既能与盐酸反应,又能与NaOH 溶液反应的是( A )
①NaHCO ②Al ③Al O ④Na CO ⑤(NH ) SO
A.①②③⑤ B.②③④ C.①③④⑤ D.①②④
4、某无色溶液中放入铝片后有氢气产生,则下列离子在该溶液中
一定不能大量存在的是(D )
B.Mg +
D.HCO -
溶液呈强酸性或强碱性
A.Na+
C.OH-
5. (1)等质量的Al 分别与足量盐酸、NaOH 溶液反应,放出
H 的量之比1:1
(2).等物质的量的盐酸和NaOH 溶液分别与足量Al反应,放出 H 的量之比1:3
2AI+6HCl =2AICl +3H 个 2Al+2NaOH+6H O=2Na[Al(OH) ]+3H 个
科学研究发现,老年性痴呆症与铝有密
切关系。同时还发现,铝对人体的脑、心、 肝、肾功能都有损害。因此,世界卫生组 织于1989年正式将铝确定为食品污染物而 加以控制。提出成年人每天允许铝摄入量 为36mg。如经常吃油条等油炸食品,喝 铝罐装饮料等,或是经常食用铝制炊具炒 出的饭菜,都会使人的摄铝量增加,从而 影响脑细胞功能,导致记忆力下降,思 维 能力迟钝。
铝与人体健康
