1-3-1氧化还原反应(教学课件)-高中化学人教版(2019)必修第一册(共31张PPT)
文档属性
| 名称 | 1-3-1氧化还原反应(教学课件)-高中化学人教版(2019)必修第一册(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-24 19:34:01 | ||
图片预览











文档简介
(共31张PPT)
氧 化 还 原 反 应
第一课时
按反应物和生成 物的种类及类别
化学反应
化合反应
分解反应
置换反应
复分解反应
化学反应的分类
离子反应
非离子反应
有无离子参加
给下列化学反应分类
S+O sO
CaCO 温CaO+CO 个
Mg+2HCl=MgCl +H 个
MgO+2HCl=MgCl +H O CuO+CO温 Cu+CO
探究一、从得氧失氧角度探究氧化还原反应:
发生在身边的事 —
Fe 得到氧Fe O
反应类型:氧化反应
铁锁锈了
发生在身边的事—
铁矿石 铸铁
现代炼铁
反应类型:还原反应
失去氧
Fe
Cu Cu
Cu
Cu C
C
得到氧,被氧化(氧化反应)
2CuO + 二 2 Cu+CO,
失去氧,被还原(还原反应)
同时进行
一、氧化还原反应
1、从得失氧的角度(狭义)
物质得到氧的反应化反应。
物质失去氧的反原反应。
有氧得失的反应化还原反应。
思考与交流
是否只有得氧、失氧的反应才是氧化还原反应呢
·
Fe+CuSO =FeSO +Cu
探究二、从化合价升降角度探究氧化还原反应:
请分析下列两个氧化还原反应中各种元素的化 合价在反应前后有无变化,讨论氧化还原反应与元 素化合价的升降有什么关系
得到氧,化合价升高,被氧化(氧化反应)
+2 0 0 +1
CuO +H ====Cu +H O
失去氧,化合价降低 ,被还原(还原反应)
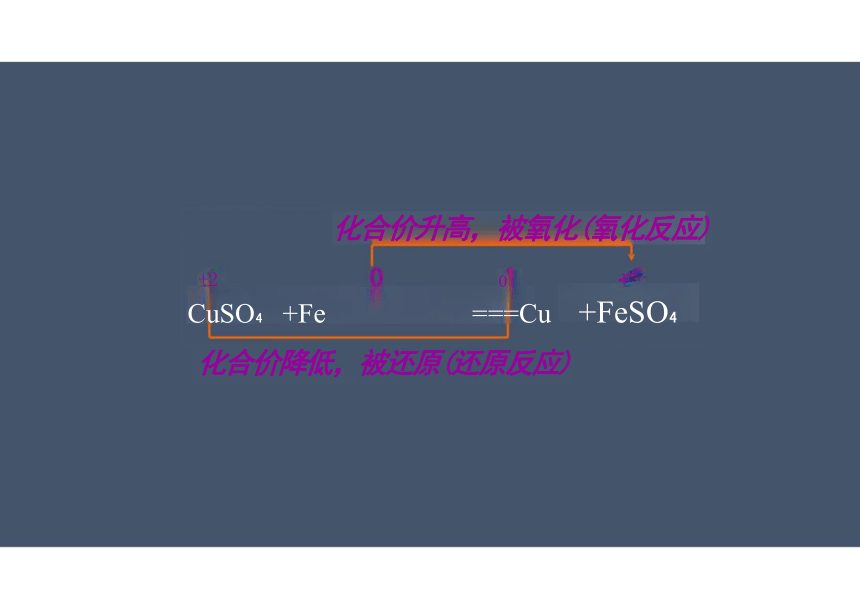
化合价升高,被氧化(氧化反应)
+2 0 2
CuSO +Fe ===Cu +FeSO
化合价降低,被还原(还原反应)
2、从化合价升降的角度(广义)
化合价升高的反应
化合价降低的反应
有化合价升降的反应
☆氧化还原反应的特征:元素化合价有升降。
应用:可以用来判断任一化学反应是否为氧化还原反应。
一是氧化反应。
一是还原反应。
-是氧化还原反应。
课堂练习
1、下列反应属于氧化还原反应的是( D )
A、CaCO +2HCl=CaCl +H O+CO 个 B 、CaCo CaO+CO 个
C 、Na O+H O=2NaOH
D 、Mg+2HCl=MgCl,+H,个
2、下列反应不属于氧化还原反应的是( B )
A.2H O =2H O+O 个
B.CuCl +2NaOH =Cu(OH) J+2NaCl
C.2Na+2H O =2NaOH+H 个
D.3CO+Fe O =2Fe+3CO
2Na+Cl =2NaCl
H +Cl =2HCI
1、在氧化还原反应中为什么会发生化合价的升降 如何在
上述两反应中表达出来
2、课本介绍的两个反应过程有何相同的特点与不同的特点
(请阅读课本P21-22页并分组讨论)
探究三、从电子转移的角度探究氧化还原反应:
1、从电子得失角度:NaCl 的形成
{((o
( O Cl
Na+
Na
失电子,化合价升高,被氧化(氧化反应)
+1
十 2Na
得电子,化合价降低,被还原(还原反应)
化合价升降原困之一:电子的得失
2、从电子偏移角度:HCl 的形成
+1 1
H-: Cl
电子对偏离,化合价升高,被氧化(氧化反应)
0 0
H 十 Cl 二 = = 2H&
电子对偏向,化合价降低,被还原(还原反应)
化合价升降原因之二;共用电子对的偏移
3、从电子转移的角度(本质)
失电子(或电子偏离)的反应 一是氧化反应
得电子(或电子偏向)的反应 —是还原反应
有电子转移(得失或偏移-)-反应——是氧化还原反应
☆氧化还原反应的本质 :电子转移(得失或偏移)
课堂练习
1.下列说法正确的是( B )
A. 氧化还原反应的实质是有元素化合价的升降
B. 元素化合价升高时失电子,元素化合价降低时得电子
C. 元素化合价降低被氧化,元素化合价升高被还原
D. 元素化合价升高的反应是氧化反应,失去电子的反应是 还原反应
反应实例 反应类型 是否属于氧 化还原反应
与氧化还原 反应的关系
2H +O 2H O 化合反应 是
部分
CaO+H O=Ca(OH) 化合反应 非
2H O2H 个+0 1 分解反应 是
部分
CaCO =CaO+CO 个 分解反应 非
Fe+CuSO =Cu+FeSO 置换反应 是
全是
Ba(NO ) +Na SO = BaSO J+2NaNO 复分解反应 非
全非
探究四、探究氧化还原反应与四种基本反应类型的关系
二 、氧化还原反应与四种基本反应类型的关系
脱含 分解
氧化还原
复分解
判断:
1、有单质参加或者有单质生成的反应一定是氧化还原反应(×)
2、反应中,某元素由化合态变成游离态,该元素在反应中一定被
还原。(×)
3、下列说法正确的是:(BC )
A、化合反应一定是氧化还原反应
B、有单质参加的化合反应或者有单质生成的分解反应是氧化还原反应 C、置换反应一定是氧化还原反应
D、分解反应是氧化还原反应
课堂练习
1.下列反应中,不属于四种基本反应,但属于氧化 还原反应的是( B )
A.2Na+2H O=2NaOH+H 个
B.Cl +H O=HCl+HCIO
C.2H O =2H O+O 个
D.CaCO +2HCl=CaCl +H O+CO 个
本质 特征
规律:升→失→氧;降→得→还
失电子
(或电子对偏离)
得电子
(或电子对偏向)
氧化反应
还原反应
化合价 升高
化合价 降低
课堂小结
感受氧化还原反应的价值
S+2KNO +3C=K S+N 个+3CO 个
感受氧化还原反应的价值
钢铁腐蚀
电池
金属冶炼
武钢集E
精品名牌
电镀
wiscO GRO
书写要点:标价态,连双线,注得失。失3×2e化合价升高被氧化
1.箭头必须由反应物指向生成物中发生化合价变化的司一元素
化合价升高、降低各有一根箭头 每个原子得(失)电子的数目
2.电子转移数目:在双线桥上写出“得失mxne”
化合价发生改变的原子个数
表示电子转移的方法
双线桥法
有2个Fe被还原 得 电 子化合价降低被还原
+3 +2
Fe O +3C0温2
0 +4
Fe+3CO
电子守恒
课堂练习
用双线桥描述下列氧化还原反应:
(1)2CuO+C Cu +CO 个
(2)2KMnO =K MnO +MnO +O 个
(3)Cl +2NaOH=NaCl+NaCIO+H O
(4)MnO +4HCI(浓)=MnCl +Cl 个+2H O
表示电子转移的方法
单线桥法
6e
R O +3CO超 2Re+300
书写要点:标价态,连单线,注数目。
1.箭头由反应物中化合价升高的元素,指向反应物中化合价降低的元素 2.在线桥上表明电子转移总数,不用写出得失
课堂练习
用单线桥描述下列氧化还原反应:
(1)SO +2H S=2H O+3SJ
(2)2 KCIO ≌2KCl+3 O 个
(3)Cl +2NaOH=NaCl+NaClO+H O
(4)MnO +4HCI(浓)=MnCl +Cl 个+2H 0
全部氧化还原反应 CuSO +Fe=Cu+FeSO
部分氧化还原反应 MnO +4HCI(浓)台
MnCl +Cl 个+2H O
歧化反应 Cl +2NaOH=NaCl+NaClO
+H O
归中反应 SO +2H S=2H O+3SJ
氧化还原反应
氧 化 还 原 反 应
第一课时
按反应物和生成 物的种类及类别
化学反应
化合反应
分解反应
置换反应
复分解反应
化学反应的分类
离子反应
非离子反应
有无离子参加
给下列化学反应分类
S+O sO
CaCO 温CaO+CO 个
Mg+2HCl=MgCl +H 个
MgO+2HCl=MgCl +H O CuO+CO温 Cu+CO
探究一、从得氧失氧角度探究氧化还原反应:
发生在身边的事 —
Fe 得到氧Fe O
反应类型:氧化反应
铁锁锈了
发生在身边的事—
铁矿石 铸铁
现代炼铁
反应类型:还原反应
失去氧
Fe
Cu Cu
Cu
Cu C
C
得到氧,被氧化(氧化反应)
2CuO + 二 2 Cu+CO,
失去氧,被还原(还原反应)
同时进行
一、氧化还原反应
1、从得失氧的角度(狭义)
物质得到氧的反应化反应。
物质失去氧的反原反应。
有氧得失的反应化还原反应。
思考与交流
是否只有得氧、失氧的反应才是氧化还原反应呢
·
Fe+CuSO =FeSO +Cu
探究二、从化合价升降角度探究氧化还原反应:
请分析下列两个氧化还原反应中各种元素的化 合价在反应前后有无变化,讨论氧化还原反应与元 素化合价的升降有什么关系
得到氧,化合价升高,被氧化(氧化反应)
+2 0 0 +1
CuO +H ====Cu +H O
失去氧,化合价降低 ,被还原(还原反应)
化合价升高,被氧化(氧化反应)
+2 0 2
CuSO +Fe ===Cu +FeSO
化合价降低,被还原(还原反应)
2、从化合价升降的角度(广义)
化合价升高的反应
化合价降低的反应
有化合价升降的反应
☆氧化还原反应的特征:元素化合价有升降。
应用:可以用来判断任一化学反应是否为氧化还原反应。
一是氧化反应。
一是还原反应。
-是氧化还原反应。
课堂练习
1、下列反应属于氧化还原反应的是( D )
A、CaCO +2HCl=CaCl +H O+CO 个 B 、CaCo CaO+CO 个
C 、Na O+H O=2NaOH
D 、Mg+2HCl=MgCl,+H,个
2、下列反应不属于氧化还原反应的是( B )
A.2H O =2H O+O 个
B.CuCl +2NaOH =Cu(OH) J+2NaCl
C.2Na+2H O =2NaOH+H 个
D.3CO+Fe O =2Fe+3CO
2Na+Cl =2NaCl
H +Cl =2HCI
1、在氧化还原反应中为什么会发生化合价的升降 如何在
上述两反应中表达出来
2、课本介绍的两个反应过程有何相同的特点与不同的特点
(请阅读课本P21-22页并分组讨论)
探究三、从电子转移的角度探究氧化还原反应:
1、从电子得失角度:NaCl 的形成
{((o
( O Cl
Na+
Na
失电子,化合价升高,被氧化(氧化反应)
+1
十 2Na
得电子,化合价降低,被还原(还原反应)
化合价升降原困之一:电子的得失
2、从电子偏移角度:HCl 的形成
+1 1
H-: Cl
电子对偏离,化合价升高,被氧化(氧化反应)
0 0
H 十 Cl 二 = = 2H&
电子对偏向,化合价降低,被还原(还原反应)
化合价升降原因之二;共用电子对的偏移
3、从电子转移的角度(本质)
失电子(或电子偏离)的反应 一是氧化反应
得电子(或电子偏向)的反应 —是还原反应
有电子转移(得失或偏移-)-反应——是氧化还原反应
☆氧化还原反应的本质 :电子转移(得失或偏移)
课堂练习
1.下列说法正确的是( B )
A. 氧化还原反应的实质是有元素化合价的升降
B. 元素化合价升高时失电子,元素化合价降低时得电子
C. 元素化合价降低被氧化,元素化合价升高被还原
D. 元素化合价升高的反应是氧化反应,失去电子的反应是 还原反应
反应实例 反应类型 是否属于氧 化还原反应
与氧化还原 反应的关系
2H +O 2H O 化合反应 是
部分
CaO+H O=Ca(OH) 化合反应 非
2H O2H 个+0 1 分解反应 是
部分
CaCO =CaO+CO 个 分解反应 非
Fe+CuSO =Cu+FeSO 置换反应 是
全是
Ba(NO ) +Na SO = BaSO J+2NaNO 复分解反应 非
全非
探究四、探究氧化还原反应与四种基本反应类型的关系
二 、氧化还原反应与四种基本反应类型的关系
脱含 分解
氧化还原
复分解
判断:
1、有单质参加或者有单质生成的反应一定是氧化还原反应(×)
2、反应中,某元素由化合态变成游离态,该元素在反应中一定被
还原。(×)
3、下列说法正确的是:(BC )
A、化合反应一定是氧化还原反应
B、有单质参加的化合反应或者有单质生成的分解反应是氧化还原反应 C、置换反应一定是氧化还原反应
D、分解反应是氧化还原反应
课堂练习
1.下列反应中,不属于四种基本反应,但属于氧化 还原反应的是( B )
A.2Na+2H O=2NaOH+H 个
B.Cl +H O=HCl+HCIO
C.2H O =2H O+O 个
D.CaCO +2HCl=CaCl +H O+CO 个
本质 特征
规律:升→失→氧;降→得→还
失电子
(或电子对偏离)
得电子
(或电子对偏向)
氧化反应
还原反应
化合价 升高
化合价 降低
课堂小结
感受氧化还原反应的价值
S+2KNO +3C=K S+N 个+3CO 个
感受氧化还原反应的价值
钢铁腐蚀
电池
金属冶炼
武钢集E
精品名牌
电镀
wiscO GRO
书写要点:标价态,连双线,注得失。失3×2e化合价升高被氧化
1.箭头必须由反应物指向生成物中发生化合价变化的司一元素
化合价升高、降低各有一根箭头 每个原子得(失)电子的数目
2.电子转移数目:在双线桥上写出“得失mxne”
化合价发生改变的原子个数
表示电子转移的方法
双线桥法
有2个Fe被还原 得 电 子化合价降低被还原
+3 +2
Fe O +3C0温2
0 +4
Fe+3CO
电子守恒
课堂练习
用双线桥描述下列氧化还原反应:
(1)2CuO+C Cu +CO 个
(2)2KMnO =K MnO +MnO +O 个
(3)Cl +2NaOH=NaCl+NaCIO+H O
(4)MnO +4HCI(浓)=MnCl +Cl 个+2H O
表示电子转移的方法
单线桥法
6e
R O +3CO超 2Re+300
书写要点:标价态,连单线,注数目。
1.箭头由反应物中化合价升高的元素,指向反应物中化合价降低的元素 2.在线桥上表明电子转移总数,不用写出得失
课堂练习
用单线桥描述下列氧化还原反应:
(1)SO +2H S=2H O+3SJ
(2)2 KCIO ≌2KCl+3 O 个
(3)Cl +2NaOH=NaCl+NaClO+H O
(4)MnO +4HCI(浓)=MnCl +Cl 个+2H 0
全部氧化还原反应 CuSO +Fe=Cu+FeSO
部分氧化还原反应 MnO +4HCI(浓)台
MnCl +Cl 个+2H O
歧化反应 Cl +2NaOH=NaCl+NaClO
+H O
归中反应 SO +2H S=2H O+3SJ
氧化还原反应
