化学人教版(2019)必修第一册4.1.3原子结构与元素的性质(共27张PPT)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.3原子结构与元素的性质(共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 405.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-24 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
第四章 物质结构元素周期律 第一节原子结构与元素周期表 第3课时原子结构与元素的性质
元素种类 最外层电 子数(填< 或 > ) 容易得到还是 失去
具有的性质
金属元素 ≤4个 容易失去
金属性
非金属元素 ≥4个 容易得到
非金属性
根据初中所学原子结构的知识,填写下表
人们经常把元素周期表中的同族元素放在一起研究,
是因为他们之间存在着某种内在联系。那么,这种内 在的联系是什么呢 我们将从他们的结构和性质的关 系进行探讨。
Li Na K
Rb
Be Mg Ca Sr Ba
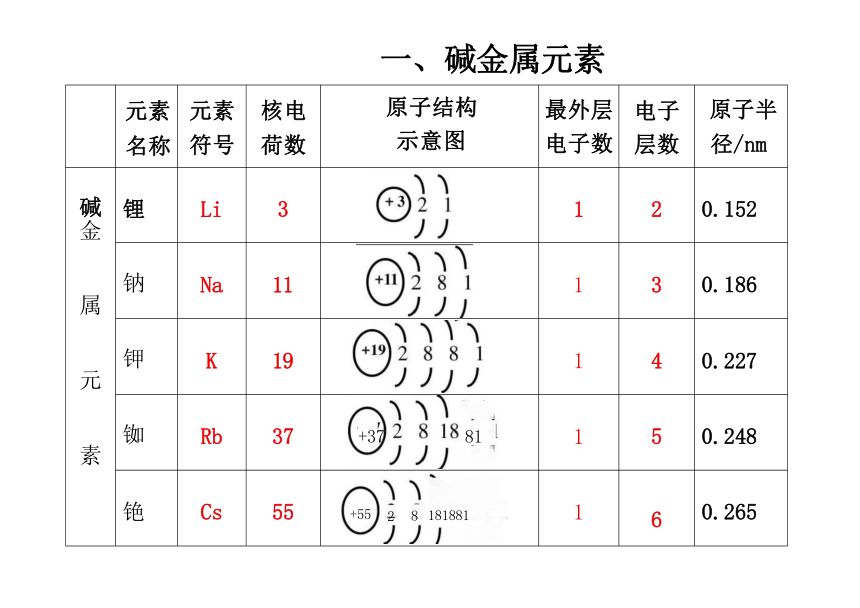
元素 名称 元素 符号 核电 荷数 原子结构 示意图 最外层 电子数 电子 层数
原子半 径/nm
碱金 属 元 素 锂 Li 3 +3 1 2
0.152
钠 Na 11 +11 1 3
0.186
钾 K 19 +19 1 4
0.227
铷 Rb 37 +37 81 1 5
0.248
铯 Cs 55 +55 2 8 181881 1 6
0.265
一、碱金属元素
1.从上往下碱金属元素原子的核电荷数、 原子半径如何变化
核电荷数逐渐增大,原子半径逐渐增大
2.从上往下原子核外电子排布有什么特 点 从哪一点能推断出碱金属的化学性 质具有相似性
最外层都只有一个电子,电子层数逐 渐增多;最外层都只有一个电子。
思考与交流
【证据推理】认识碱金属的化学性质
1、回忆第二章学过的知识,钠有哪些化学性质
与O 、水、酸、盐溶液反应
2、结合锂、钠和钾的原子结构特点,请你预测 锂、钾可能具有哪些与钠相似的化学性质。
与钠相似。与O 、水、酸、盐溶液反应
钠、钾化学性质比较
【实验和观察】
回忆钠与氧气、水反应的实验现象,并观察下列实验(由教师演示)。
(1)将干燥的坩埚加热,同时切取一块绿豆大的钾,用镊子夹取并迅速投到热坩 埚中(如图4-8)。继续加热片刻,待钾熔化后立即撤掉酒精灯,观察现象。
(2)在烧杯中加入一些水,滴入几滴酚酞溶液。切取一块绿豆大的钾,用镊子夹 取并投入水中(如图4-9),观察现象。
图4-8 钾在空气中燃烧
钠
钾
与 氧 气 反 应 剧烈燃烧,火焰呈黄 色,生成 淡黄色 的 固体
燃烧更剧烈,火焰呈紫色
注;钾与氧气反应生成多种氧 化物,该反应只是其中一个
K+O =KO (超氧化钾)
2Na+0 2
结论:金属的活泼性:K> Na。
(1)钠、钾与氧气的反应
钠
钾
实验 现象 钠浮在水面上;熔成光 亮的小球;小球四处游 动;发出嘶嘶的响声; 反应后滴入酚酞;溶液 变红。
钾浮于水面;迅速熔化 成银色小球;四处游动; 反应剧烈;有轻微爆炸 声并着火燃烧;反应
后滴入酚酞;溶液变红。
原理 2Na+2H O=2NaOH+H 个
2K+2H O=2KOH+H 个
结论 金属活动性:K > Na
(2)钠、钾与水的反应
碱金属化学性质的相似性和递变性与原子结构的 关系
相似性:最外层电子数都是1
结构相似
强还原性:容易失去1个电子
(与钠相似,与O 、水、酸、 盐溶液反应)
决
定
性质相似
元素 条件 现象 产物
结论
Li 加热 燃烧,较不 剧烈 Li O
从Li—Cs,
随电子层 数的递增,
还原性
(金属性) 逐渐增强。
Na 加热 燃烧,剧烈
K 稍加热 燃烧, 更剧烈 更复杂的 氧化物
Rb 接触空气 不加热 剧烈 更复杂的 氧化物
Cs 接触空气 不加热 剧烈 更复杂的 氧化物
与非金属的反应(以O 为例)
元素 现象 产物
结论
Li 会反应,比Na缓慢 对应的碱和氢气
从Li—Cs,
随电子层 数的递增,
还原性
(金属性)
逐渐增强。
Na 剧烈反应,有“浮、 熔、游、红、鸣”现象
K 更剧烈,气体会燃烧, 轻微爆炸
Rb 遇水燃烧,甚至爆炸
Cs
与水的反应
②递变性:从Li→Cs核电荷数增加
> 电子层数逐渐增多
> 原子半径逐渐增大
> 核对最外层电子的引力逐渐减弱
> 原子失电子的能力逐渐增强
> 元素的金属性逐渐增强
单质的还原性逐渐增强
与O 、 水等反应更快更剧烈
碱金属 单质 颜色和状态 密度 g ·cm-3 熔点 ℃
沸点
℃
Li 银白色,柔软 0.534 180.5
1347
Na 银白色,柔软 0.97 97.81
882.9
K 银白色,柔软 0.86 63.65
774
Rb 银白色,柔软 1.532 38.89
688
Cs 略带金属光泽,柔软 1.879 28.40
678.4
碱金属的物理性质
Li Na K Rb Cs
相 似
均为银白色(Cs略带金色)
柔软
较小
熔沸点
较低
导电导热性
强
密度变化
逐渐增大(K特殊)
熔沸点变化
单质的熔沸点逐渐降低
碱金属的物理性质的比较
(1)锂电池是一种高能电池;锂是优质的高 能燃料(已经用于宇宙飞船、人造卫星和超声 速飞机);有机化学中重要的催化剂。
(2)液态钠可作为核反应堆的传热介质。
(3)钾的化合物最大用途是做钾肥。硝酸钾 还用于做火药。
(4)铷铯主要用于制备光电管、真空管。铯原 子钟是目前最准确的计时仪器。
碱金属元素的用途:
二、卤族元素
卤族元素(简称卤素F、Cl、Br、I)是典型的 非金属元素,它们在自然界中都以化合态 存在。
F
I
卤素单质 颜色(常态) 密度 熔点/℃
沸点/℃
F (易液化) 淡黄绿色气 体 1.69g.L- (15℃) —219.6
—188.1
Cl 黄绿色气体 3.214g.L-1(0℃) -101
—34.6
Br 深红棕色液 体 3.119g ·cm-3(20℃) —7.2
58.78
I (易升化) 紫黑色固体 4.93g ·cm-3 113.5
184.4
1.卤族元素单质的物理性质
单质 颜色 状态 密度
熔沸点
H 2 由浅到深 气 液!固 由小到大
由低到高
Cl
Br
I
相似性:均有颜色,密度小,熔沸点低。
递变性:
F CI Br I
思考与讨论:根据卤素的原子结构,请你试着推测氟、 氯、溴、碘在化学性质上表现出的相似性和递变性。
原子结构特点如下:
(1)相似性:最外层电子数都是 7 。容易得到1个电 子,具有氧化性
(2)递变性:F→I, 核电荷数依次 增 大,电子层数依 次增 多,原子半径逐渐增 大。
2. 卤族元素的原子结构
H +F =2HF
暗处剧烈反应并爆炸;HF很稳定
H +Cl =2HCl
光照或点燃反应;HCl较稳定
H +Br =2HBr
加热500℃ ,HBr不稳定
H +I 2HI
需不断加热,HI同时分解
3. 卤素单质的化学性质
(1)与H 反应
阅读教材P97, 归纳卤素与氢气反应的相似性及反 应条件、产物稳定性等的递变规律
【结论】
1、与氢气反应的难易程度:由易到难
2、生成氢化物的稳定性: 由强到弱
3、卤素的非金属性强弱: 由强到弱
根据卤素单质与H 的反应事实,讨论随着原子 核电荷数的增多,卤素单质与H 反应的规律变 化
F Cl Br I
(2)卤素单质间的置换反应。
类似于金属与盐溶液的置换反应,卤素单质间也可发生置
换反应。
【实验4-1】
分别向盛有4 mL KBr溶液和4 mL KI溶液的两支试管中加入1 mL 氯水,振荡,观察溶液的颜色变化,并与氯水的颜色进行比较。 静置一段时间后,观察现象。写出反应的化学方程式。
向盛有4 mL KI溶液的试管中加入1 mL溴水,振荡,观察溶液的 颜色变化,并与溴水的颜色进行比较。静置一段时间后,观察现 象。写出反应的化学方程式。
实验操作 实验现象 离子方程式
结论
氯水 CCl 0 振荡 溶液由无色 变为橙色 2KBr+Cl =2KCI+BU2 2Br-+Cl =Br +2Cl-
氧化性:
Cl >Br >I
NaBr溶液
氯水 CCl 0 振荡 溶液由无色变 为褐色 2KI十Cl2=2KCI +I 2I-+Cl =I +2Cl-
KI溶液
CCl 溴水 振荡 KI 溶 液 溶液由无色变 为褐色 Br +2KT=2KBr十Ⅱ 2I-+Br =I +2Br
将F 通入饱和的NaCl溶液中能否置换出Cl 为什 么
因为氟气具有强氧化性,会先与水反
2F +2H O=4HF+O
所以氟气不能从其他卤化物的盐溶液中置换出 卤素单质
3.卤素单质间的置换反应
Cl Br I
2
A
氧化性逐渐减弱
元素的非金属性逐渐减弱
在元素周期表中,同主族元素从上到下原子核外电子层数依次 增多,原子半径逐渐增大,失电子能力逐渐增强。所以,金属性 逐渐增强。
在元素周期表中,同主族元素从下到上原子核外电子层数依次 增多,原子半径逐渐减小,得电子能力逐渐增强。所以,非金 属性逐渐增强。
同主族元素的性质与原子结构的关系:
非 个 VIA
F
Cl Br I
强 At
I A
Li
Na
K
Rb
Cs
金属性增强
金属性增
第四章 物质结构元素周期律 第一节原子结构与元素周期表 第3课时原子结构与元素的性质
元素种类 最外层电 子数(填< 或 > ) 容易得到还是 失去
具有的性质
金属元素 ≤4个 容易失去
金属性
非金属元素 ≥4个 容易得到
非金属性
根据初中所学原子结构的知识,填写下表
人们经常把元素周期表中的同族元素放在一起研究,
是因为他们之间存在着某种内在联系。那么,这种内 在的联系是什么呢 我们将从他们的结构和性质的关 系进行探讨。
Li Na K
Rb
Be Mg Ca Sr Ba
元素 名称 元素 符号 核电 荷数 原子结构 示意图 最外层 电子数 电子 层数
原子半 径/nm
碱金 属 元 素 锂 Li 3 +3 1 2
0.152
钠 Na 11 +11 1 3
0.186
钾 K 19 +19 1 4
0.227
铷 Rb 37 +37 81 1 5
0.248
铯 Cs 55 +55 2 8 181881 1 6
0.265
一、碱金属元素
1.从上往下碱金属元素原子的核电荷数、 原子半径如何变化
核电荷数逐渐增大,原子半径逐渐增大
2.从上往下原子核外电子排布有什么特 点 从哪一点能推断出碱金属的化学性 质具有相似性
最外层都只有一个电子,电子层数逐 渐增多;最外层都只有一个电子。
思考与交流
【证据推理】认识碱金属的化学性质
1、回忆第二章学过的知识,钠有哪些化学性质
与O 、水、酸、盐溶液反应
2、结合锂、钠和钾的原子结构特点,请你预测 锂、钾可能具有哪些与钠相似的化学性质。
与钠相似。与O 、水、酸、盐溶液反应
钠、钾化学性质比较
【实验和观察】
回忆钠与氧气、水反应的实验现象,并观察下列实验(由教师演示)。
(1)将干燥的坩埚加热,同时切取一块绿豆大的钾,用镊子夹取并迅速投到热坩 埚中(如图4-8)。继续加热片刻,待钾熔化后立即撤掉酒精灯,观察现象。
(2)在烧杯中加入一些水,滴入几滴酚酞溶液。切取一块绿豆大的钾,用镊子夹 取并投入水中(如图4-9),观察现象。
图4-8 钾在空气中燃烧
钠
钾
与 氧 气 反 应 剧烈燃烧,火焰呈黄 色,生成 淡黄色 的 固体
燃烧更剧烈,火焰呈紫色
注;钾与氧气反应生成多种氧 化物,该反应只是其中一个
K+O =KO (超氧化钾)
2Na+0 2
结论:金属的活泼性:K> Na。
(1)钠、钾与氧气的反应
钠
钾
实验 现象 钠浮在水面上;熔成光 亮的小球;小球四处游 动;发出嘶嘶的响声; 反应后滴入酚酞;溶液 变红。
钾浮于水面;迅速熔化 成银色小球;四处游动; 反应剧烈;有轻微爆炸 声并着火燃烧;反应
后滴入酚酞;溶液变红。
原理 2Na+2H O=2NaOH+H 个
2K+2H O=2KOH+H 个
结论 金属活动性:K > Na
(2)钠、钾与水的反应
碱金属化学性质的相似性和递变性与原子结构的 关系
相似性:最外层电子数都是1
结构相似
强还原性:容易失去1个电子
(与钠相似,与O 、水、酸、 盐溶液反应)
决
定
性质相似
元素 条件 现象 产物
结论
Li 加热 燃烧,较不 剧烈 Li O
从Li—Cs,
随电子层 数的递增,
还原性
(金属性) 逐渐增强。
Na 加热 燃烧,剧烈
K 稍加热 燃烧, 更剧烈 更复杂的 氧化物
Rb 接触空气 不加热 剧烈 更复杂的 氧化物
Cs 接触空气 不加热 剧烈 更复杂的 氧化物
与非金属的反应(以O 为例)
元素 现象 产物
结论
Li 会反应,比Na缓慢 对应的碱和氢气
从Li—Cs,
随电子层 数的递增,
还原性
(金属性)
逐渐增强。
Na 剧烈反应,有“浮、 熔、游、红、鸣”现象
K 更剧烈,气体会燃烧, 轻微爆炸
Rb 遇水燃烧,甚至爆炸
Cs
与水的反应
②递变性:从Li→Cs核电荷数增加
> 电子层数逐渐增多
> 原子半径逐渐增大
> 核对最外层电子的引力逐渐减弱
> 原子失电子的能力逐渐增强
> 元素的金属性逐渐增强
单质的还原性逐渐增强
与O 、 水等反应更快更剧烈
碱金属 单质 颜色和状态 密度 g ·cm-3 熔点 ℃
沸点
℃
Li 银白色,柔软 0.534 180.5
1347
Na 银白色,柔软 0.97 97.81
882.9
K 银白色,柔软 0.86 63.65
774
Rb 银白色,柔软 1.532 38.89
688
Cs 略带金属光泽,柔软 1.879 28.40
678.4
碱金属的物理性质
Li Na K Rb Cs
相 似
均为银白色(Cs略带金色)
柔软
较小
熔沸点
较低
导电导热性
强
密度变化
逐渐增大(K特殊)
熔沸点变化
单质的熔沸点逐渐降低
碱金属的物理性质的比较
(1)锂电池是一种高能电池;锂是优质的高 能燃料(已经用于宇宙飞船、人造卫星和超声 速飞机);有机化学中重要的催化剂。
(2)液态钠可作为核反应堆的传热介质。
(3)钾的化合物最大用途是做钾肥。硝酸钾 还用于做火药。
(4)铷铯主要用于制备光电管、真空管。铯原 子钟是目前最准确的计时仪器。
碱金属元素的用途:
二、卤族元素
卤族元素(简称卤素F、Cl、Br、I)是典型的 非金属元素,它们在自然界中都以化合态 存在。
F
I
卤素单质 颜色(常态) 密度 熔点/℃
沸点/℃
F (易液化) 淡黄绿色气 体 1.69g.L- (15℃) —219.6
—188.1
Cl 黄绿色气体 3.214g.L-1(0℃) -101
—34.6
Br 深红棕色液 体 3.119g ·cm-3(20℃) —7.2
58.78
I (易升化) 紫黑色固体 4.93g ·cm-3 113.5
184.4
1.卤族元素单质的物理性质
单质 颜色 状态 密度
熔沸点
H 2 由浅到深 气 液!固 由小到大
由低到高
Cl
Br
I
相似性:均有颜色,密度小,熔沸点低。
递变性:
F CI Br I
思考与讨论:根据卤素的原子结构,请你试着推测氟、 氯、溴、碘在化学性质上表现出的相似性和递变性。
原子结构特点如下:
(1)相似性:最外层电子数都是 7 。容易得到1个电 子,具有氧化性
(2)递变性:F→I, 核电荷数依次 增 大,电子层数依 次增 多,原子半径逐渐增 大。
2. 卤族元素的原子结构
H +F =2HF
暗处剧烈反应并爆炸;HF很稳定
H +Cl =2HCl
光照或点燃反应;HCl较稳定
H +Br =2HBr
加热500℃ ,HBr不稳定
H +I 2HI
需不断加热,HI同时分解
3. 卤素单质的化学性质
(1)与H 反应
阅读教材P97, 归纳卤素与氢气反应的相似性及反 应条件、产物稳定性等的递变规律
【结论】
1、与氢气反应的难易程度:由易到难
2、生成氢化物的稳定性: 由强到弱
3、卤素的非金属性强弱: 由强到弱
根据卤素单质与H 的反应事实,讨论随着原子 核电荷数的增多,卤素单质与H 反应的规律变 化
F Cl Br I
(2)卤素单质间的置换反应。
类似于金属与盐溶液的置换反应,卤素单质间也可发生置
换反应。
【实验4-1】
分别向盛有4 mL KBr溶液和4 mL KI溶液的两支试管中加入1 mL 氯水,振荡,观察溶液的颜色变化,并与氯水的颜色进行比较。 静置一段时间后,观察现象。写出反应的化学方程式。
向盛有4 mL KI溶液的试管中加入1 mL溴水,振荡,观察溶液的 颜色变化,并与溴水的颜色进行比较。静置一段时间后,观察现 象。写出反应的化学方程式。
实验操作 实验现象 离子方程式
结论
氯水 CCl 0 振荡 溶液由无色 变为橙色 2KBr+Cl =2KCI+BU2 2Br-+Cl =Br +2Cl-
氧化性:
Cl >Br >I
NaBr溶液
氯水 CCl 0 振荡 溶液由无色变 为褐色 2KI十Cl2=2KCI +I 2I-+Cl =I +2Cl-
KI溶液
CCl 溴水 振荡 KI 溶 液 溶液由无色变 为褐色 Br +2KT=2KBr十Ⅱ 2I-+Br =I +2Br
将F 通入饱和的NaCl溶液中能否置换出Cl 为什 么
因为氟气具有强氧化性,会先与水反
2F +2H O=4HF+O
所以氟气不能从其他卤化物的盐溶液中置换出 卤素单质
3.卤素单质间的置换反应
Cl Br I
2
A
氧化性逐渐减弱
元素的非金属性逐渐减弱
在元素周期表中,同主族元素从上到下原子核外电子层数依次 增多,原子半径逐渐增大,失电子能力逐渐增强。所以,金属性 逐渐增强。
在元素周期表中,同主族元素从下到上原子核外电子层数依次 增多,原子半径逐渐减小,得电子能力逐渐增强。所以,非金 属性逐渐增强。
同主族元素的性质与原子结构的关系:
非 个 VIA
F
Cl Br I
强 At
I A
Li
Na
K
Rb
Cs
金属性增强
金属性增
