第1章 物质及其变化 综合练习(含答案)
文档属性
| 名称 | 第1章 物质及其变化 综合练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 288.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-07-24 00:10:29 | ||
图片预览



文档简介
浙教版科学九年级上册第一章物质及其变化
一、单选题
1.人体内一些液体的pH如下所示,其中酸性最强的是( )
A.胃液:0.9~1.5 B.唾液:6.6~7.1
C.血浆:7.35~7.45 D.尿液:4.7~7.9
2.结构决定性质,性质决定用途。下列关于物质结构、性质、用途的说法正确的是( )
A.Na+和Na化学性质不同,是因为它们最外层电子数的不同
B.金刚石和石墨的物理性质不同,是由于构成它们的原子不同
C.金属铝和镁化学性质不同,主要是由于铝、镁原子的质子数不同
D.水变成水蒸气时体积膨胀,是由于受热时水分子变大
3. 下列变化属于化学变化的是( )
A.试管破碎 B.汽油挥发 C.水结成冰 D.木条燃烧
4.下列属于化学变化的是 ( )
A.冰雪融化 B.玻璃破碎
C.树木折断 D.用“84”消毒液消毒
5.下列说法错误的是( )
A.化学变化和化学反应是同一个概念
B.物质发生化学变化时一定同时发生物理变化
C.化学变化的特征就是一定会有沉淀生成
D.物质的性质决定了物质的变化,物质的变化反映了物质的性质
6.常温下某饱和的硝酸钾溶液,向该溶液中加入少量的浓硫酸(浓硫酸中的水可以忽略不计),对于溶液的变化情况下列叙述错误的是( )
A.溶液的总质量增加
B.硝酸钾溶质的质量分数减少
C.溶液的pH值将减小
D.硝酸钾的溶解度先增加后保持不变
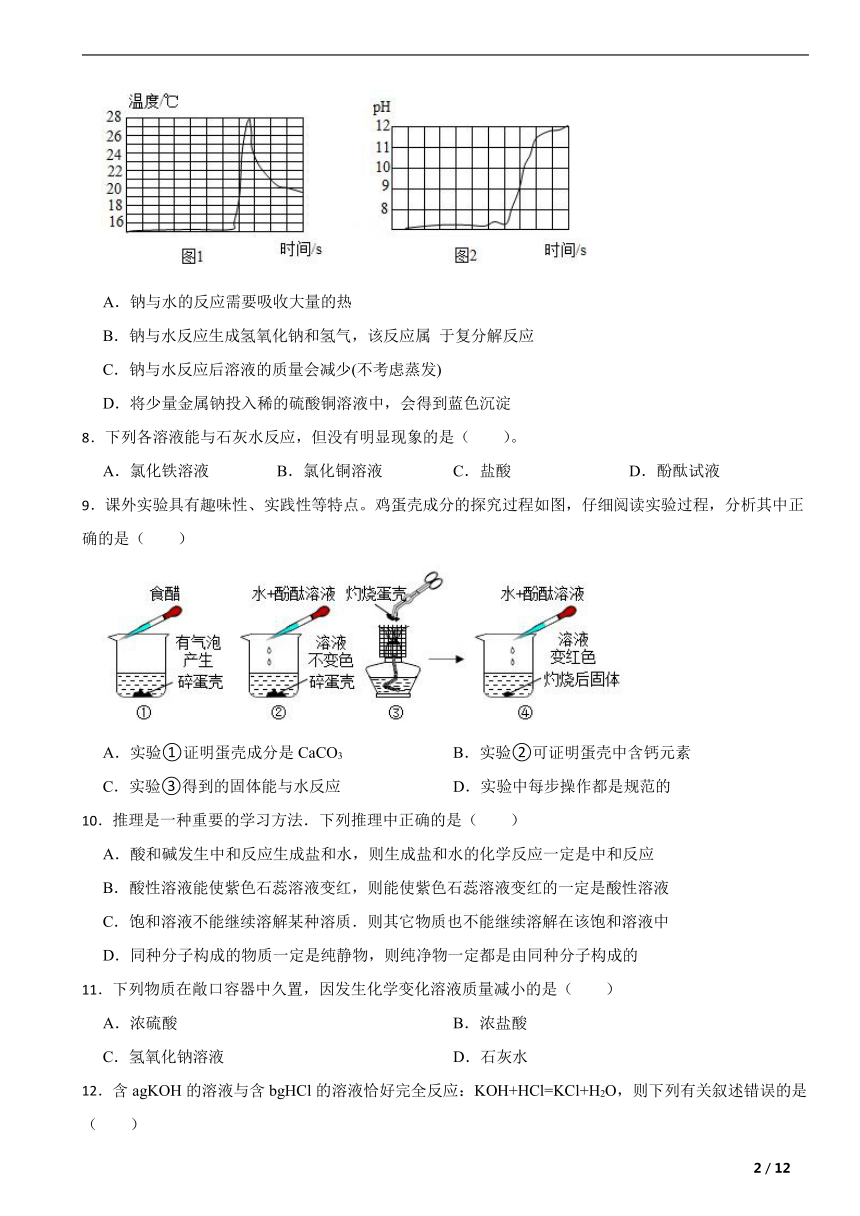
7.某化学学习小组用传感器探究钠与水的反应,得到如图图象,其中图1是反应过程中溶液温度与时间的关系图像,图2是反应过程中溶液pH+与时间的关系图象,下列说法正确的是( )
A.钠与水的反应需要吸收大量的热
B.钠与水反应生成氢氧化钠和氢气,该反应属 于复分解反应
C.钠与水反应后溶液的质量会减少(不考虑蒸发)
D.将少量金属钠投入稀的硫酸铜溶液中,会得到蓝色沉淀
8.下列各溶液能与石灰水反应,但没有明显现象的是( )。
A.氯化铁溶液 B.氯化铜溶液 C.盐酸 D.酚酞试液
9.课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图,仔细阅读实验过程,分析其中正确的是( )
A.实验①证明蛋壳成分是CaCO3 B.实验②可证明蛋壳中含钙元素
C.实验③得到的固体能与水反应 D.实验中每步操作都是规范的
10.推理是一种重要的学习方法.下列推理中正确的是( )
A.酸和碱发生中和反应生成盐和水,则生成盐和水的化学反应一定是中和反应
B.酸性溶液能使紫色石蕊溶液变红,则能使紫色石蕊溶液变红的一定是酸性溶液
C.饱和溶液不能继续溶解某种溶质.则其它物质也不能继续溶解在该饱和溶液中
D.同种分子构成的物质一定是纯静物,则纯净物一定都是由同种分子构成的
11.下列物质在敞口容器中久置,因发生化学变化溶液质量减小的是( )
A.浓硫酸 B.浓盐酸
C.氢氧化钠溶液 D.石灰水
12.含agKOH的溶液与含bgHCl的溶液恰好完全反应:KOH+HCl=KCl+H2O,则下列有关叙述错误的是( )
A.KOH和HCl发生了中和反应
B.反应后的溶液中溶质是KCl
C.产物KCl与NH4Cl都属于化肥的一种,但不属于同一类化肥
D.将反应后的溶液进行蒸发,可得到KCl晶体的质量为(a+b)g
13.探究中和反应是否发生的方法有多种。小华同学进行了以下四个实验,并用图像分别描述了实验过程中的现象。其中,依据图示现象不能判断中和反应一定发生的是( )
A.在稀盐酸中加入氯化铜,然后向其中逐滴加入NaOH溶液
B.在NaOH溶液中加入CaCO3,然后向其中逐滴加入稀盐酸
C.在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
D.在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸
14.如图所示的四个图像,能正确反映对应变化关系的是( )
A. 向质量均为M克的锌粉和铁粉中分别滴加100克质量分数相同的稀硫酸
B. 一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应
C. 一定量的稀盐酸中,滴加硝酸银溶液至过量
D. 一瓶浓盐酸和一瓶浓硫酸,在实验室中敞口放置一定时间
15.某同学发现对已做实验用的氢氧化钠溶液忘记了盖瓶塞。对于该溶液变质情况的探究,同学们的实验设计合理的是( )
A.取样,在溶液中加入少量的稀盐酸,如果无气泡产生,则可证明该溶液没有变质
B.取样,在溶液中滴加酚酞,如酚酞呈无色,则溶液已完全变质
C.取样,在溶液中加入过量滴有酚酞的氯化钡溶液,如产生白色沉淀,且上层清液呈红色,则溶液已经完全变质
D.取样,在溶液中加入过量的稀盐酸,如果有气泡产生,则可证明该溶液已变质
二、填空题
16.小科同学发现校园中的玫瑰花生长不茂盛,叶子发黄。她想:
(1)可能是缺少氮元素,需要施加下列肥料中的 (填字母);
A.K2CO3 B.NH4Cl C.Ca(H2PO4)2
(2)也可能是土壤酸性太强,可以用实验室中的 测定土壤的酸碱度;
(3)若土壤酸性太强,农业上可以用施加 来降低土壤的酸性。
17.请选择合适物质的序号填空:a.盐酸b.碳酸钠c.熟石灰d.食盐
(1)在日常生活中用做调味剂的是
(2)常用降低土壤酸性的是
(3)少量存于胃液中帮助消化的是
18.在学习“酸碱中和反应”时,老师给大家变了一个魔术——使“水”变色的杯子。操作过程及现象如图所示。
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:
(1)“空”杯内涂抹的物质可能是 溶液。
(2)此过程中发生反应的化学方程式可能是 。
(3)最终溶液为无色,能否说明该溶液一定呈中性? (选填“能”或“不 能”),理由是 。
19. 2015年6月5日是世界环境日,我国的主题是“践行绿色生活”,爱护水资源、节约用水是其中重要内容之一.
(1)淡水资源有限,我们需要节约用水.如图中表示节水标志的是 (填字母)
(2)长期饮用酸碱度过大或硬度过大的水都不利于人体健康,在实验室里可用 来测定水的酸碱度;生活中常讲的“烧开水”是指利用 的方法,获得可以饮用的水,这样既可以降低水的硬度又可以除去水中的细菌.
(3)下列与自来水的净化过程无关的是 (填序号)
A.沉降 B.过滤 C.消毒 D.电解.
20.化学实验小组为验证氢氧化钙的化学性质进行了一系列实验。
(1)按如图进行实验,写出甲实验中发生反应的化学方程式 。
(2)为确定两个实验后剩余物的成分,继续实验:
①将少量氧化铁加入甲实验后的溶液中,发现红棕色固体消失,溶液变为 色。
②取乙实验所得上层清液于烧杯中,为确定溶质成分,下列实验方案可行的是 (填序号)
A.将烧杯久置于空气中,杯内物质质量增加(忽略水的蒸发)
B.向烧杯内通入二氧化碳,变浑浊
C.向烧杯内加入足量稀盐酸,没有气泡产生
D.向烧杯内加入氯化铵并微热,产生有氨味的气体
三、实验探究题
21. 某化学实验小组用两种方法验证空气中的氧气含量.
(1)方法一:如图A所示进行.
(1)写出图A中二氧化碳与氢氧化钠溶液反应的化学方程式 .
(2)小星同学对该实验提出质疑:木炭在燃烧过程中,氧气浓度降低,参加反应的木炭[m(C)]与氧气[]的质量之比在 范围内,生成的CO对实验结果会产生误差.
(2)方法二:如图B所示进行.
(1)写出图B中红磷燃烧的化学方程式 .
(2)实验测定数据如表:(集气瓶的容积为100mL).
组别 1 2 3 4 5 6
进入集气瓶中水的体积/mL 30 21 19 22 15 20
分析实验数据,第2,3,4,6组验证出氧气约占空气体积的 ,第5组出现较大偏差的原因可能是 .
22.用下图装置进行实验(夹持仪器略去).加热一段时间后,蜡烛熔化、掉落,之后火柴燃烧.
(1)能说明铜具有导热性的现象是
(2)能体现物质化学性质的现象是____(填序号).
A.酒精燃烧 B.蜡烛熔化 C.火柴燃烧
23.氯气(Cl2)是一种黄绿色气体,它可溶于水,得到黄绿色的氯水。它易与氢氧化钠反应,不与硫酸反应。
(1)小明对氯气溶于水的过程中所发生的变化提出了两种假设:
假设1:氯气溶于水的过程中只有物理变化
假设2:氯气溶于水的过程中既有物理变化又有化学变化
小明向氯水中加入紫色石蕊试液,发现溶液先变红后褪色。由溶液变红可知氯水显 性,从而知道氯气溶于水的过程中发生了化学变化。假设2成立。
(2)小明对褪色现象产生了兴趣,查阅资料后了解到氯水有漂白性。氯水中有氯气分子,还有氯气与水反应得到的盐酸和次氯酸(HClO)。他对氯水的漂白性提出了3种假设:
A.盐酸有漂白性
B.氯气有漂白性
C.次氯酸有漂白性
经过认真思考,小明否定了假设A,请写出依据 。
实验室制备的氯气往往带有水蒸气和其他杂质。为了探究氯气是否具有漂白性,必须要用纯净、干燥的氯气。图甲是小明为了干燥氯气所设计的装置图。请在图甲中将广口瓶中的导管画完整,并在图中的 处写出试剂名称。最后,将经过除杂后得到的干燥氯气通入装有有色布条的试管中(如图乙),布条颜色不变。得出结论:氯气不具有漂白性。
(3)次氯酸除有漂白性外还有不稳定性。小明设计了一套装置,收集到一试管次氯酸见光分解后生成的气体,将带火星的木条伸入试管,发现木条复燃,说明分解产物中含有 。
24.某科学小组利用氨水(即氨气溶于水中)能使无色的酚酞试液变红的原理,设计如图实验以探究“分子在不停地运动着”,请回答实验中的有关问题。
(1)实验Ⅰ:在盛有少量燕馏水的小烧杯中滴入2~3滴无色酚酞试液,没有颜色变化,再向其中滴加无色透明浓氨水。溶液颜色变为红色,由实验Ⅰ得出的结论有 。
(2)实验Ⅱ(如图甲所示):烧杯A中的现象是 ;产生这一现象的原因是 。
(3)该兴趣小组设计实验Ⅲ(如图乙所示)作为对照实验。仅凭实验Ⅲ能验证“分子在不停地运动着”吗? 理由是 。
四、解答题
25.治污水是“五水共治”内容之一,根据国家标准,废水排放时铅元素的含量不允许超过1.0毫升/升,蓄电池生产企业往往采用化学沉淀法处理Pb2-,其中以氢氧化物沉淀法应用较多。
20℃时,各种铅的化合物在水中的溶解度
物质 溶解度/g 物质 溶解度/g
Pb(NO3)2 54.3 PbCO3 7.3×10-3
Pb(OH)2 1.6×10-4 PbS 6.8×10×10-13
(1)根据图表信息,沉淀剂除了NaOH外,还可使用的两种钠盐是 。
(2)某蓄电池生产企业购得40%的烧碱溶液100千克,若废水处理时需要溶质质量分数为10%的NaOH溶液,则应对所购烧碱溶液加水 千克进行稀释。
26.常温下,向一定量的稀盐酸中逐滴加入氢氧化钠溶液至过量.测得水的质量、氯化钠的质量随氢氧化钠溶液质量的变化关系如图甲、乙所示。求:
(1) 图像 表示氯化钠的质量随氢氧化钠溶液质量的变化关系。
(2)当加入40gNaOH 溶液时,所得溶液的溶质质量分数。
(3)a 的值。
(4)稀盐酸的溶质质量分数。(计算结果精确至0.1%)
27.某同学对氯化钠、烧碱、纯碱、无水硫酸铜、硫酸铜晶体等五种样品进行鉴别。
(1)观察样品,颜色为蓝色的是 。
(2)余下四种样品,分别取少量置于试管中,加水溶解,溶液呈 色的是 。
(3)再在剩下的三种溶液中,加入 ,无明显现象的是氯化钠。
(4)最后两种溶液中加 ,有气泡生成的是 ,无气泡的是 。
28.浓硫酸具有脱水性,能把小木棍、蔗糖等中的氢元素和氧元素“脱出”结合生成水。
(1)用小木棍蘸取浓硫酸少许,一段时间后,小木棍上出现的实验现象是 。
(2)在蔗糖(C12H22O11)分子中,氢、氧原子个数比是 。如果蔗糖完全脱水,则生成C和H2O的质量比是 。
(3)将44克有机物完全燃烧,生成88克CO2和36克H2O(无其他产物).已知该有机物的相对分子质量为88,则44克有机物中含碳元素 克,该有机物的化学式为 .
答案解析部分
1.【答案】A
2.【答案】A
3.【答案】D
4.【答案】D
5.【答案】C
6.【答案】D
7.【答案】D
8.【答案】C
9.【答案】C
10.【答案】B
11.【答案】D
12.【答案】D
13.【答案】D
14.【答案】D
15.【答案】D
16.【答案】(1)B
(2)pH试纸
(3)熟石灰
17.【答案】(1)d
(2)c
(3)a
18.【答案】(1)氢氧化钠
(2)NaOH+HCl=NaCl+H2O
(3)不能;酚酞试液在中性和酸性溶液中均呈现无色
19.【答案】B;pH试纸;煮沸;D
20.【答案】(1)Ca(OH)2+2HCl=CaCl2+2H2O
(2)黄色;B
21.【答案】(1)CO2+2NaOH=Na2CO3+H2O;大于3:8而小于或等于3:4
(2)4P+5O22P2O5;;没有冷却到室温读数等(合理即可)
22.【答案】(1)蜡烛熔化 掉落(或火柴燃烧)
(2)A;C
23.【答案】(1)酸
(2)盐酸能使紫色石蕊试液变红,且不褪色;
(3)氧气
24.【答案】(1)酚酞试液遇蒸馏水不变色,酚酞试液遇浓氨水变红色
(2)溶液变红;氨分子微粒从烧杯B运动到烧杯A中,溶于水使酚酞试液变红
(3)不能;蒸馏水不能使酚酞试液变红,观察不到明显的现象
25.【答案】(1)碳酸钠和硫化钠
(2)300
26.【答案】(1)甲
(2)设当加入NaOH 溶液20g 时, 其溶质为x。
NaOH+HCl =NaCl+H2 O
40 58.5
x 5.85 g
当加入40g NaOH 溶液时恰好反应, 设生成NaCl质量为y。
NaOH + HCl=NaCl+H2 O
40 36.5 58.5 18
40 g×20% m y n
(3)设恰好反应时,需要HCl的质量为m,生成水的质量为n。
m=7.3g n=3.6 g
ag+3.6g+(40g-40g×20%)=105.3g
(4).5%
27.【答案】(1)硫酸铜晶体
(2)蓝;无水硫酸铜
(3)无色酚酞
(4)稀盐酸;纯碱;烧碱
28.【答案】(1)小木棍变黑
(2)2:1;8:11
(3)24克;C4H8O2
1 / 1
一、单选题
1.人体内一些液体的pH如下所示,其中酸性最强的是( )
A.胃液:0.9~1.5 B.唾液:6.6~7.1
C.血浆:7.35~7.45 D.尿液:4.7~7.9
2.结构决定性质,性质决定用途。下列关于物质结构、性质、用途的说法正确的是( )
A.Na+和Na化学性质不同,是因为它们最外层电子数的不同
B.金刚石和石墨的物理性质不同,是由于构成它们的原子不同
C.金属铝和镁化学性质不同,主要是由于铝、镁原子的质子数不同
D.水变成水蒸气时体积膨胀,是由于受热时水分子变大
3. 下列变化属于化学变化的是( )
A.试管破碎 B.汽油挥发 C.水结成冰 D.木条燃烧
4.下列属于化学变化的是 ( )
A.冰雪融化 B.玻璃破碎
C.树木折断 D.用“84”消毒液消毒
5.下列说法错误的是( )
A.化学变化和化学反应是同一个概念
B.物质发生化学变化时一定同时发生物理变化
C.化学变化的特征就是一定会有沉淀生成
D.物质的性质决定了物质的变化,物质的变化反映了物质的性质
6.常温下某饱和的硝酸钾溶液,向该溶液中加入少量的浓硫酸(浓硫酸中的水可以忽略不计),对于溶液的变化情况下列叙述错误的是( )
A.溶液的总质量增加
B.硝酸钾溶质的质量分数减少
C.溶液的pH值将减小
D.硝酸钾的溶解度先增加后保持不变
7.某化学学习小组用传感器探究钠与水的反应,得到如图图象,其中图1是反应过程中溶液温度与时间的关系图像,图2是反应过程中溶液pH+与时间的关系图象,下列说法正确的是( )
A.钠与水的反应需要吸收大量的热
B.钠与水反应生成氢氧化钠和氢气,该反应属 于复分解反应
C.钠与水反应后溶液的质量会减少(不考虑蒸发)
D.将少量金属钠投入稀的硫酸铜溶液中,会得到蓝色沉淀
8.下列各溶液能与石灰水反应,但没有明显现象的是( )。
A.氯化铁溶液 B.氯化铜溶液 C.盐酸 D.酚酞试液
9.课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图,仔细阅读实验过程,分析其中正确的是( )
A.实验①证明蛋壳成分是CaCO3 B.实验②可证明蛋壳中含钙元素
C.实验③得到的固体能与水反应 D.实验中每步操作都是规范的
10.推理是一种重要的学习方法.下列推理中正确的是( )
A.酸和碱发生中和反应生成盐和水,则生成盐和水的化学反应一定是中和反应
B.酸性溶液能使紫色石蕊溶液变红,则能使紫色石蕊溶液变红的一定是酸性溶液
C.饱和溶液不能继续溶解某种溶质.则其它物质也不能继续溶解在该饱和溶液中
D.同种分子构成的物质一定是纯静物,则纯净物一定都是由同种分子构成的
11.下列物质在敞口容器中久置,因发生化学变化溶液质量减小的是( )
A.浓硫酸 B.浓盐酸
C.氢氧化钠溶液 D.石灰水
12.含agKOH的溶液与含bgHCl的溶液恰好完全反应:KOH+HCl=KCl+H2O,则下列有关叙述错误的是( )
A.KOH和HCl发生了中和反应
B.反应后的溶液中溶质是KCl
C.产物KCl与NH4Cl都属于化肥的一种,但不属于同一类化肥
D.将反应后的溶液进行蒸发,可得到KCl晶体的质量为(a+b)g
13.探究中和反应是否发生的方法有多种。小华同学进行了以下四个实验,并用图像分别描述了实验过程中的现象。其中,依据图示现象不能判断中和反应一定发生的是( )
A.在稀盐酸中加入氯化铜,然后向其中逐滴加入NaOH溶液
B.在NaOH溶液中加入CaCO3,然后向其中逐滴加入稀盐酸
C.在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
D.在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸
14.如图所示的四个图像,能正确反映对应变化关系的是( )
A. 向质量均为M克的锌粉和铁粉中分别滴加100克质量分数相同的稀硫酸
B. 一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应
C. 一定量的稀盐酸中,滴加硝酸银溶液至过量
D. 一瓶浓盐酸和一瓶浓硫酸,在实验室中敞口放置一定时间
15.某同学发现对已做实验用的氢氧化钠溶液忘记了盖瓶塞。对于该溶液变质情况的探究,同学们的实验设计合理的是( )
A.取样,在溶液中加入少量的稀盐酸,如果无气泡产生,则可证明该溶液没有变质
B.取样,在溶液中滴加酚酞,如酚酞呈无色,则溶液已完全变质
C.取样,在溶液中加入过量滴有酚酞的氯化钡溶液,如产生白色沉淀,且上层清液呈红色,则溶液已经完全变质
D.取样,在溶液中加入过量的稀盐酸,如果有气泡产生,则可证明该溶液已变质
二、填空题
16.小科同学发现校园中的玫瑰花生长不茂盛,叶子发黄。她想:
(1)可能是缺少氮元素,需要施加下列肥料中的 (填字母);
A.K2CO3 B.NH4Cl C.Ca(H2PO4)2
(2)也可能是土壤酸性太强,可以用实验室中的 测定土壤的酸碱度;
(3)若土壤酸性太强,农业上可以用施加 来降低土壤的酸性。
17.请选择合适物质的序号填空:a.盐酸b.碳酸钠c.熟石灰d.食盐
(1)在日常生活中用做调味剂的是
(2)常用降低土壤酸性的是
(3)少量存于胃液中帮助消化的是
18.在学习“酸碱中和反应”时,老师给大家变了一个魔术——使“水”变色的杯子。操作过程及现象如图所示。
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:
(1)“空”杯内涂抹的物质可能是 溶液。
(2)此过程中发生反应的化学方程式可能是 。
(3)最终溶液为无色,能否说明该溶液一定呈中性? (选填“能”或“不 能”),理由是 。
19. 2015年6月5日是世界环境日,我国的主题是“践行绿色生活”,爱护水资源、节约用水是其中重要内容之一.
(1)淡水资源有限,我们需要节约用水.如图中表示节水标志的是 (填字母)
(2)长期饮用酸碱度过大或硬度过大的水都不利于人体健康,在实验室里可用 来测定水的酸碱度;生活中常讲的“烧开水”是指利用 的方法,获得可以饮用的水,这样既可以降低水的硬度又可以除去水中的细菌.
(3)下列与自来水的净化过程无关的是 (填序号)
A.沉降 B.过滤 C.消毒 D.电解.
20.化学实验小组为验证氢氧化钙的化学性质进行了一系列实验。
(1)按如图进行实验,写出甲实验中发生反应的化学方程式 。
(2)为确定两个实验后剩余物的成分,继续实验:
①将少量氧化铁加入甲实验后的溶液中,发现红棕色固体消失,溶液变为 色。
②取乙实验所得上层清液于烧杯中,为确定溶质成分,下列实验方案可行的是 (填序号)
A.将烧杯久置于空气中,杯内物质质量增加(忽略水的蒸发)
B.向烧杯内通入二氧化碳,变浑浊
C.向烧杯内加入足量稀盐酸,没有气泡产生
D.向烧杯内加入氯化铵并微热,产生有氨味的气体
三、实验探究题
21. 某化学实验小组用两种方法验证空气中的氧气含量.
(1)方法一:如图A所示进行.
(1)写出图A中二氧化碳与氢氧化钠溶液反应的化学方程式 .
(2)小星同学对该实验提出质疑:木炭在燃烧过程中,氧气浓度降低,参加反应的木炭[m(C)]与氧气[]的质量之比在 范围内,生成的CO对实验结果会产生误差.
(2)方法二:如图B所示进行.
(1)写出图B中红磷燃烧的化学方程式 .
(2)实验测定数据如表:(集气瓶的容积为100mL).
组别 1 2 3 4 5 6
进入集气瓶中水的体积/mL 30 21 19 22 15 20
分析实验数据,第2,3,4,6组验证出氧气约占空气体积的 ,第5组出现较大偏差的原因可能是 .
22.用下图装置进行实验(夹持仪器略去).加热一段时间后,蜡烛熔化、掉落,之后火柴燃烧.
(1)能说明铜具有导热性的现象是
(2)能体现物质化学性质的现象是____(填序号).
A.酒精燃烧 B.蜡烛熔化 C.火柴燃烧
23.氯气(Cl2)是一种黄绿色气体,它可溶于水,得到黄绿色的氯水。它易与氢氧化钠反应,不与硫酸反应。
(1)小明对氯气溶于水的过程中所发生的变化提出了两种假设:
假设1:氯气溶于水的过程中只有物理变化
假设2:氯气溶于水的过程中既有物理变化又有化学变化
小明向氯水中加入紫色石蕊试液,发现溶液先变红后褪色。由溶液变红可知氯水显 性,从而知道氯气溶于水的过程中发生了化学变化。假设2成立。
(2)小明对褪色现象产生了兴趣,查阅资料后了解到氯水有漂白性。氯水中有氯气分子,还有氯气与水反应得到的盐酸和次氯酸(HClO)。他对氯水的漂白性提出了3种假设:
A.盐酸有漂白性
B.氯气有漂白性
C.次氯酸有漂白性
经过认真思考,小明否定了假设A,请写出依据 。
实验室制备的氯气往往带有水蒸气和其他杂质。为了探究氯气是否具有漂白性,必须要用纯净、干燥的氯气。图甲是小明为了干燥氯气所设计的装置图。请在图甲中将广口瓶中的导管画完整,并在图中的 处写出试剂名称。最后,将经过除杂后得到的干燥氯气通入装有有色布条的试管中(如图乙),布条颜色不变。得出结论:氯气不具有漂白性。
(3)次氯酸除有漂白性外还有不稳定性。小明设计了一套装置,收集到一试管次氯酸见光分解后生成的气体,将带火星的木条伸入试管,发现木条复燃,说明分解产物中含有 。
24.某科学小组利用氨水(即氨气溶于水中)能使无色的酚酞试液变红的原理,设计如图实验以探究“分子在不停地运动着”,请回答实验中的有关问题。
(1)实验Ⅰ:在盛有少量燕馏水的小烧杯中滴入2~3滴无色酚酞试液,没有颜色变化,再向其中滴加无色透明浓氨水。溶液颜色变为红色,由实验Ⅰ得出的结论有 。
(2)实验Ⅱ(如图甲所示):烧杯A中的现象是 ;产生这一现象的原因是 。
(3)该兴趣小组设计实验Ⅲ(如图乙所示)作为对照实验。仅凭实验Ⅲ能验证“分子在不停地运动着”吗? 理由是 。
四、解答题
25.治污水是“五水共治”内容之一,根据国家标准,废水排放时铅元素的含量不允许超过1.0毫升/升,蓄电池生产企业往往采用化学沉淀法处理Pb2-,其中以氢氧化物沉淀法应用较多。
20℃时,各种铅的化合物在水中的溶解度
物质 溶解度/g 物质 溶解度/g
Pb(NO3)2 54.3 PbCO3 7.3×10-3
Pb(OH)2 1.6×10-4 PbS 6.8×10×10-13
(1)根据图表信息,沉淀剂除了NaOH外,还可使用的两种钠盐是 。
(2)某蓄电池生产企业购得40%的烧碱溶液100千克,若废水处理时需要溶质质量分数为10%的NaOH溶液,则应对所购烧碱溶液加水 千克进行稀释。
26.常温下,向一定量的稀盐酸中逐滴加入氢氧化钠溶液至过量.测得水的质量、氯化钠的质量随氢氧化钠溶液质量的变化关系如图甲、乙所示。求:
(1) 图像 表示氯化钠的质量随氢氧化钠溶液质量的变化关系。
(2)当加入40gNaOH 溶液时,所得溶液的溶质质量分数。
(3)a 的值。
(4)稀盐酸的溶质质量分数。(计算结果精确至0.1%)
27.某同学对氯化钠、烧碱、纯碱、无水硫酸铜、硫酸铜晶体等五种样品进行鉴别。
(1)观察样品,颜色为蓝色的是 。
(2)余下四种样品,分别取少量置于试管中,加水溶解,溶液呈 色的是 。
(3)再在剩下的三种溶液中,加入 ,无明显现象的是氯化钠。
(4)最后两种溶液中加 ,有气泡生成的是 ,无气泡的是 。
28.浓硫酸具有脱水性,能把小木棍、蔗糖等中的氢元素和氧元素“脱出”结合生成水。
(1)用小木棍蘸取浓硫酸少许,一段时间后,小木棍上出现的实验现象是 。
(2)在蔗糖(C12H22O11)分子中,氢、氧原子个数比是 。如果蔗糖完全脱水,则生成C和H2O的质量比是 。
(3)将44克有机物完全燃烧,生成88克CO2和36克H2O(无其他产物).已知该有机物的相对分子质量为88,则44克有机物中含碳元素 克,该有机物的化学式为 .
答案解析部分
1.【答案】A
2.【答案】A
3.【答案】D
4.【答案】D
5.【答案】C
6.【答案】D
7.【答案】D
8.【答案】C
9.【答案】C
10.【答案】B
11.【答案】D
12.【答案】D
13.【答案】D
14.【答案】D
15.【答案】D
16.【答案】(1)B
(2)pH试纸
(3)熟石灰
17.【答案】(1)d
(2)c
(3)a
18.【答案】(1)氢氧化钠
(2)NaOH+HCl=NaCl+H2O
(3)不能;酚酞试液在中性和酸性溶液中均呈现无色
19.【答案】B;pH试纸;煮沸;D
20.【答案】(1)Ca(OH)2+2HCl=CaCl2+2H2O
(2)黄色;B
21.【答案】(1)CO2+2NaOH=Na2CO3+H2O;大于3:8而小于或等于3:4
(2)4P+5O22P2O5;;没有冷却到室温读数等(合理即可)
22.【答案】(1)蜡烛熔化 掉落(或火柴燃烧)
(2)A;C
23.【答案】(1)酸
(2)盐酸能使紫色石蕊试液变红,且不褪色;
(3)氧气
24.【答案】(1)酚酞试液遇蒸馏水不变色,酚酞试液遇浓氨水变红色
(2)溶液变红;氨分子微粒从烧杯B运动到烧杯A中,溶于水使酚酞试液变红
(3)不能;蒸馏水不能使酚酞试液变红,观察不到明显的现象
25.【答案】(1)碳酸钠和硫化钠
(2)300
26.【答案】(1)甲
(2)设当加入NaOH 溶液20g 时, 其溶质为x。
NaOH+HCl =NaCl+H2 O
40 58.5
x 5.85 g
当加入40g NaOH 溶液时恰好反应, 设生成NaCl质量为y。
NaOH + HCl=NaCl+H2 O
40 36.5 58.5 18
40 g×20% m y n
(3)设恰好反应时,需要HCl的质量为m,生成水的质量为n。
m=7.3g n=3.6 g
ag+3.6g+(40g-40g×20%)=105.3g
(4).5%
27.【答案】(1)硫酸铜晶体
(2)蓝;无水硫酸铜
(3)无色酚酞
(4)稀盐酸;纯碱;烧碱
28.【答案】(1)小木棍变黑
(2)2:1;8:11
(3)24克;C4H8O2
1 / 1
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
