化学键高一上学期化学人教版(2019)必修第一册(共34张PPT)
文档属性
| 名称 | 化学键高一上学期化学人教版(2019)必修第一册(共34张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 616.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-24 00:00:00 | ||
图片预览










文档简介
(共34张PPT)
第四章物质结构元素周期律
第3节化学键
(1)离子键
苹果能够落在地上,人在地球上生活而不自动脱离地 球,均是因为地球的吸引力,也就是说宏观物质之间 存在力的作用才能够“稳定存在”。
那么化学物质(如: NaCI、HCI、H O 等)能够稳定 存在,构成这些物质的微观粒子之间是不是也存在着 作用力呢
化学键
定义:分子内相邻原子(或离子)之间强烈的相互作 用。
什么是离子键和共价键呢
它们分别是通过什么作用形成物质的呢
离子键
共价键
●●●●●●
化学键
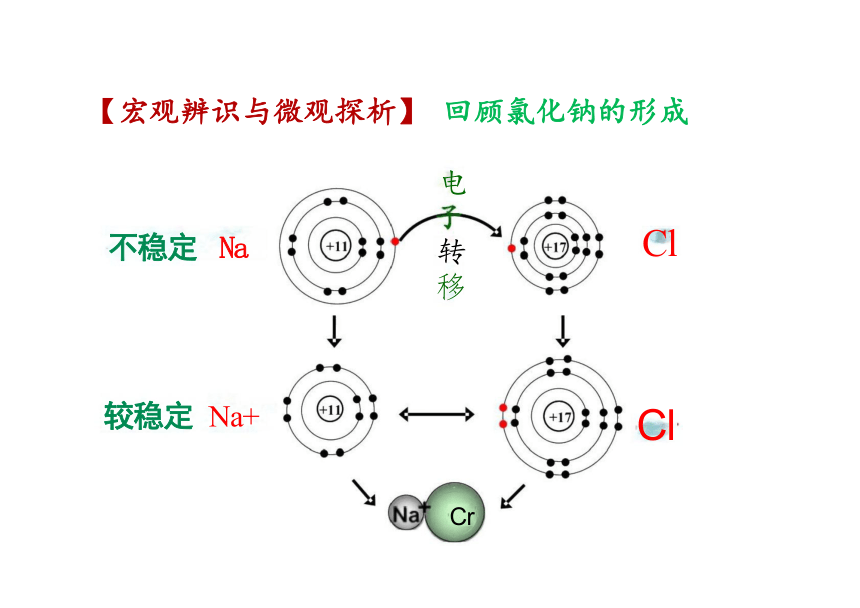
电
不稳定 Na
移
较稳定 Na+
Cr
【宏观辨识与微观探析】 回顾氯化钠的形成
Cl
Cl
转
【证据推理与模型认知】分析离子键的形成
在氯化钠晶体中,Na+ 和Cl-间存在哪些力
Na+和Cl-所带电荷的静电吸引
Na+和Cl-间电子与电子、原子核与原子核间的
相互排斥
当阴阳离子接近到某一定距离时,吸引和排斥作 用达到平衡,阴阳离子间形成稳定的离子键。
一、离子键
1.概念:带相反电荷离子之间的强烈相互作用
2.成键粒子:阴阳离子
3.成键本质:静电作用
(静电吸引和静电排斥的平衡)
哪些物质中存在离子键呢
1、活泼的金属元素和活泼的非金属元素之间的化合物。 (如:Na O(IA、IIA)) (VIA 、VIIA)
2、活泼的金属元素和酸根离子形成的盐 。 (如:NaNO )
3、铵根和酸根离子(或活泼非金属元素)形成的
盐。 如:NH CI,(NH ) SO
4、活 泼 的金属阳离子与OH- 形成的碱 。 ( 如 NaOH)
由 离子键构成的化合物叫做离子化合物。
注意:离子化合物固体不导电,但熔化或溶于水后能导
由
1、具有下列最外层电子数的原子,最难形成离子 的是( B )
A 、L层6个 B 、L层4个
C、M 层2个 D、M 层7个
2、不能形成离子键的是( D )
A、钠和氟 B、镁和溴
C、钙和氧 D 、氯和氧
3、下列各组原子序数所表示的A、B 两种元素,
能形成AB 型含离子的化合物的是( D )
A 、6和8 B 、11和13
C 、11和16 D 、12和17
化学反应中一般是原子的最外层电
子发生变化,所以化学反应中需要表示出 最外层电子的变化,那么用什么来表示
呢
●
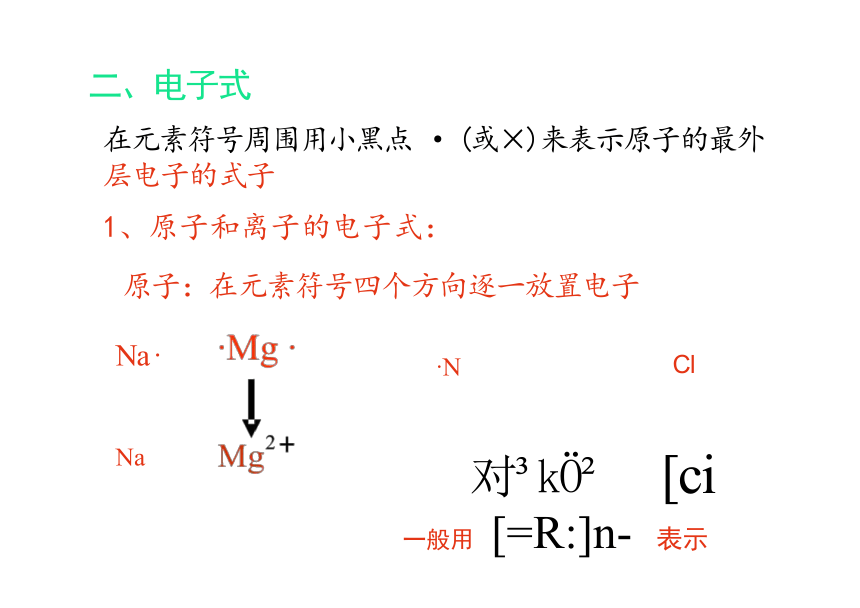
二、电子式
在元素符号周围用小黑点 · (或×)来表示原子的最外
层电子的式子
1、原子和离子的电子式:
原子:在元素符号四个方向逐一放置电子
·N Cl
对 k [ci
一般用 [=R:]n- 表示
Na ·
Na
①由阴、阳离子的电子式组成
②相同离子不能合并,同性电荷不直接相邻
2、离子化合物
AB型(如:NaCl)Na[Cx]
A B 型(Na O)
AB 型(MgCl )
(5)用电子式表示由原子形成离子化合物的过程
K×+··+×K —K+[Sak
:Br +×Mgx+·Br:—[:Br]Mg#[Br:
书写要点①左侧写原子的电子式
②用弧形箭头表示电子转移的方向
③中间用 — → 连接
④右侧写离子化合物的电子式
1、写出下列微粒的电子式:
(1)硫原子 (S)、 硫离子 (S -)
(2)溴原子 (Br)、 溴离子 (Br-)
(3)氟原子 (F) 、 氟离子 (F-)
(4)铝原子 (Al)、 铝离子(AI +)
2、写出下列离子化合物的电子式:
氯化钙 [Clx]Ca +[xcir- 氯化钠 Nat [:ci:]
硫化钠 Na+[×S×] -Na+ 氟化钾 K+[×F:]
3、用电子式表示氧化镁和硫化钾的形成过程
Mg·+·O·→Mg +[:O:]2-
2K·十 ·S·→K+[:S:]2-K+
·
4、下列说法正确的是( D )
A. 离子键就是使阴、阳离子结合成化合物的静电引力 B.所有金属与所有非金属原子之间都能形成离子键
C.因为离子键是一种强相互作用,所以离子化合物均很
难分解
D.含有离子键的化合物一定是离子化合物
5.下列物质中属于离子化合物的是( C )
A. 硝酸 B. 氨气 C. 氯化铵 D. 氯化氢
→成键微粒:阳离子和阴离子
→成键本质:静电作用
成键元素:一般是活泼金属 和活泼非金属
→大多数盐:如NaCl 、K SO 等
活泼金属氧化物:如Na O、CaO 等
→概念:由离子键构成的化合物
强碱:如NaOH、KOH等
离 子 键 形 成 离 子 化 合 物
【归纳总结】 离子键和离子化合物
→概念:带相反电荷离子之间的相互作用
常见
类型
成键
要素
第四章物质结构元素周期律
第3节化学键
(2)共价键
活泼的金属元素和活泼非金属元素化合时形
成离子键。请思考,非金属元素之间化合时, 能形成离子键吗 为什么
不能,因非金属元素的原子均有获得电子的倾向。
【思考与交流1】
+1
H
均不容易
失 去e-
CI
形成共用电子对,双 方都达到稳定结构— —共赢
共用电子对偏向 氯,偏离氢
氯化氢的形成
【思考与交流2】氯原子是如何形成氯气分子的
C|. 十 :Cl:Cl:
氯原子最外层有7个电子,不能通过原子间得 失电子达到稳定结构
2个氯原子各提供一个电子,形成共用电子对, 2个氯原子就都形成了8电子稳定结构
一、共价键
1、定 义 :
原子之间通过共用电子对所形成的强烈相互作 用,为共价键。
2、共价键的成键特点
成键微粒:原 子
成键本质:共用电子对
思考
下列物质中含有共价键吗,分别是那些原子间存
在共价键
N CO NaOH NH C
含有共价键的化合物不 一 定是共价化合物
共价化合物:以共用电子对形成分子的化合物。
注意:共价化合物只含有共价键。
3、共价键的存在
(1)共价化合物: 只含有共价键的化合物
HCl 、CO 、NH ..
(2)多原子非金属单质: Cl 、O 、P ..
(3)含根的离子化合物: NaOH 、Na O 、 NH Cl 、NH NO
含有共价键的化合物不一定是共价化合物
化学键和化合物关系的“三个一定”和“三个可能”
(1)“三个一定”
①离子化合物中一定含离子键;
②含离子键的一定是离子化合物;
③共价化合物中一定不含离子键。
(2)“三个可能”
①离子化合物中可能含有共价键,如NaOH;
②金属与非金属形成的化合物可能是共价化合物,如AICl ;
③完全由非金属形成的化合物可能是离子化合物,如N H Cl。
4、共价键的分类
非极性键:共用电子对不发生偏移 成键元素相同
极性键:共用电子对偏向某一方 成键元素不同
H:H H:Cl:
电子 对不
偏移
电子 对偏 向CI
十
下列物质中是否存在共价键 如果有并指明其中 共价键类型。
O 非极性键
CH 极性键
CO 极性键
H O (H-O-O-H) 非极性键 极性键
NaOH 极性键
5、分子的电子式(共价键)
(1)电子式
H H:H HCI H:Ci:
H O H: :H CH H:H
H
①每个原子一般达到相对稳定结构
②不加中括号[],不标正负电荷数
NH 3H +·N.→H:N:H
H
(3)请写出NH Cl 、Na O 的电
子式
(2)用电子式表示原子形成共价键
H O
CO
(2)结构式
分别用“一、=、=”表示一对、二对和三对共用电子对
H-H H-O-H 0=C=0
HH N三N
H-Cl
[讨论]用化学键的观点分析化学反应过程:
1、用化学键的观点来分析H 与Cl 反应的过程,可以把 它想象为2个步骤:
(1)H 和CI中化学键断裂(旧化学键),生成H
(2)H 和Cl 结合生成HCI, 形成了H和Cl之间的化学键 H-Cl (新化学键)
2、化学反应的本质
化学反应的过程,本质上就是旧化学键的断裂和新化学
键形成的过程。
离子化合物
共价化合物
化学键 离子键或
共价键
离子键与共价键
概念 由 离子键 构成的化合 物叫离子化合物
以 共用电子对 形成
分子的化合物叫共价 化合物
达到稳定 结构的途 径 通过电子得失达到稳定 结构
通过形成共用电子对达 到稳定结构
构成微粒 阴、阳离子
原子
阅读P110 资料卡片:分子间的作用力
【归纳总结】 离子化合物与共价化合物的比较
1、下列说法正确的是( D )
X、含有金属元素的化合物一定是离子化合物如 :AIC l 不、第I A族和第VIA族原子化合时,一定生成离子键
HCl
X、由非金属元素形成的化合物一定不是离子化合物
如 :NH Cl
D 、活泼金属与非金属化合时,能形成离子键
2、下列化合物中只有共价键的是( D )
A .NaCl B.NaOH
C.(NH ) SO D.H SO
3.A 、B 、C 三种短周期元素,其原子序数依次增大,
三种元素的原子序数之和为35,A、C 同 主 族 ,B+ 原 子核外有10个电子。请回答下列问题:
(1)A、B、C 三种元素分别为 氧 钠 (填疏称)
(2)A、B、C 两两之间可形成多种化合物,其中属于离 子化合物的化学式分别为 Na O Na O
(3)用电子式表示B 和C 形成化合物的过程:
第四章物质结构元素周期律
第3节化学键
(1)离子键
苹果能够落在地上,人在地球上生活而不自动脱离地 球,均是因为地球的吸引力,也就是说宏观物质之间 存在力的作用才能够“稳定存在”。
那么化学物质(如: NaCI、HCI、H O 等)能够稳定 存在,构成这些物质的微观粒子之间是不是也存在着 作用力呢
化学键
定义:分子内相邻原子(或离子)之间强烈的相互作 用。
什么是离子键和共价键呢
它们分别是通过什么作用形成物质的呢
离子键
共价键
●●●●●●
化学键
电
不稳定 Na
移
较稳定 Na+
Cr
【宏观辨识与微观探析】 回顾氯化钠的形成
Cl
Cl
转
【证据推理与模型认知】分析离子键的形成
在氯化钠晶体中,Na+ 和Cl-间存在哪些力
Na+和Cl-所带电荷的静电吸引
Na+和Cl-间电子与电子、原子核与原子核间的
相互排斥
当阴阳离子接近到某一定距离时,吸引和排斥作 用达到平衡,阴阳离子间形成稳定的离子键。
一、离子键
1.概念:带相反电荷离子之间的强烈相互作用
2.成键粒子:阴阳离子
3.成键本质:静电作用
(静电吸引和静电排斥的平衡)
哪些物质中存在离子键呢
1、活泼的金属元素和活泼的非金属元素之间的化合物。 (如:Na O(IA、IIA)) (VIA 、VIIA)
2、活泼的金属元素和酸根离子形成的盐 。 (如:NaNO )
3、铵根和酸根离子(或活泼非金属元素)形成的
盐。 如:NH CI,(NH ) SO
4、活 泼 的金属阳离子与OH- 形成的碱 。 ( 如 NaOH)
由 离子键构成的化合物叫做离子化合物。
注意:离子化合物固体不导电,但熔化或溶于水后能导
由
1、具有下列最外层电子数的原子,最难形成离子 的是( B )
A 、L层6个 B 、L层4个
C、M 层2个 D、M 层7个
2、不能形成离子键的是( D )
A、钠和氟 B、镁和溴
C、钙和氧 D 、氯和氧
3、下列各组原子序数所表示的A、B 两种元素,
能形成AB 型含离子的化合物的是( D )
A 、6和8 B 、11和13
C 、11和16 D 、12和17
化学反应中一般是原子的最外层电
子发生变化,所以化学反应中需要表示出 最外层电子的变化,那么用什么来表示
呢
●
二、电子式
在元素符号周围用小黑点 · (或×)来表示原子的最外
层电子的式子
1、原子和离子的电子式:
原子:在元素符号四个方向逐一放置电子
·N Cl
对 k [ci
一般用 [=R:]n- 表示
Na ·
Na
①由阴、阳离子的电子式组成
②相同离子不能合并,同性电荷不直接相邻
2、离子化合物
AB型(如:NaCl)Na[Cx]
A B 型(Na O)
AB 型(MgCl )
(5)用电子式表示由原子形成离子化合物的过程
K×+··+×K —K+[Sak
:Br +×Mgx+·Br:—[:Br]Mg#[Br:
书写要点①左侧写原子的电子式
②用弧形箭头表示电子转移的方向
③中间用 — → 连接
④右侧写离子化合物的电子式
1、写出下列微粒的电子式:
(1)硫原子 (S)、 硫离子 (S -)
(2)溴原子 (Br)、 溴离子 (Br-)
(3)氟原子 (F) 、 氟离子 (F-)
(4)铝原子 (Al)、 铝离子(AI +)
2、写出下列离子化合物的电子式:
氯化钙 [Clx]Ca +[xcir- 氯化钠 Nat [:ci:]
硫化钠 Na+[×S×] -Na+ 氟化钾 K+[×F:]
3、用电子式表示氧化镁和硫化钾的形成过程
Mg·+·O·→Mg +[:O:]2-
2K·十 ·S·→K+[:S:]2-K+
·
4、下列说法正确的是( D )
A. 离子键就是使阴、阳离子结合成化合物的静电引力 B.所有金属与所有非金属原子之间都能形成离子键
C.因为离子键是一种强相互作用,所以离子化合物均很
难分解
D.含有离子键的化合物一定是离子化合物
5.下列物质中属于离子化合物的是( C )
A. 硝酸 B. 氨气 C. 氯化铵 D. 氯化氢
→成键微粒:阳离子和阴离子
→成键本质:静电作用
成键元素:一般是活泼金属 和活泼非金属
→大多数盐:如NaCl 、K SO 等
活泼金属氧化物:如Na O、CaO 等
→概念:由离子键构成的化合物
强碱:如NaOH、KOH等
离 子 键 形 成 离 子 化 合 物
【归纳总结】 离子键和离子化合物
→概念:带相反电荷离子之间的相互作用
常见
类型
成键
要素
第四章物质结构元素周期律
第3节化学键
(2)共价键
活泼的金属元素和活泼非金属元素化合时形
成离子键。请思考,非金属元素之间化合时, 能形成离子键吗 为什么
不能,因非金属元素的原子均有获得电子的倾向。
【思考与交流1】
+1
H
均不容易
失 去e-
CI
形成共用电子对,双 方都达到稳定结构— —共赢
共用电子对偏向 氯,偏离氢
氯化氢的形成
【思考与交流2】氯原子是如何形成氯气分子的
C|. 十 :Cl:Cl:
氯原子最外层有7个电子,不能通过原子间得 失电子达到稳定结构
2个氯原子各提供一个电子,形成共用电子对, 2个氯原子就都形成了8电子稳定结构
一、共价键
1、定 义 :
原子之间通过共用电子对所形成的强烈相互作 用,为共价键。
2、共价键的成键特点
成键微粒:原 子
成键本质:共用电子对
思考
下列物质中含有共价键吗,分别是那些原子间存
在共价键
N CO NaOH NH C
含有共价键的化合物不 一 定是共价化合物
共价化合物:以共用电子对形成分子的化合物。
注意:共价化合物只含有共价键。
3、共价键的存在
(1)共价化合物: 只含有共价键的化合物
HCl 、CO 、NH ..
(2)多原子非金属单质: Cl 、O 、P ..
(3)含根的离子化合物: NaOH 、Na O 、 NH Cl 、NH NO
含有共价键的化合物不一定是共价化合物
化学键和化合物关系的“三个一定”和“三个可能”
(1)“三个一定”
①离子化合物中一定含离子键;
②含离子键的一定是离子化合物;
③共价化合物中一定不含离子键。
(2)“三个可能”
①离子化合物中可能含有共价键,如NaOH;
②金属与非金属形成的化合物可能是共价化合物,如AICl ;
③完全由非金属形成的化合物可能是离子化合物,如N H Cl。
4、共价键的分类
非极性键:共用电子对不发生偏移 成键元素相同
极性键:共用电子对偏向某一方 成键元素不同
H:H H:Cl:
电子 对不
偏移
电子 对偏 向CI
十
下列物质中是否存在共价键 如果有并指明其中 共价键类型。
O 非极性键
CH 极性键
CO 极性键
H O (H-O-O-H) 非极性键 极性键
NaOH 极性键
5、分子的电子式(共价键)
(1)电子式
H H:H HCI H:Ci:
H O H: :H CH H:H
H
①每个原子一般达到相对稳定结构
②不加中括号[],不标正负电荷数
NH 3H +·N.→H:N:H
H
(3)请写出NH Cl 、Na O 的电
子式
(2)用电子式表示原子形成共价键
H O
CO
(2)结构式
分别用“一、=、=”表示一对、二对和三对共用电子对
H-H H-O-H 0=C=0
HH N三N
H-Cl
[讨论]用化学键的观点分析化学反应过程:
1、用化学键的观点来分析H 与Cl 反应的过程,可以把 它想象为2个步骤:
(1)H 和CI中化学键断裂(旧化学键),生成H
(2)H 和Cl 结合生成HCI, 形成了H和Cl之间的化学键 H-Cl (新化学键)
2、化学反应的本质
化学反应的过程,本质上就是旧化学键的断裂和新化学
键形成的过程。
离子化合物
共价化合物
化学键 离子键或
共价键
离子键与共价键
概念 由 离子键 构成的化合 物叫离子化合物
以 共用电子对 形成
分子的化合物叫共价 化合物
达到稳定 结构的途 径 通过电子得失达到稳定 结构
通过形成共用电子对达 到稳定结构
构成微粒 阴、阳离子
原子
阅读P110 资料卡片:分子间的作用力
【归纳总结】 离子化合物与共价化合物的比较
1、下列说法正确的是( D )
X、含有金属元素的化合物一定是离子化合物如 :AIC l 不、第I A族和第VIA族原子化合时,一定生成离子键
HCl
X、由非金属元素形成的化合物一定不是离子化合物
如 :NH Cl
D 、活泼金属与非金属化合时,能形成离子键
2、下列化合物中只有共价键的是( D )
A .NaCl B.NaOH
C.(NH ) SO D.H SO
3.A 、B 、C 三种短周期元素,其原子序数依次增大,
三种元素的原子序数之和为35,A、C 同 主 族 ,B+ 原 子核外有10个电子。请回答下列问题:
(1)A、B、C 三种元素分别为 氧 钠 (填疏称)
(2)A、B、C 两两之间可形成多种化合物,其中属于离 子化合物的化学式分别为 Na O Na O
(3)用电子式表示B 和C 形成化合物的过程:
