铁单质+高一上学期化学人教版(2019)必修第一册(共28张PPT)
文档属性
| 名称 | 铁单质+高一上学期化学人教版(2019)必修第一册(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-24 19:58:38 | ||
图片预览








文档简介
(共28张PPT)
第三章铁金属材料
第一节铁及其化合物
3.1.1铁
学习目标
1、了 解铁在自然界中的存在形态及冶炼方法
2、掌握铁的物理性质和化学性质
1、人类历史使用工具的顺序是石器→青铜器→铁器(铁单 质)→铝器等等,同学们在初中就已经知道,铁的性质比 较活泼,在自然界以化合态的形式存在,那个时候的人类 手中的铁器最开始是从哪里来的了
思考
(1)铁元素是地壳主要组成成分之一。铁在地壳中的含量仅次于氧、硅、 铝、居第4 位。主 要以化合物的形式存在,在化合物中铁元素的化合价主 要有+2 和+3 价。
【注意】
常见铁矿石:磁铁矿(Fe O ) 、 赤铁矿(Fe O ) 、 菱铁矿(FeCO ) 、黄铁 矿(FeS )
(3)陨铁是自然界中铁元素的单质形态。人类最早使用的铁,是来自太
一、铁元素的存在及冶炼
1、铁元素在自然界的存在形态
游离态和化合态(主)均有
内蒙古磁铁矿 陨铁
空的陨铁。
短柄铁剑,这说明春秋初年我国已掌握了冶铁技术。战国中期以后,
铁制工具在社会生产中发挥了巨大的作用。现代工业炼铁的原理是用 还原的方法把铁从铁矿中提炼出来。
我国目前发现最早的人工冶铁制品是甘肃灵台出图的春秋初年秦国的
2、铁的冶炼
战国时期最大的铁器——长方形铁炉
料 钟 调 控 阀
小 料
炉 煤
炉
大 料
~200℃
大 料
~5000
炉 身
炉 身
时 火
-~8000
炉 体
炉 腰
环 炉
炉 腹
~1800℃
出 铁 口
炉 缸
900~1000℃
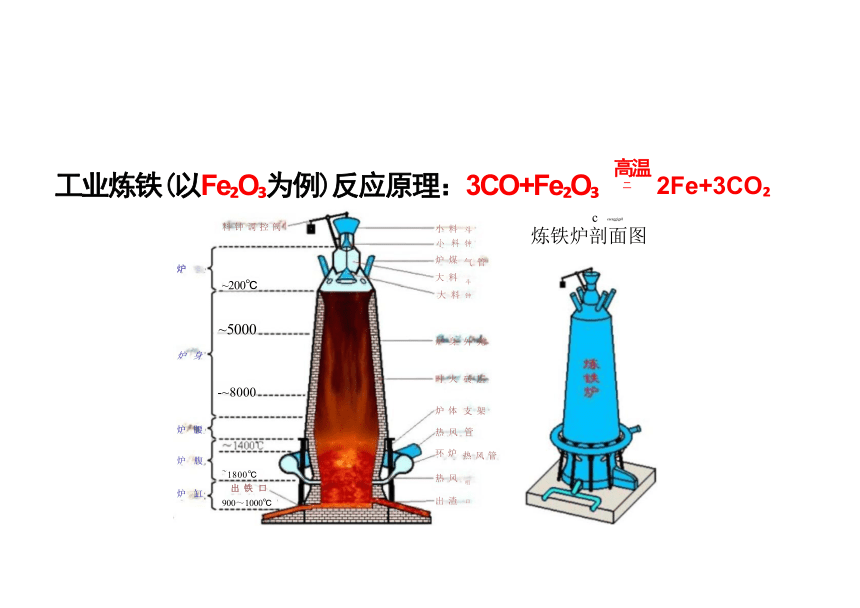
工业炼铁(以Fe O 为例)反应原理:3CO+Fe O
c esesggigs8
炼铁炉剖面图
2Fe+3CO
支 架
管
热 风 管
高温
二
热 风
出 渣
咀 口
斗 钟
斗 钟
热 风
气 管
砖 层
外 光
小 料
铁是一种有金属光泽的银白色金属,有良好的导热性和延展性。铁能导
电,但其导电性不如铜和铝。密度是7.68g·cm-3, 熔点是1535℃,
沸点是2750℃,粉末为黑色。铁属于重金属、黑色金属、常见金属。
铁能被磁铁吸 引
二 .铁单质的性质
1、铁单质的物理性质
2、为什么铁片是银白色,而铁粉却是黑色
金属小颗粒能反射光线。而小颗粒的分布是非常混乱的,所 以不能像镜面一样把入射光线定向地反射回去。入射光线进 到金属小颗粒中,就像进了“迷魂阵”,从一个小颗粒反射 到另一个颗粒,这样反射过来又反射回去,光线越来越弱, 很少按入射方向返回去,因此看上去是黑色的。
思考
2.铁的化学性质
(1)铁原子结构特点
失去3e- 失去2e-
+26 813 +26 142 426 14
Fe3+ Fe Fe2+
铁是较活泼的金属,很容易失去电子,有比较强的还原性,发生化 学反应时可生成+2、+3两种价态的化合物,且Fe + 比Fe2+稳定。
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反 应
【几点强调】
① 铁与氧化性较弱的 氧化剂(如:盐酸、硫酸铜溶液、S ,,Fe 3+ 等 )反应,铁原子失去2个电子生成+2价铁的化合物(Fe -2e=Fe +)
②铁与氧化性较强的氧化剂(如:氯气、硝酸、Br2, 浓硫酸等)反应 ,铁原子则失去3个电子生成+3价铁的化合物(Fe -3el =Fe +)
③铁在纯氧中燃烧得到产物为Fe O4 。
④铁与稀硝酸反应的产物可能为Fe2+或Fe 3 ,还可能都有。
现象 :剧烈燃烧、火星四射、放出大量的热、生成黑色固体
②Fe在氯气中燃烧
Fe+Cl 点燃FeCl
现象:剧烈燃烧、产生棕褐色的烟
①Fe与O 的反应 ③Fe与硫的反应
点燃
3Fe +4O =Fe O Fe+S△ FeS
(2)Fe与非金属反应
①与非氧化性酸 (如 :稀盐酸、稀硫酸)的反应
Fe+2HCl=FeCl +H 个 Fe+2H+=Fe ++H 个 现象:产生气泡,放出热量,生成浅绿色的溶液
② 与氧化性酸 (如 :硝酸、浓硫酸)的反应
【注意】常温下,铁遇冷的浓硫酸、浓硝酸产生钝化现象,即:浓硫 、浓硝酸将铁的表面氧化成一层致密的氧化物薄膜,这层薄膜阻止了 酸与内层金属的进一步反应。但在加热的条件下铁可以和浓硫酸、浓
硝酸反应
(3)Fe与酸的反应
a.少量的铁与稀硝酸反应:
Fe(少量)+4HNO (稀)=Fe(NO )s+NOT+2H O
生成的Fe(NO ) 可以和铁继续反应:
Fe+2Fe(NO )g=3Fe(NO )
b.过量的铁与稀硝酸反应:
3Fe(过量)+8HNO (稀)=3Fe(NO )z+2NO 个+4H O
c.少量的铁与浓硝酸共热:
Fe+6HNO (浓)=Fe(NO ) +3NOz↑+3H O
Fe(少量)+4HNO (稀)=Fe(NO ) +NO 个+2H O
现象:有红色物质生成,溶液逐渐变为浅绿色
②与FeCl 溶液反应
Fe+2FeCl =3FeCl Fe+2Fe +=3Fe +
现象:溶液逐渐由黄色变为浅绿色
(4)与盐溶液反应:
①与CuSO 溶液反应
Fe+CuSO =Cu +FeSO
Fe+Cu2+=Fe2++Cu
化学性质
化学方程式举例
与非金属单质 反应
3Fe+4O 点Fe O Fe +Cl 点FeCl Fe+s AFeS
与(非)氧化性酸 反应
Fe+2HCl=FeCl +H 个
Fe(少量)+4HNO (稀)=Fe(NO ) +NO个+2H O
与盐溶液反应
Fe+CuSO =Cu+FeSO Fe+2FeCl =3FeCl
Fe在反应中作还原剂,遇到较强的氧化剂(如Cl 等)生成+3 价铁的化 合物,遇到较弱的氧化剂(如稀硫酸等)生成+2 价铁的化合物。
【练一练】
1、下列叙述正确的是( C )
A. 纯铁为灰黑色,所以铁属于黑色金属
B. 铁在硫蒸气中燃烧生成Fe S
C. 纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化
D. 足量的铁在氯气中燃烧生成FeCl 和FeCl
2、下列有关铁及其化合物的说法中不正确的是( D )
A. 工业上在高温下用CO 还原含Fe O 的铁矿石炼铁
B. 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe O
C. 工业上可用铁制容器储存、运输浓硝酸、浓硫酸
D. 氯化铁溶液有较强氧化性,故可用作净水剂
3、在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模 具必须进行充分的干燥处理。这是为什么呢
思考
实验现象:肥皂液产生肥皂泡,把燃着的火柴靠近,有爆鸣声,稍后 有肥皂泡飘到空中,证明生成了H 。
3Fe +4H O(g) 燃 Fe O +4H 不打气体符号
4、下图装置用来探究铁与水蒸气的反应,请回答下列问题:
①上述实验装置中,湿棉花的作用是什么
②还原铁粉处酒精灯为什么配用金属套筒
③A,B 两处酒精灯的作用
①受热时提供反应所需的水蒸气
②聚集火焰,提高温度
③A处酒精灯处提供反应需要的水蒸气;B处酒精灯提供反 应需要的“高温”条件;
思考
水蒸气与铁
粉反应装置
产物收水蒸气的 集装置发生装置
5、装置可以有哪些改进点
①改变水蒸气的生成方式
②氢气的收集方式。如下图:
思考
6、下图的酒精灯放在湿棉花下面加热,效果会不会更好
思考
还原铁粉
【几点强调】
①铁与水蒸气的反应实验中,湿棉花的作用是加热时可产生水蒸气,
与铁粉反应生成氢气
②铁与水蒸气反应,日常生活中能用铁壶烧水是因为铁只能在高温下
与 水 蒸 气 反 应 , 与 冷 水 、 热 水 都 不 能 反 应
③常温下,铁与水不起反应,但在水和空气里的O 等共同作用下,铁 易被腐蚀
④验证固体是否是四氧化三铁方法:试管冷却后,利用磁铁在试管外 侧吸一吸。若固体被吸引,证明固体是四氧化三铁(如果铁有剩,则此 法不成立 )。
⑤酒精灯上加防风罩可以保证集中加热,以达到较高的反应温度;肥 皂液在该实验中可以起到些收集”氢气的作用。
3、金属与水的反应规律
K 、Ca 、Na、Mg、Al, Zn、Fe 、Sn 、Pb 、 (H) 、Cu 、Hg 、Ag 、Pt 、Au 冷H O 热H O 水蒸气
3、金属与水的反应规律
(1)K、Ca、Na等可以和冷水作用,生成可溶性碱和氢气。
(2)Mg、A 很难与冷水反应,但是可与沸水迅速反应,生成难溶性 碱和氢气。
(3)Zn、Fe、Sn、Pb 要和高温水蒸气反 应 ,生成不溶性氧化物和氢 气。
(4)Cu、Hg、Ag、Pt、Au则不与水作用。
K、Ca、Na、Mg、AI,Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
冷H O 热H O 水蒸气 与水不反应
金属活动性顺序表中,金属越活泼,越容易与水反应,反应越剧烈。
铁在人体中的含量为4~5g, 是人体必需微量元素中含量最多的一种。
功能性铁 参与氧的运输
人体内的含铁化合物
储存铁 与一些酶结合
缺铁会造成 记忆力、免疫力、对温度适应力下降、贫血
资料卡片
人体中的铁元素
【练一练】
3、判断正误
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质(×)
(2)氯化亚铁既可由铁与盐酸反应制取也可由铁与氯气化合制取(×)
(3)由于钠与水反应生成NaOH 和H , 所以铁与水蒸气反应生成
Fe(OH) 和H (×)
【练一练】
4、某化学兴趣小组利用如图装置(铁架台及夹持装置已省略)进行 “铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是产生水蒸气 碱石灰 烧瓶底部放碎瓷片的作用是防止加热时液体暴沸
(2)写出装置B中发生反应的化学
方程式:3Fe+4H O(g), 高温 Fe O +4H
该反应中氧化剂是 H O ,
氧化产物是 Fe O 。
(3)D 的作用是吸收未反应的水蒸气,干燥H
(4)E中的实验现象是黑色固体变成红色,玻璃管内壁上有水珠生成
(5)A、B 两个装置中应先点燃 A 处的酒精灯(或酒精喷灯),点燃E 处酒精灯之前应进行的操作是收集H 并检验其纯度
第三章铁金属材料
第一节铁及其化合物
3.1.1铁
学习目标
1、了 解铁在自然界中的存在形态及冶炼方法
2、掌握铁的物理性质和化学性质
1、人类历史使用工具的顺序是石器→青铜器→铁器(铁单 质)→铝器等等,同学们在初中就已经知道,铁的性质比 较活泼,在自然界以化合态的形式存在,那个时候的人类 手中的铁器最开始是从哪里来的了
思考
(1)铁元素是地壳主要组成成分之一。铁在地壳中的含量仅次于氧、硅、 铝、居第4 位。主 要以化合物的形式存在,在化合物中铁元素的化合价主 要有+2 和+3 价。
【注意】
常见铁矿石:磁铁矿(Fe O ) 、 赤铁矿(Fe O ) 、 菱铁矿(FeCO ) 、黄铁 矿(FeS )
(3)陨铁是自然界中铁元素的单质形态。人类最早使用的铁,是来自太
一、铁元素的存在及冶炼
1、铁元素在自然界的存在形态
游离态和化合态(主)均有
内蒙古磁铁矿 陨铁
空的陨铁。
短柄铁剑,这说明春秋初年我国已掌握了冶铁技术。战国中期以后,
铁制工具在社会生产中发挥了巨大的作用。现代工业炼铁的原理是用 还原的方法把铁从铁矿中提炼出来。
我国目前发现最早的人工冶铁制品是甘肃灵台出图的春秋初年秦国的
2、铁的冶炼
战国时期最大的铁器——长方形铁炉
料 钟 调 控 阀
小 料
炉 煤
炉
大 料
~200℃
大 料
~5000
炉 身
炉 身
时 火
-~8000
炉 体
炉 腰
环 炉
炉 腹
~1800℃
出 铁 口
炉 缸
900~1000℃
工业炼铁(以Fe O 为例)反应原理:3CO+Fe O
c esesggigs8
炼铁炉剖面图
2Fe+3CO
支 架
管
热 风 管
高温
二
热 风
出 渣
咀 口
斗 钟
斗 钟
热 风
气 管
砖 层
外 光
小 料
铁是一种有金属光泽的银白色金属,有良好的导热性和延展性。铁能导
电,但其导电性不如铜和铝。密度是7.68g·cm-3, 熔点是1535℃,
沸点是2750℃,粉末为黑色。铁属于重金属、黑色金属、常见金属。
铁能被磁铁吸 引
二 .铁单质的性质
1、铁单质的物理性质
2、为什么铁片是银白色,而铁粉却是黑色
金属小颗粒能反射光线。而小颗粒的分布是非常混乱的,所 以不能像镜面一样把入射光线定向地反射回去。入射光线进 到金属小颗粒中,就像进了“迷魂阵”,从一个小颗粒反射 到另一个颗粒,这样反射过来又反射回去,光线越来越弱, 很少按入射方向返回去,因此看上去是黑色的。
思考
2.铁的化学性质
(1)铁原子结构特点
失去3e- 失去2e-
+26 813 +26 142 426 14
Fe3+ Fe Fe2+
铁是较活泼的金属,很容易失去电子,有比较强的还原性,发生化 学反应时可生成+2、+3两种价态的化合物,且Fe + 比Fe2+稳定。
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反 应
【几点强调】
① 铁与氧化性较弱的 氧化剂(如:盐酸、硫酸铜溶液、S ,,Fe 3+ 等 )反应,铁原子失去2个电子生成+2价铁的化合物(Fe -2e=Fe +)
②铁与氧化性较强的氧化剂(如:氯气、硝酸、Br2, 浓硫酸等)反应 ,铁原子则失去3个电子生成+3价铁的化合物(Fe -3el =Fe +)
③铁在纯氧中燃烧得到产物为Fe O4 。
④铁与稀硝酸反应的产物可能为Fe2+或Fe 3 ,还可能都有。
现象 :剧烈燃烧、火星四射、放出大量的热、生成黑色固体
②Fe在氯气中燃烧
Fe+Cl 点燃FeCl
现象:剧烈燃烧、产生棕褐色的烟
①Fe与O 的反应 ③Fe与硫的反应
点燃
3Fe +4O =Fe O Fe+S△ FeS
(2)Fe与非金属反应
①与非氧化性酸 (如 :稀盐酸、稀硫酸)的反应
Fe+2HCl=FeCl +H 个 Fe+2H+=Fe ++H 个 现象:产生气泡,放出热量,生成浅绿色的溶液
② 与氧化性酸 (如 :硝酸、浓硫酸)的反应
【注意】常温下,铁遇冷的浓硫酸、浓硝酸产生钝化现象,即:浓硫 、浓硝酸将铁的表面氧化成一层致密的氧化物薄膜,这层薄膜阻止了 酸与内层金属的进一步反应。但在加热的条件下铁可以和浓硫酸、浓
硝酸反应
(3)Fe与酸的反应
a.少量的铁与稀硝酸反应:
Fe(少量)+4HNO (稀)=Fe(NO )s+NOT+2H O
生成的Fe(NO ) 可以和铁继续反应:
Fe+2Fe(NO )g=3Fe(NO )
b.过量的铁与稀硝酸反应:
3Fe(过量)+8HNO (稀)=3Fe(NO )z+2NO 个+4H O
c.少量的铁与浓硝酸共热:
Fe+6HNO (浓)=Fe(NO ) +3NOz↑+3H O
Fe(少量)+4HNO (稀)=Fe(NO ) +NO 个+2H O
现象:有红色物质生成,溶液逐渐变为浅绿色
②与FeCl 溶液反应
Fe+2FeCl =3FeCl Fe+2Fe +=3Fe +
现象:溶液逐渐由黄色变为浅绿色
(4)与盐溶液反应:
①与CuSO 溶液反应
Fe+CuSO =Cu +FeSO
Fe+Cu2+=Fe2++Cu
化学性质
化学方程式举例
与非金属单质 反应
3Fe+4O 点Fe O Fe +Cl 点FeCl Fe+s AFeS
与(非)氧化性酸 反应
Fe+2HCl=FeCl +H 个
Fe(少量)+4HNO (稀)=Fe(NO ) +NO个+2H O
与盐溶液反应
Fe+CuSO =Cu+FeSO Fe+2FeCl =3FeCl
Fe在反应中作还原剂,遇到较强的氧化剂(如Cl 等)生成+3 价铁的化 合物,遇到较弱的氧化剂(如稀硫酸等)生成+2 价铁的化合物。
【练一练】
1、下列叙述正确的是( C )
A. 纯铁为灰黑色,所以铁属于黑色金属
B. 铁在硫蒸气中燃烧生成Fe S
C. 纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化
D. 足量的铁在氯气中燃烧生成FeCl 和FeCl
2、下列有关铁及其化合物的说法中不正确的是( D )
A. 工业上在高温下用CO 还原含Fe O 的铁矿石炼铁
B. 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe O
C. 工业上可用铁制容器储存、运输浓硝酸、浓硫酸
D. 氯化铁溶液有较强氧化性,故可用作净水剂
3、在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模 具必须进行充分的干燥处理。这是为什么呢
思考
实验现象:肥皂液产生肥皂泡,把燃着的火柴靠近,有爆鸣声,稍后 有肥皂泡飘到空中,证明生成了H 。
3Fe +4H O(g) 燃 Fe O +4H 不打气体符号
4、下图装置用来探究铁与水蒸气的反应,请回答下列问题:
①上述实验装置中,湿棉花的作用是什么
②还原铁粉处酒精灯为什么配用金属套筒
③A,B 两处酒精灯的作用
①受热时提供反应所需的水蒸气
②聚集火焰,提高温度
③A处酒精灯处提供反应需要的水蒸气;B处酒精灯提供反 应需要的“高温”条件;
思考
水蒸气与铁
粉反应装置
产物收水蒸气的 集装置发生装置
5、装置可以有哪些改进点
①改变水蒸气的生成方式
②氢气的收集方式。如下图:
思考
6、下图的酒精灯放在湿棉花下面加热,效果会不会更好
思考
还原铁粉
【几点强调】
①铁与水蒸气的反应实验中,湿棉花的作用是加热时可产生水蒸气,
与铁粉反应生成氢气
②铁与水蒸气反应,日常生活中能用铁壶烧水是因为铁只能在高温下
与 水 蒸 气 反 应 , 与 冷 水 、 热 水 都 不 能 反 应
③常温下,铁与水不起反应,但在水和空气里的O 等共同作用下,铁 易被腐蚀
④验证固体是否是四氧化三铁方法:试管冷却后,利用磁铁在试管外 侧吸一吸。若固体被吸引,证明固体是四氧化三铁(如果铁有剩,则此 法不成立 )。
⑤酒精灯上加防风罩可以保证集中加热,以达到较高的反应温度;肥 皂液在该实验中可以起到些收集”氢气的作用。
3、金属与水的反应规律
K 、Ca 、Na、Mg、Al, Zn、Fe 、Sn 、Pb 、 (H) 、Cu 、Hg 、Ag 、Pt 、Au 冷H O 热H O 水蒸气
3、金属与水的反应规律
(1)K、Ca、Na等可以和冷水作用,生成可溶性碱和氢气。
(2)Mg、A 很难与冷水反应,但是可与沸水迅速反应,生成难溶性 碱和氢气。
(3)Zn、Fe、Sn、Pb 要和高温水蒸气反 应 ,生成不溶性氧化物和氢 气。
(4)Cu、Hg、Ag、Pt、Au则不与水作用。
K、Ca、Na、Mg、AI,Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
冷H O 热H O 水蒸气 与水不反应
金属活动性顺序表中,金属越活泼,越容易与水反应,反应越剧烈。
铁在人体中的含量为4~5g, 是人体必需微量元素中含量最多的一种。
功能性铁 参与氧的运输
人体内的含铁化合物
储存铁 与一些酶结合
缺铁会造成 记忆力、免疫力、对温度适应力下降、贫血
资料卡片
人体中的铁元素
【练一练】
3、判断正误
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质(×)
(2)氯化亚铁既可由铁与盐酸反应制取也可由铁与氯气化合制取(×)
(3)由于钠与水反应生成NaOH 和H , 所以铁与水蒸气反应生成
Fe(OH) 和H (×)
【练一练】
4、某化学兴趣小组利用如图装置(铁架台及夹持装置已省略)进行 “铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是产生水蒸气 碱石灰 烧瓶底部放碎瓷片的作用是防止加热时液体暴沸
(2)写出装置B中发生反应的化学
方程式:3Fe+4H O(g), 高温 Fe O +4H
该反应中氧化剂是 H O ,
氧化产物是 Fe O 。
(3)D 的作用是吸收未反应的水蒸气,干燥H
(4)E中的实验现象是黑色固体变成红色,玻璃管内壁上有水珠生成
(5)A、B 两个装置中应先点燃 A 处的酒精灯(或酒精喷灯),点燃E 处酒精灯之前应进行的操作是收集H 并检验其纯度
