铁单质高一上学期化学人教版(2019)必修第一册(共23张PPT)
文档属性
| 名称 | 铁单质高一上学期化学人教版(2019)必修第一册(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-24 20:18:36 | ||
图片预览








文档简介
(共23张PPT)
第三章铁金属材料
第一节铁及其化合物
第1课时铁单质
4.掌握铁的冶炼方法、铁元素在人体中存在形态和 作用。
3.了解掌握铁单质的物理化学性质。
1.了解在人类社会发展中的对铁制工具的应用历史。
2.了解掌握铁在自然界的存在形态,结构特征。
石 陶 青铜 铁 钢与合金高分子 半导体 划时代的新材料
历史上,材料被视为人类社会进化的里程碑。历史学家也把材料及其 工具作为划分时代的标志;如石器时代、青铜器时代、铁器时代等。
为什么在公元前2000年前人类就能够开始大量使用铁器
时至今日,铁仍然是人类使用量最大的金属材料,这表明了铁怎样的性质特点
石器时代 青铜器时代 铁器时代蒸汽时代电气时代信息时代智能时代
新课引入:人类社会的发展过程
一、铁单质
1.铁元素在自然界中的存在形式
(1)游离态: 太空的陨铁
一、铁单质
1.铁元素在自然界中的存在形式
(1)游离态:太空的陨铁
(2)化合态:主要以+2价、+3价化合物的形态存在于矿石中
赤铁矿Fe O 菱铁矿FeCO 磁铁矿Fe O 黄铁矿FeS
一、铁单质
1.铁元素在自然界中的存在形式
(1)游离态:太空的陨铁
(2)化合态:主要以+2价、+3价化合物的形态存在于矿石中
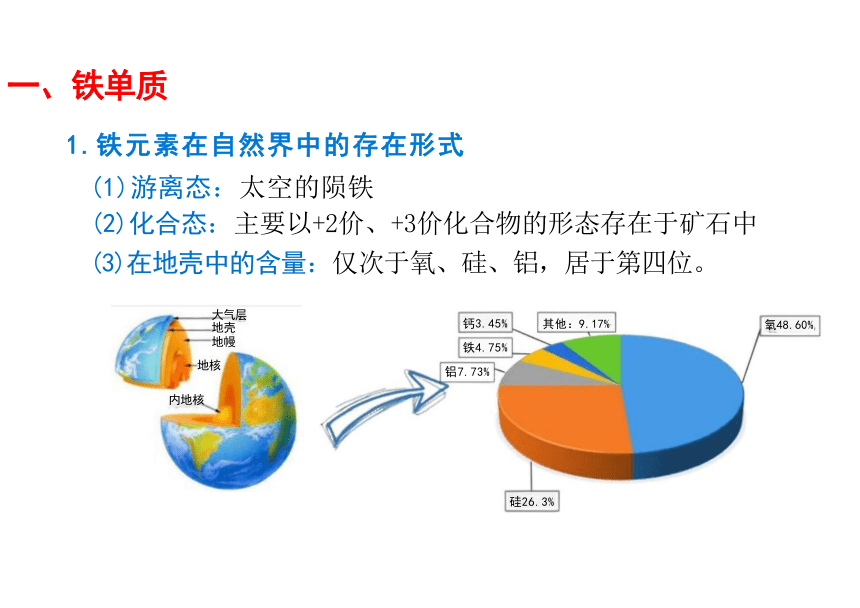
(3)在地壳中的含量:仅次于氧、硅、铝,居于第四位。
大气层 地壳 地幔 地核 钙3.45% 铁4.75% 铝7.73%
其他:9.17% 氧48.60%
内地核
硅26.3%
一、铁单质
2.铁元素在元素周期表中的位置、铁单质的物理性质
(1)在元素周期表中的位置:第四周期第VⅢ族
(2)我国最早发现:西周晚期已经掌握了冶铁技术
一、铁单质
2 .铁元素在元素周期表中的位置、铁单质的物理性质
(1)在元素周期表中的位置:第四周期第VⅢ族
(2)我国最早发现:西周晚期已经掌握了冶铁技术 (3)铁单质的物理性质:
观察下列铁制品,并结合生活经验,总结铁单质的物理性质
一、铁单质
2.铁元素在元素周期表中的位置、铁单质的物理性质
(1)在元素周期表中的位置:第四周期第 族
(2)我国最早发现: 西周晚期已经掌握了冶铁技术
(3)铁单质的物理性质:
①熔点1535℃,沸点2750℃。密度7.86g/cm
②有延展性和导热性
③具有导电性,导电性:Ag>Cu>Al>Fe
④能被磁铁吸引
一 、铁单质
3.铁单质的化学性质
铁的化学性质活泼,能与许多物质发生化学反应,表现较强 的还原性。常见价态有0价、+2价、+3价,也有+6价。
(1)与非金属单质反应(表现还原性):
①与O 反应: 常温下4Fe+3O =2Fe O (铁的生锈)
(在纯氧中剧烈燃烧, 发出耀眼的光,火星四溅,放出大量的热)
(1)与非金属单质反应(表现还原性):
①与O 反应: 常温下4Fe+3O =2Fe O (铁的生锈)
(在纯氧中剧烈燃烧, 发出耀眼的光,火星四溅,放出大量的热)
②与S反应: Fe+S—FeS (黑色固体,不溶于水)
(1)与非金属单质反应(表现还原性):
①与O 反应: 常温下4Fe+3O =2Fe O (铁的生锈)
(在纯氧中剧烈燃烧, 发出耀眼的光,火星四溅,放出大量的热)
②与S反应:] (黑色固体,不溶于水)
③与Cl 反应: (剧烈燃烧,产生棕褐色的烟)
(1)与非金属单质反应(表现还原性):
①与O 反应: 常温下4Fe+30 =2Fe O (铁的生锈)
(在纯氧中剧烈燃烧, 发出耀眼的光,火星四溅,放出大量的热)
②与S反应: (黑色固体,不溶于水)
③与Cl 反应: (剧烈燃烧,产生棕褐色的烟)
④与Br 反应:2Fe ( 少 量 ) + 3Br —2FeBr
⑤与I 反 应 :
【微点拨】①铁与非金属单质的反应体现了铁单质的还原性
②无论Fe过量还是不足,都只能生成FeCl
③常温下,Fe与Cl 不反应,可以用钢瓶保存液氯, 但要把钢瓶置于干燥阴凉处
(2)与非氧化性酸反应(与稀盐酸、稀硫酸反应,Fe表现还原性)
① 与稀盐酸反应: Fe+2HCl=FeCl +H 个
②与稀硫酸反应: Fe+H SO =FeSO +H 个
(3)与氧化性酸反应(与硝酸、浓硫酸反应)
①Fe 不足时:Fe+4HNO (稀)= Fe(NO ) +NO 个+2H O
②Fe过量时:3Fe+8HNO (稀)=3Fe(NO ) +2NO 个+4H O
③与浓硝酸、浓硫酸:钝化作用(化学变化)
在常温时,Fe 的表面会被浓硝酸、浓硫酸氧化形成一层致密的氧化物薄 膜,氧化物薄膜隔绝了内层金属与浓硝酸、浓硫酸的接触,即钝化作用。
【微点拨】
在加热的条件下,浓硝酸、浓硫酸能破坏氧化物薄膜,使内层金属与 浓硝酸、浓硫酸继续反应。
(4)与盐反应
①与硫酸铜溶液反应:Fe+CuSO =FeSO +Cu
②与氯化铁溶液反应:Fe+2FeCl =3FeCl
(5)与水蒸气反应
思考:常温下,铁与水不反应,但铸铁的时候为什么不能将高温铁水倒入含有水的模具
(4)与盐反应
①与硫酸铜溶液反应: Fe+CuSO =FeSO +Cu
②与氯化铁溶液反应: Fe+2FeCl =3FeCl
(5)与水蒸气反应
酒精灯加金属网罩的目的
湿棉花的作用是受热时
提供反应所需的水蒸气 用燃着的火柴点燃肥皂泡,听
到爆鸣声,证明生成了氢气
思考:如何证
铁粉与水蒸气的反应实验装置
实验结论:在高温下,铁能与水蒸气反应生成H 化学方程式:3 Fe+4H O(g) 高温Fe O +4H
明生成的黑色 固体是Fe O
【微点拨】铁与水蒸气的反应实验注意事项
①反应条件:铁与冷水、热水不能反应,只能与水蒸气在高温下反应。
②反应产物:Fe O 和 H , 不是Fe O 。
③反应实质:与Na、Mg 一样,都是置换出水电离产生的H+, 但不能得到 铁的氢氧化物,因为在高温下铁的氢氧化物会分解为铁的氧化物和水。
④在钢铁生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分 的干燥处理,不得留有水。
组成血红蛋白,参与氧的运输
人体内的含铁化合物
与一些酶结合,分布于身体各器官
缺铁会造成 记忆力、免疫力、对温度适应力下降、缺铁性贫血
高炉炼铁:Fe O +3CO 高温2Fe+3CO
5.人体中的铁元素
铁在人体中的含量为4~5g, 是人体必需微量元素中含量最多的一种。
一、铁的单质
工业炼铁的原理是用还原的方法把铁从铁矿石中
4.铁的冶炼
提炼出来。你还记得炼铁高炉内发生的化学反应吗
功能性铁
储存铁
【对点训练1】
1. 下列关于铁的叙述中错误的是 ( C )
A. 纯净的铁是光亮的银白色金属
B. 铁能被磁体吸引
C. 铁是地壳中含量最多的金属元素
D. 铁具有延展性和导热性,可制作炊具
【对点训练1】
2.Fe 与非金属单质反应
(1)与O 反应点燃(化学方程式): 3Fe+2O 点燃Fe O __ ;
现象:剧烈燃烧,火星四射。
常温:铁在潮湿的空气中易被腐蚀,生成铁锈,其主要成分为
Fe O ·xH O。
(2)与Cl 反应(化学方程式): 2Fe+3Cl —2FeCl
;
现象:剧烈燃烧,棕褐色烟。
注意:铁在氯气中燃烧,只生成FeCl , 与反应物量比无关。
(3)与S反应(化学方程式) :Fe+S—FeS
铁元素的存在及使用
铁的物理性质
铁的化学性质
第一节
铁及其化合物
第1课时
铁单质
第三章铁金属材料
第一节铁及其化合物
第1课时铁单质
4.掌握铁的冶炼方法、铁元素在人体中存在形态和 作用。
3.了解掌握铁单质的物理化学性质。
1.了解在人类社会发展中的对铁制工具的应用历史。
2.了解掌握铁在自然界的存在形态,结构特征。
石 陶 青铜 铁 钢与合金高分子 半导体 划时代的新材料
历史上,材料被视为人类社会进化的里程碑。历史学家也把材料及其 工具作为划分时代的标志;如石器时代、青铜器时代、铁器时代等。
为什么在公元前2000年前人类就能够开始大量使用铁器
时至今日,铁仍然是人类使用量最大的金属材料,这表明了铁怎样的性质特点
石器时代 青铜器时代 铁器时代蒸汽时代电气时代信息时代智能时代
新课引入:人类社会的发展过程
一、铁单质
1.铁元素在自然界中的存在形式
(1)游离态: 太空的陨铁
一、铁单质
1.铁元素在自然界中的存在形式
(1)游离态:太空的陨铁
(2)化合态:主要以+2价、+3价化合物的形态存在于矿石中
赤铁矿Fe O 菱铁矿FeCO 磁铁矿Fe O 黄铁矿FeS
一、铁单质
1.铁元素在自然界中的存在形式
(1)游离态:太空的陨铁
(2)化合态:主要以+2价、+3价化合物的形态存在于矿石中
(3)在地壳中的含量:仅次于氧、硅、铝,居于第四位。
大气层 地壳 地幔 地核 钙3.45% 铁4.75% 铝7.73%
其他:9.17% 氧48.60%
内地核
硅26.3%
一、铁单质
2.铁元素在元素周期表中的位置、铁单质的物理性质
(1)在元素周期表中的位置:第四周期第VⅢ族
(2)我国最早发现:西周晚期已经掌握了冶铁技术
一、铁单质
2 .铁元素在元素周期表中的位置、铁单质的物理性质
(1)在元素周期表中的位置:第四周期第VⅢ族
(2)我国最早发现:西周晚期已经掌握了冶铁技术 (3)铁单质的物理性质:
观察下列铁制品,并结合生活经验,总结铁单质的物理性质
一、铁单质
2.铁元素在元素周期表中的位置、铁单质的物理性质
(1)在元素周期表中的位置:第四周期第 族
(2)我国最早发现: 西周晚期已经掌握了冶铁技术
(3)铁单质的物理性质:
①熔点1535℃,沸点2750℃。密度7.86g/cm
②有延展性和导热性
③具有导电性,导电性:Ag>Cu>Al>Fe
④能被磁铁吸引
一 、铁单质
3.铁单质的化学性质
铁的化学性质活泼,能与许多物质发生化学反应,表现较强 的还原性。常见价态有0价、+2价、+3价,也有+6价。
(1)与非金属单质反应(表现还原性):
①与O 反应: 常温下4Fe+3O =2Fe O (铁的生锈)
(在纯氧中剧烈燃烧, 发出耀眼的光,火星四溅,放出大量的热)
(1)与非金属单质反应(表现还原性):
①与O 反应: 常温下4Fe+3O =2Fe O (铁的生锈)
(在纯氧中剧烈燃烧, 发出耀眼的光,火星四溅,放出大量的热)
②与S反应: Fe+S—FeS (黑色固体,不溶于水)
(1)与非金属单质反应(表现还原性):
①与O 反应: 常温下4Fe+3O =2Fe O (铁的生锈)
(在纯氧中剧烈燃烧, 发出耀眼的光,火星四溅,放出大量的热)
②与S反应:] (黑色固体,不溶于水)
③与Cl 反应: (剧烈燃烧,产生棕褐色的烟)
(1)与非金属单质反应(表现还原性):
①与O 反应: 常温下4Fe+30 =2Fe O (铁的生锈)
(在纯氧中剧烈燃烧, 发出耀眼的光,火星四溅,放出大量的热)
②与S反应: (黑色固体,不溶于水)
③与Cl 反应: (剧烈燃烧,产生棕褐色的烟)
④与Br 反应:2Fe ( 少 量 ) + 3Br —2FeBr
⑤与I 反 应 :
【微点拨】①铁与非金属单质的反应体现了铁单质的还原性
②无论Fe过量还是不足,都只能生成FeCl
③常温下,Fe与Cl 不反应,可以用钢瓶保存液氯, 但要把钢瓶置于干燥阴凉处
(2)与非氧化性酸反应(与稀盐酸、稀硫酸反应,Fe表现还原性)
① 与稀盐酸反应: Fe+2HCl=FeCl +H 个
②与稀硫酸反应: Fe+H SO =FeSO +H 个
(3)与氧化性酸反应(与硝酸、浓硫酸反应)
①Fe 不足时:Fe+4HNO (稀)= Fe(NO ) +NO 个+2H O
②Fe过量时:3Fe+8HNO (稀)=3Fe(NO ) +2NO 个+4H O
③与浓硝酸、浓硫酸:钝化作用(化学变化)
在常温时,Fe 的表面会被浓硝酸、浓硫酸氧化形成一层致密的氧化物薄 膜,氧化物薄膜隔绝了内层金属与浓硝酸、浓硫酸的接触,即钝化作用。
【微点拨】
在加热的条件下,浓硝酸、浓硫酸能破坏氧化物薄膜,使内层金属与 浓硝酸、浓硫酸继续反应。
(4)与盐反应
①与硫酸铜溶液反应:Fe+CuSO =FeSO +Cu
②与氯化铁溶液反应:Fe+2FeCl =3FeCl
(5)与水蒸气反应
思考:常温下,铁与水不反应,但铸铁的时候为什么不能将高温铁水倒入含有水的模具
(4)与盐反应
①与硫酸铜溶液反应: Fe+CuSO =FeSO +Cu
②与氯化铁溶液反应: Fe+2FeCl =3FeCl
(5)与水蒸气反应
酒精灯加金属网罩的目的
湿棉花的作用是受热时
提供反应所需的水蒸气 用燃着的火柴点燃肥皂泡,听
到爆鸣声,证明生成了氢气
思考:如何证
铁粉与水蒸气的反应实验装置
实验结论:在高温下,铁能与水蒸气反应生成H 化学方程式:3 Fe+4H O(g) 高温Fe O +4H
明生成的黑色 固体是Fe O
【微点拨】铁与水蒸气的反应实验注意事项
①反应条件:铁与冷水、热水不能反应,只能与水蒸气在高温下反应。
②反应产物:Fe O 和 H , 不是Fe O 。
③反应实质:与Na、Mg 一样,都是置换出水电离产生的H+, 但不能得到 铁的氢氧化物,因为在高温下铁的氢氧化物会分解为铁的氧化物和水。
④在钢铁生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分 的干燥处理,不得留有水。
组成血红蛋白,参与氧的运输
人体内的含铁化合物
与一些酶结合,分布于身体各器官
缺铁会造成 记忆力、免疫力、对温度适应力下降、缺铁性贫血
高炉炼铁:Fe O +3CO 高温2Fe+3CO
5.人体中的铁元素
铁在人体中的含量为4~5g, 是人体必需微量元素中含量最多的一种。
一、铁的单质
工业炼铁的原理是用还原的方法把铁从铁矿石中
4.铁的冶炼
提炼出来。你还记得炼铁高炉内发生的化学反应吗
功能性铁
储存铁
【对点训练1】
1. 下列关于铁的叙述中错误的是 ( C )
A. 纯净的铁是光亮的银白色金属
B. 铁能被磁体吸引
C. 铁是地壳中含量最多的金属元素
D. 铁具有延展性和导热性,可制作炊具
【对点训练1】
2.Fe 与非金属单质反应
(1)与O 反应点燃(化学方程式): 3Fe+2O 点燃Fe O __ ;
现象:剧烈燃烧,火星四射。
常温:铁在潮湿的空气中易被腐蚀,生成铁锈,其主要成分为
Fe O ·xH O。
(2)与Cl 反应(化学方程式): 2Fe+3Cl —2FeCl
;
现象:剧烈燃烧,棕褐色烟。
注意:铁在氯气中燃烧,只生成FeCl , 与反应物量比无关。
(3)与S反应(化学方程式) :Fe+S—FeS
铁元素的存在及使用
铁的物理性质
铁的化学性质
第一节
铁及其化合物
第1课时
铁单质
