氯气的性质高一上学期化学人教版(2019)必修第一册(共57张PPT)
文档属性
| 名称 | 氯气的性质高一上学期化学人教版(2019)必修第一册(共57张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-24 20:20:47 | ||
图片预览










文档简介
(共57张PPT)
第二章海水中的重要元素——钠和氯
第二节氯及其化合物
2.2.1氯气的性质
学习目标
1、能通过实验探究氯气的物理性质、化学性质,体会实验对认识和 研究物质性质的重要作用,培养证据推理意识。
2、能用氧化还原反应、离子反应的观点预测并解释氯气的化学性质,
并能用化学方程式正确表达。
3、以氯及其化合物知识的学习为线索,建立含氯元素的物质间的转 化关系,进一步了解研究物质的思路和方法。
4、通过含氯物质性质和用途的学习,感受物质性质与用途的关系, 体会化学对生活、环境保护的重要意义,增强社会责任感。
5、了解氯气的发现史,学习科学家的研究精神及勤于钻研、严谨求
实的科学态度。
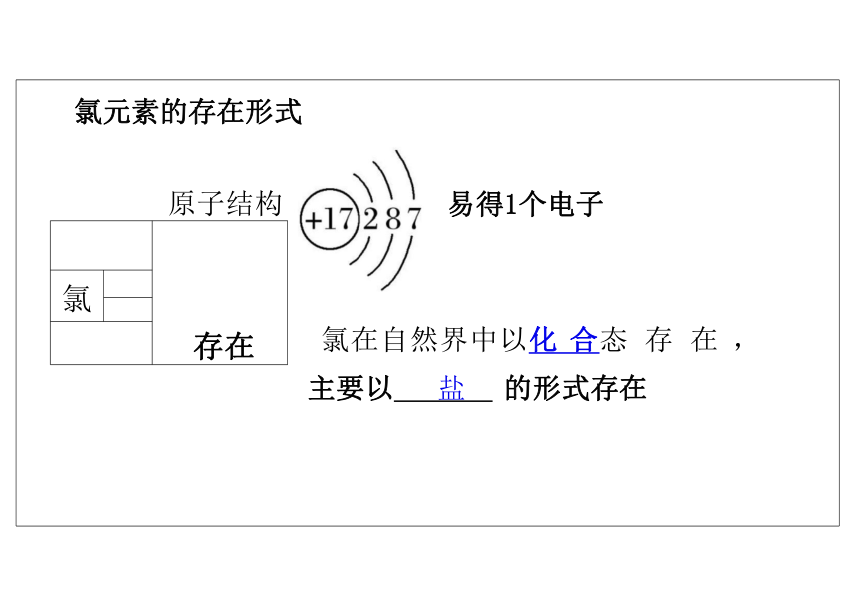
氯元素的存在形式
氯是一种重要的“成盐元素”,在自然界中只以化合物的 形式存在,主要是以NaCl 、MgCl 、CaCl 等形式大量存在 于海水中,还存在于陆地的盐湖和盐矿中。
海水 盐湖 盐矿
氯元素的存在形式 原子结构 +17)287 易得1个电子
氯在自然界中以化 合态 存 在 , 主要以 盐 的形式存在
存在
氯
氯气的用途
物杀虫
20%高
包邮 高氯 · 马
农药 染料 药品 消毒剂
3 1 % 工 业 盐 酸
制造盐酸
氯气的发现史
瑞典化学家 ·舍勒
【1742.12-1786.5】
英国化学家 ·戴维
【1778.12-1829.5】
密度 密度比空气大 如何收集氯气
> 水 溶 性 :能溶于水(1:2),1体积的水可溶解约2体积的氯气
一 、氯 气 【Cl 】的物理性质
颜色状态:黄绿色气体 > 气味:有刺激性气味
数据
氯气
熔点: -101℃
沸点:-34.6℃
密度:3.214 g/L(0℃)
熔沸点:熔沸点较低,易加压液化成液氯
一、氯气【Cl 】的物理性质
毒性:有毒
大黄绿刺激毒密大,能熔水来易液化
扇闻法
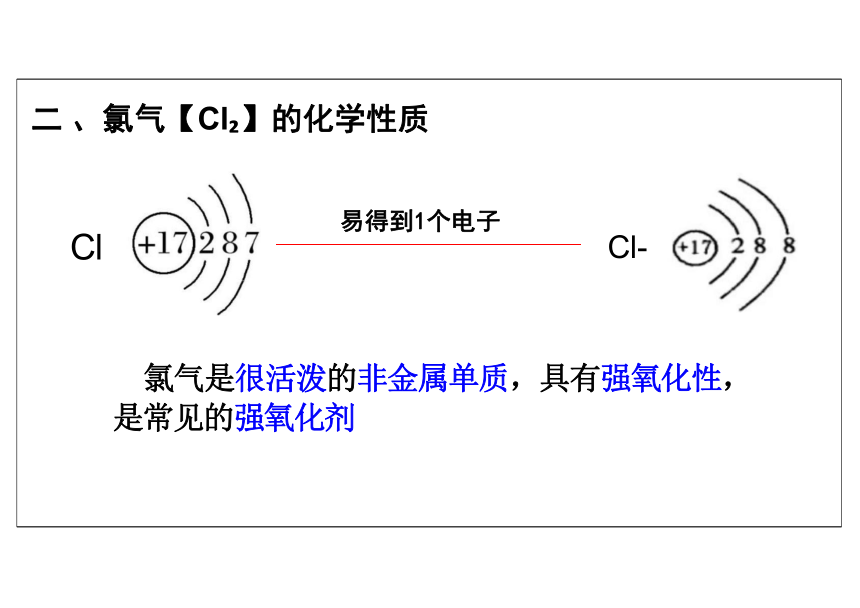
二 、氯气【Cl 】的化学性质
易得到1个电子
氯气是很活泼的非金属单质,具有强氧化性, 是常见的强氧化剂
Cl-
Cl
【问1】请书写氯气与下列金属在加热条件下反应
的化学方程式
Na:
Mg:
Al:
Fe:
Cu:
二、氯气【Cl 】的化学性质
1、氯气与金属单质反应
二、氯气【Cl 】的化学性质
1、氯气与金属单质反应
金属 实验现象
化学方程式
钠 剧烈燃烧,产生黄色火焰, 有白烟产生,有少量白色固体 生成
2Na+Cl =2NaC
铁 剧烈燃烧,产生棕红色烟, 加水后溶液呈棕黄色
铜 剧烈燃烧,产生棕黄色烟, 加水后溶液呈蓝绿色
Cu+Cl =CuCl
二、氯气【Cl 】的化学性质 1、氯气与金属单质反应
【小结】氯气在点燃或灼热的条件下,能与大多数金属 ( Pt、Au除外)化合,生成最高价金属氯化物(强氧化性) 【问2】对比Cl 和S的氧化性,请写出S与Fe、Cu 在加热条件下的化学方程式
Fe+S=FeS 2Cu+S=Cu S 氧 化 性 :Cl >S
【问4】铁会和氯气发生反应,为什么还可以用
钢瓶储运液氯
2Fe+3Cl =2FeCl
液 氯
常温下,干燥的氯气不与铁反应, 因此可用钢瓶储运液氯
【实验2-7】
在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的
集气瓶中,观察现象。
西瓜视频
氯气与氢气的反应
二、氯气【Cl 】的化学性质 盐酸的工业制法
2、氯气与非金属单质反应
图2-12 H 在Cl 中燃烧
【思考】为什么反应过程中集气瓶瓶口有白雾产生
生成的HCl 气体极易溶于水(1:500),和空气中的水蒸气
形成盐酸小液滴,所以瓶口有白雾产生
非金属 实验现象
化学方程式
氢气 纯净的氢气在氯气中安静 地燃烧,发出苍白色火焰, 瓶口有白雾产生
点燃
H +Cl =2HCl
【知识拓展】在光照条件下,H 与Cl 混合后也能发生反应
非金属 实验现象
化学方程式
氢气 剧烈反应,发生爆炸, 瓶口有白雾产生
光照
H +Cl =2HCl
【问5】请写出Cl 分别与Si、P的反应的化学方程式
Si: Si+2Cl =SiCl
Cl 不足:2P+3Cl =2PCl (白雾)
P:
Cl 过量:2P+5Cl =2PCl (白烟)
【思考与讨论】我们以前学过的燃烧反应,都是物质 在氧气中的燃烧。通过H 在Cl 中的燃烧,你对燃烧的 条件及其本质有什么新的认识
① 燃烧不一定要有氧气参加;
② 燃烧的本质是氧化还原反应,任何发光、发热的 剧烈的化学反应都称为燃烧
1、下列氯化物中,既能由金属和Cl 直接化合制得, 又能由金属和盐酸反应制得的是 ( B )
A.CuCl
B.Mg Cl
C.FeCl
D.Fe(
CI3
自来水 自来水与净水比较
除氯最好的方法是曝脑
过滤前 过滤后
不含余氯
富含矿物质
二、氯气【Cl 】的化学性质
3、溶于水中的部分氯气与水反应,氯气的水溶液称为氯水 Cl +H O=HCl+HClO 弱酸
Cl +H O=H++Cl-+HClO
失e-
歧化反应
0 -1 +1
Cl +H O=HCl+HClO e
得e-
【实验2-8】
(1)取干燥的和湿润的有色纸条(或布条)各一条,分别 放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
(2)将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃
片,观察现象。
图2-14 干燥的氧气使有色鲜花变色
HCIO的性质 1、强氧化性 作漂白剂(永久漂白)、杀菌、 消毒 实验现象
实验结论
干燥的有色纸条不褪色, 湿润的有色纸条褪色; 有色鲜花褪色
干燥的Cl 不具有漂白性,Cl 与
H O反应生成的HClO才具有漂白性
HCIO的性质 1、强氧化性(作漂白剂,杀菌,消毒) 2、不稳定性 光
氯水
法国化学家 · 贝托雷 【1748.12-1822.11】 图4.19氯水光照分解 H C I O 的 性 质 1 、强氧化性(作漂白剂,杀菌,消毒) 2、不稳定性 光照 2HClO=2HCl+O 个
光照 2HClO=2H++2Cl - +O 个
图4.19氧水光照分解
失2×2e- +1-2光照 -1 2H CIO=2HCl+O 个 4e 得2×2e-
> HCIO 的性质
1、强氧化性(作漂白剂,杀菌,消毒)
2、不稳定性(见光易分解)
2HClO= l+O 个
3、酸性(酸性比H CO 弱)
HC
照
2
光
1、用自来水养金鱼时,通常先将自来水日晒一段 时间后再注入鱼缸,其目的是(D )
A.利用紫外线杀死水中的细菌
B.提高水温,有利于金鱼生长
D.促使水中的次氯酸分解
养鱼先养水
稀盐酸
液氯 氯 水 :氯气的水溶液称为氯水 分类 纯净物 混合物 新制“ 三分四离” 久置 主要 微粒 只有Cl 分子:H O、Cl 、HClO
H O
离子:H+、Cl、CIO、OH-
H+、Cl、OH-
性质 有氧化性, 无漂白性和酸性 有强氧化性、不稳定性、酸性
酸性增强
【思考】液氯与氯水的区别 新制氯水与久置氯水的区别
放置一段时间
之后的氯水
新制氯水
浅黄绿色
久置氯水
无色
氯水
氯水
【注意】实验室中使用的氯水只能“现配现用”, 并密闭贮存于棕色细口瓶中,并放置在阴凉处
氯水
微粒 所加试剂 实验现象
离子方程式或解释
Cl- AgNO 溶液 有白色沉淀生成
Ag++Cl-=AgClJ
H+ Na CO 有气泡产生
CO -+2H+=CO 个+ H O
HClO 有色布条 有色布条褪色
漂白性
Cl FeCl 溶液 溶液变成棕黄色
2Fe ++Cl =2Fe ++
Cl 、H O SO 黄绿色褪去
s82+Cl +2H O=4H++2Cl+SO 2
H+、HClO 紫色石蕊溶液 溶液先变红, 后褪色
酸性、漂白性
H+ 镁条 有气泡产生
Mg+2H+=Mg ++H 个
1、为探究氯水中含有的部分粒子及某些粒子的性质,某化
学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含
有的粒子是 Cl
0
(2)向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中
含有的粒子是 H+
0
(3)盛有氯水的试管中有色布条褪色,说明氯水中含有的
粒子是HClO。
1、为探究氯水中含有的部分粒子及某些粒子的性质,某化
学兴趣小组做了如下实验:
(4)将紫色石蕊溶液滴入新制氯水中,溶液显红色,起作 用的微粒是 H+ ,过一会儿溶液的颜色褪去,起作用的微粒 是HClO。
(5)将氯气通入水中,所得溶液中具有氧化性的含氯微粒 是 Cl 、HCIO 、ClO- 。
(6)将氯水滴入氯化亚铁溶液中,溶液由浅绿色变为黄色, 该反应的离子方程式为: 2Fe ++Cl =2Fe ++2Cl- 。
【思考与讨论】下图是市面上常见的漂白剂, 为什么不直接用次氯酸作漂白剂
二、氯气【Cl 】的化学性质 4、氯气与碱反应 ①与NaOH反应 有效成分 Cl +2NaOH=NaCl+NaClO+H O 漂白液(84消毒液)的主要成分
C Cl +2OH-=Cl-+ClO-+H O NaOH溶液
【问6】请用双线桥法表示Cl 与NaOH 反应的电子
转移方向和数目
失e-
歧化反应 0 -1 +1
Cl +2NaOH=NaCl+NaClO+H O e
得e-
二 、氯气【Cl 】的化学性质
4、氯气与碱反应
② 与Ca(OH) 反应
2Cl +2Ca(OH) =CaCl +Ca(ClO) +2H O
漂白粉的主要成分
Cl +Ca(OH) =Ca ++Cl-+ClO-+H O
有效成分,漂粉精 的主要成分
【问7】请用双线桥法表示Cl 与Ca(OH) 反应的电子
转移方向和数目
失2 × e-
0 -1 +1
2Cl +2Ca(OH) =CaCl +Ca(ClO) +2H O ~2e
得2 × e-
歧化反应
漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的
漂白剂,又可用作游泳池等场所的消毒剂
使用说明
【主要成分】次氯酸钙 氯化钙
【用途用量】取漂白粉2至3g,水1000g,配成溶液,将病人 用具浸泡其中5至10分钟。如需要,浓度可提高,时间可延长。 【注意事项]密封避光保存于阴凉处,随配随用 有腐蚀性, 少与手接触。
【问8】如果漂白粉长期露置在空气中会不会失效
强酸制弱酸 CaCO +2HCl=CaCl +H O+CO 个
Ca(CIO) +2HCl=CaCl +2HClO
Ca(ClO) +CO +H O=CaCO ↓+2HCIO
H CO 酸性比HClO强
Ca(ClO)2+CO +H O=CaCO ↓+2HClO
光照
2HCIO=2HCl+O 个
【问8】如果漂白粉长期露置在空气中会不会失效
【思考与讨论】84消毒液能不能和洁厕剂混合使用
焦点连连
女子混用84消毒液与法厕灵
致气体中毒住院
事后感悟要学好化学
那天不是在洗澡嘛
焦点
连连
84消毒液不能和洁厕剂混合使用
NaClO+2HCl(浓)=Cl 个+H O+NaCl
ClO-+Cl-+2H+=Cl 个+H O
消毒
消毒液 洁厕剂 有毒氯气
【问9】请书写84消毒液有效成分与洁厕剂主要成分
反应的化学方程式、离子方程式
【思考与讨论】日常生活中发现氯气泄漏应如何自救
①Cl 密度比空气大,因此要逆着风向朝高处转移;
②由于Cl 易和碱反应,可用蘸有肥皂水或纯碱溶液 的毛巾捂住眼睛和呼吸道;
③向空中喷洒石灰水用于处理Cl 。
溶液先变红后褪色①因为Cl 与碱发生了反应
②因为氯水中含有HClO,HCIO 起漂白作用
你是否能设计实验证明哪种猜测是对的呢
取少量褪色后的溶液于试管中,向其中滴加几滴NaOH 溶液。若溶液恢复成红色,说明是原因①;若溶液未恢复 成红色,说明是原因②
【思考与讨论】向NaOH 溶液中滴加酚酞溶液,再逐滴滴
加氯水,会有什么现象 实验中酚酞褪色的原因是什么
验证次氯酸光照分解产物的数字化实验
时间/s 时间/s
数据:随着时间推移,溶液的pH 减小,酸性增强,Cl-浓度增大, 有氧气生成
结论:次氯酸不稳定,见光易分解
氧 气 的 体 积 分 数
氯 离 子 的 浓 度
时间/s
%
/
验证次氯酸光照分解产物的数字化实验
Cl 新制氯水 、
C 生成沉淀 加入AgNO 溶液产生白色沉淀
HClO H+ 不稳定性 漂白性 酸性
在强光照射下,新制氯水中有 气泡产生
使有色布条或品红溶液褪色
使紫色石蕊溶液先变红后褪色
加活泼金属、碳酸盐等产生气泡
能够氧化Fe +、Br- I-等
氧化性
收 塔
合成
→废气
喷洒器
瓷环填料
而寸酸栅板
盐酸
散热片
支 架
点 火 孔
氢气
氯气
盐酸生产流程
燃烧器解剖
制作消毒剂、 漂白剂等
与金属反应
与非金属反应
生成次氯 酸和盐酸
生成次氯酸 盐和氯化物
氯水是混合物,液氯 氯气为氯的单质
氯水有漂白性,液 氯、氯气无漂白性
氯气、液氯溶于
水形成氯水
氯气
化学
性质
用途
强氧
化性
与水
反应
与碱
反应
都含氯元素 相同点
都具有强氧化性
黄绿色气体,密度比 空气大,能溶于水
不同点
联系
氯气、氯水
和液氯
物理
性质
1、下列叙述中正确的是 ( D )
A. 活性炭和氯气加入溶液中都会使有机色质脱色,若两 者同时使用,一定会大大增强脱色效果
B.Cl 有强氧化性,能使染料和有机色素褪色
C.Cl 、Cl与Cl-均属氯元素,它们具有相似的化学性质
D.钢瓶可以贮存液氯,但不能贮存氯水
2、检验HCl气体中是否混合氯气,下列方法中 最好采用 ( D )
A. 闻气味
B.将气体通入AgNO 溶液
C.将气体通入NaHCO 溶液
D. 用湿润蓝色石蕊试纸接触气体
3、某同学用经过氯气消毒的自来水配制下列物质的 溶液,不会引起溶液明显变质的是 (A )
A.KCI
B.NaOH
C.AgNO
D.FeCl
4、如图是一种验证某气体化学性质的实验装置,图 中B为活塞。如先打开B,在A处通入干燥氯气,C中红
布条颜色无变化;当关闭B时,C中红布条颜色褪去。 则D瓶中盛有的液体是(D)
A.浓硫酸
B.浓NaOH溶液
C.四氯化碳(氯气易溶于四氯化碳)
D.饱和NaCl溶液
第二章海水中的重要元素——钠和氯
第二节氯及其化合物
2.2.1氯气的性质
学习目标
1、能通过实验探究氯气的物理性质、化学性质,体会实验对认识和 研究物质性质的重要作用,培养证据推理意识。
2、能用氧化还原反应、离子反应的观点预测并解释氯气的化学性质,
并能用化学方程式正确表达。
3、以氯及其化合物知识的学习为线索,建立含氯元素的物质间的转 化关系,进一步了解研究物质的思路和方法。
4、通过含氯物质性质和用途的学习,感受物质性质与用途的关系, 体会化学对生活、环境保护的重要意义,增强社会责任感。
5、了解氯气的发现史,学习科学家的研究精神及勤于钻研、严谨求
实的科学态度。
氯元素的存在形式
氯是一种重要的“成盐元素”,在自然界中只以化合物的 形式存在,主要是以NaCl 、MgCl 、CaCl 等形式大量存在 于海水中,还存在于陆地的盐湖和盐矿中。
海水 盐湖 盐矿
氯元素的存在形式 原子结构 +17)287 易得1个电子
氯在自然界中以化 合态 存 在 , 主要以 盐 的形式存在
存在
氯
氯气的用途
物杀虫
20%高
包邮 高氯 · 马
农药 染料 药品 消毒剂
3 1 % 工 业 盐 酸
制造盐酸
氯气的发现史
瑞典化学家 ·舍勒
【1742.12-1786.5】
英国化学家 ·戴维
【1778.12-1829.5】
密度 密度比空气大 如何收集氯气
> 水 溶 性 :能溶于水(1:2),1体积的水可溶解约2体积的氯气
一 、氯 气 【Cl 】的物理性质
颜色状态:黄绿色气体 > 气味:有刺激性气味
数据
氯气
熔点: -101℃
沸点:-34.6℃
密度:3.214 g/L(0℃)
熔沸点:熔沸点较低,易加压液化成液氯
一、氯气【Cl 】的物理性质
毒性:有毒
大黄绿刺激毒密大,能熔水来易液化
扇闻法
二 、氯气【Cl 】的化学性质
易得到1个电子
氯气是很活泼的非金属单质,具有强氧化性, 是常见的强氧化剂
Cl-
Cl
【问1】请书写氯气与下列金属在加热条件下反应
的化学方程式
Na:
Mg:
Al:
Fe:
Cu:
二、氯气【Cl 】的化学性质
1、氯气与金属单质反应
二、氯气【Cl 】的化学性质
1、氯气与金属单质反应
金属 实验现象
化学方程式
钠 剧烈燃烧,产生黄色火焰, 有白烟产生,有少量白色固体 生成
2Na+Cl =2NaC
铁 剧烈燃烧,产生棕红色烟, 加水后溶液呈棕黄色
铜 剧烈燃烧,产生棕黄色烟, 加水后溶液呈蓝绿色
Cu+Cl =CuCl
二、氯气【Cl 】的化学性质 1、氯气与金属单质反应
【小结】氯气在点燃或灼热的条件下,能与大多数金属 ( Pt、Au除外)化合,生成最高价金属氯化物(强氧化性) 【问2】对比Cl 和S的氧化性,请写出S与Fe、Cu 在加热条件下的化学方程式
Fe+S=FeS 2Cu+S=Cu S 氧 化 性 :Cl >S
【问4】铁会和氯气发生反应,为什么还可以用
钢瓶储运液氯
2Fe+3Cl =2FeCl
液 氯
常温下,干燥的氯气不与铁反应, 因此可用钢瓶储运液氯
【实验2-7】
在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的
集气瓶中,观察现象。
西瓜视频
氯气与氢气的反应
二、氯气【Cl 】的化学性质 盐酸的工业制法
2、氯气与非金属单质反应
图2-12 H 在Cl 中燃烧
【思考】为什么反应过程中集气瓶瓶口有白雾产生
生成的HCl 气体极易溶于水(1:500),和空气中的水蒸气
形成盐酸小液滴,所以瓶口有白雾产生
非金属 实验现象
化学方程式
氢气 纯净的氢气在氯气中安静 地燃烧,发出苍白色火焰, 瓶口有白雾产生
点燃
H +Cl =2HCl
【知识拓展】在光照条件下,H 与Cl 混合后也能发生反应
非金属 实验现象
化学方程式
氢气 剧烈反应,发生爆炸, 瓶口有白雾产生
光照
H +Cl =2HCl
【问5】请写出Cl 分别与Si、P的反应的化学方程式
Si: Si+2Cl =SiCl
Cl 不足:2P+3Cl =2PCl (白雾)
P:
Cl 过量:2P+5Cl =2PCl (白烟)
【思考与讨论】我们以前学过的燃烧反应,都是物质 在氧气中的燃烧。通过H 在Cl 中的燃烧,你对燃烧的 条件及其本质有什么新的认识
① 燃烧不一定要有氧气参加;
② 燃烧的本质是氧化还原反应,任何发光、发热的 剧烈的化学反应都称为燃烧
1、下列氯化物中,既能由金属和Cl 直接化合制得, 又能由金属和盐酸反应制得的是 ( B )
A.CuCl
B.Mg Cl
C.FeCl
D.Fe(
CI3
自来水 自来水与净水比较
除氯最好的方法是曝脑
过滤前 过滤后
不含余氯
富含矿物质
二、氯气【Cl 】的化学性质
3、溶于水中的部分氯气与水反应,氯气的水溶液称为氯水 Cl +H O=HCl+HClO 弱酸
Cl +H O=H++Cl-+HClO
失e-
歧化反应
0 -1 +1
Cl +H O=HCl+HClO e
得e-
【实验2-8】
(1)取干燥的和湿润的有色纸条(或布条)各一条,分别 放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
(2)将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃
片,观察现象。
图2-14 干燥的氧气使有色鲜花变色
HCIO的性质 1、强氧化性 作漂白剂(永久漂白)、杀菌、 消毒 实验现象
实验结论
干燥的有色纸条不褪色, 湿润的有色纸条褪色; 有色鲜花褪色
干燥的Cl 不具有漂白性,Cl 与
H O反应生成的HClO才具有漂白性
HCIO的性质 1、强氧化性(作漂白剂,杀菌,消毒) 2、不稳定性 光
氯水
法国化学家 · 贝托雷 【1748.12-1822.11】 图4.19氯水光照分解 H C I O 的 性 质 1 、强氧化性(作漂白剂,杀菌,消毒) 2、不稳定性 光照 2HClO=2HCl+O 个
光照 2HClO=2H++2Cl - +O 个
图4.19氧水光照分解
失2×2e- +1-2光照 -1 2H CIO=2HCl+O 个 4e 得2×2e-
> HCIO 的性质
1、强氧化性(作漂白剂,杀菌,消毒)
2、不稳定性(见光易分解)
2HClO= l+O 个
3、酸性(酸性比H CO 弱)
HC
照
2
光
1、用自来水养金鱼时,通常先将自来水日晒一段 时间后再注入鱼缸,其目的是(D )
A.利用紫外线杀死水中的细菌
B.提高水温,有利于金鱼生长
D.促使水中的次氯酸分解
养鱼先养水
稀盐酸
液氯 氯 水 :氯气的水溶液称为氯水 分类 纯净物 混合物 新制“ 三分四离” 久置 主要 微粒 只有Cl 分子:H O、Cl 、HClO
H O
离子:H+、Cl、CIO、OH-
H+、Cl、OH-
性质 有氧化性, 无漂白性和酸性 有强氧化性、不稳定性、酸性
酸性增强
【思考】液氯与氯水的区别 新制氯水与久置氯水的区别
放置一段时间
之后的氯水
新制氯水
浅黄绿色
久置氯水
无色
氯水
氯水
【注意】实验室中使用的氯水只能“现配现用”, 并密闭贮存于棕色细口瓶中,并放置在阴凉处
氯水
微粒 所加试剂 实验现象
离子方程式或解释
Cl- AgNO 溶液 有白色沉淀生成
Ag++Cl-=AgClJ
H+ Na CO 有气泡产生
CO -+2H+=CO 个+ H O
HClO 有色布条 有色布条褪色
漂白性
Cl FeCl 溶液 溶液变成棕黄色
2Fe ++Cl =2Fe ++
Cl 、H O SO 黄绿色褪去
s82+Cl +2H O=4H++2Cl+SO 2
H+、HClO 紫色石蕊溶液 溶液先变红, 后褪色
酸性、漂白性
H+ 镁条 有气泡产生
Mg+2H+=Mg ++H 个
1、为探究氯水中含有的部分粒子及某些粒子的性质,某化
学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含
有的粒子是 Cl
0
(2)向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中
含有的粒子是 H+
0
(3)盛有氯水的试管中有色布条褪色,说明氯水中含有的
粒子是HClO。
1、为探究氯水中含有的部分粒子及某些粒子的性质,某化
学兴趣小组做了如下实验:
(4)将紫色石蕊溶液滴入新制氯水中,溶液显红色,起作 用的微粒是 H+ ,过一会儿溶液的颜色褪去,起作用的微粒 是HClO。
(5)将氯气通入水中,所得溶液中具有氧化性的含氯微粒 是 Cl 、HCIO 、ClO- 。
(6)将氯水滴入氯化亚铁溶液中,溶液由浅绿色变为黄色, 该反应的离子方程式为: 2Fe ++Cl =2Fe ++2Cl- 。
【思考与讨论】下图是市面上常见的漂白剂, 为什么不直接用次氯酸作漂白剂
二、氯气【Cl 】的化学性质 4、氯气与碱反应 ①与NaOH反应 有效成分 Cl +2NaOH=NaCl+NaClO+H O 漂白液(84消毒液)的主要成分
C Cl +2OH-=Cl-+ClO-+H O NaOH溶液
【问6】请用双线桥法表示Cl 与NaOH 反应的电子
转移方向和数目
失e-
歧化反应 0 -1 +1
Cl +2NaOH=NaCl+NaClO+H O e
得e-
二 、氯气【Cl 】的化学性质
4、氯气与碱反应
② 与Ca(OH) 反应
2Cl +2Ca(OH) =CaCl +Ca(ClO) +2H O
漂白粉的主要成分
Cl +Ca(OH) =Ca ++Cl-+ClO-+H O
有效成分,漂粉精 的主要成分
【问7】请用双线桥法表示Cl 与Ca(OH) 反应的电子
转移方向和数目
失2 × e-
0 -1 +1
2Cl +2Ca(OH) =CaCl +Ca(ClO) +2H O ~2e
得2 × e-
歧化反应
漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的
漂白剂,又可用作游泳池等场所的消毒剂
使用说明
【主要成分】次氯酸钙 氯化钙
【用途用量】取漂白粉2至3g,水1000g,配成溶液,将病人 用具浸泡其中5至10分钟。如需要,浓度可提高,时间可延长。 【注意事项]密封避光保存于阴凉处,随配随用 有腐蚀性, 少与手接触。
【问8】如果漂白粉长期露置在空气中会不会失效
强酸制弱酸 CaCO +2HCl=CaCl +H O+CO 个
Ca(CIO) +2HCl=CaCl +2HClO
Ca(ClO) +CO +H O=CaCO ↓+2HCIO
H CO 酸性比HClO强
Ca(ClO)2+CO +H O=CaCO ↓+2HClO
光照
2HCIO=2HCl+O 个
【问8】如果漂白粉长期露置在空气中会不会失效
【思考与讨论】84消毒液能不能和洁厕剂混合使用
焦点连连
女子混用84消毒液与法厕灵
致气体中毒住院
事后感悟要学好化学
那天不是在洗澡嘛
焦点
连连
84消毒液不能和洁厕剂混合使用
NaClO+2HCl(浓)=Cl 个+H O+NaCl
ClO-+Cl-+2H+=Cl 个+H O
消毒
消毒液 洁厕剂 有毒氯气
【问9】请书写84消毒液有效成分与洁厕剂主要成分
反应的化学方程式、离子方程式
【思考与讨论】日常生活中发现氯气泄漏应如何自救
①Cl 密度比空气大,因此要逆着风向朝高处转移;
②由于Cl 易和碱反应,可用蘸有肥皂水或纯碱溶液 的毛巾捂住眼睛和呼吸道;
③向空中喷洒石灰水用于处理Cl 。
溶液先变红后褪色①因为Cl 与碱发生了反应
②因为氯水中含有HClO,HCIO 起漂白作用
你是否能设计实验证明哪种猜测是对的呢
取少量褪色后的溶液于试管中,向其中滴加几滴NaOH 溶液。若溶液恢复成红色,说明是原因①;若溶液未恢复 成红色,说明是原因②
【思考与讨论】向NaOH 溶液中滴加酚酞溶液,再逐滴滴
加氯水,会有什么现象 实验中酚酞褪色的原因是什么
验证次氯酸光照分解产物的数字化实验
时间/s 时间/s
数据:随着时间推移,溶液的pH 减小,酸性增强,Cl-浓度增大, 有氧气生成
结论:次氯酸不稳定,见光易分解
氧 气 的 体 积 分 数
氯 离 子 的 浓 度
时间/s
%
/
验证次氯酸光照分解产物的数字化实验
Cl 新制氯水 、
C 生成沉淀 加入AgNO 溶液产生白色沉淀
HClO H+ 不稳定性 漂白性 酸性
在强光照射下,新制氯水中有 气泡产生
使有色布条或品红溶液褪色
使紫色石蕊溶液先变红后褪色
加活泼金属、碳酸盐等产生气泡
能够氧化Fe +、Br- I-等
氧化性
收 塔
合成
→废气
喷洒器
瓷环填料
而寸酸栅板
盐酸
散热片
支 架
点 火 孔
氢气
氯气
盐酸生产流程
燃烧器解剖
制作消毒剂、 漂白剂等
与金属反应
与非金属反应
生成次氯 酸和盐酸
生成次氯酸 盐和氯化物
氯水是混合物,液氯 氯气为氯的单质
氯水有漂白性,液 氯、氯气无漂白性
氯气、液氯溶于
水形成氯水
氯气
化学
性质
用途
强氧
化性
与水
反应
与碱
反应
都含氯元素 相同点
都具有强氧化性
黄绿色气体,密度比 空气大,能溶于水
不同点
联系
氯气、氯水
和液氯
物理
性质
1、下列叙述中正确的是 ( D )
A. 活性炭和氯气加入溶液中都会使有机色质脱色,若两 者同时使用,一定会大大增强脱色效果
B.Cl 有强氧化性,能使染料和有机色素褪色
C.Cl 、Cl与Cl-均属氯元素,它们具有相似的化学性质
D.钢瓶可以贮存液氯,但不能贮存氯水
2、检验HCl气体中是否混合氯气,下列方法中 最好采用 ( D )
A. 闻气味
B.将气体通入AgNO 溶液
C.将气体通入NaHCO 溶液
D. 用湿润蓝色石蕊试纸接触气体
3、某同学用经过氯气消毒的自来水配制下列物质的 溶液,不会引起溶液明显变质的是 (A )
A.KCI
B.NaOH
C.AgNO
D.FeCl
4、如图是一种验证某气体化学性质的实验装置,图 中B为活塞。如先打开B,在A处通入干燥氯气,C中红
布条颜色无变化;当关闭B时,C中红布条颜色褪去。 则D瓶中盛有的液体是(D)
A.浓硫酸
B.浓NaOH溶液
C.四氯化碳(氯气易溶于四氯化碳)
D.饱和NaCl溶液
