6.2.1 化学反应速率 (课件) -高中化学人教版(2019)必修第二册(共29张PPT)
文档属性
| 名称 | 6.2.1 化学反应速率 (课件) -高中化学人教版(2019)必修第二册(共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 12:51:32 | ||
图片预览






文档简介
(共29张PPT)
第六章化学反应与能量
课题:第二节化学反应的速率与限度
第1课时化学反应的速率
[学习目标]
1. 通过生活常识认识化学反应速率及其影响因素。
2. 能进行化学反应速率的计算、转化与比较,学会控制化学反应速率的常 用方法。
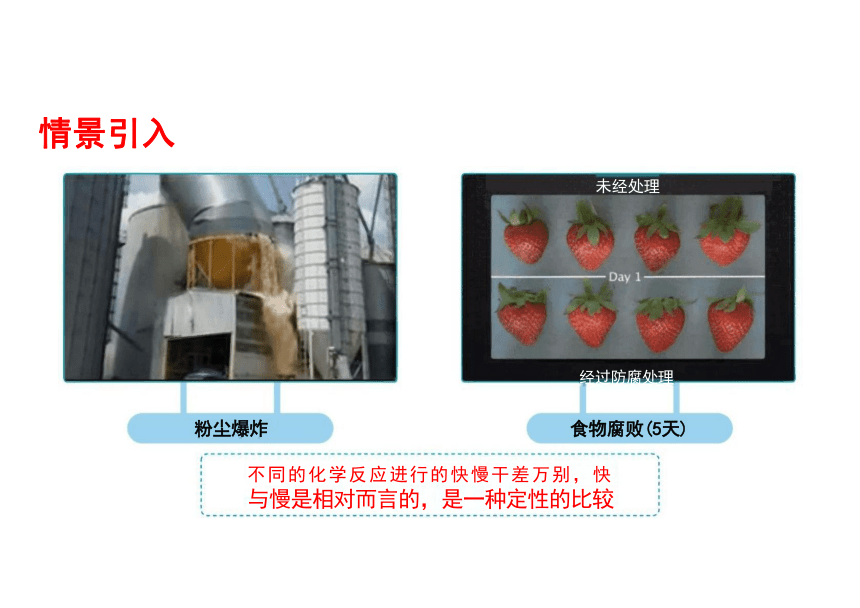
未经处理
经过防腐处理
粉尘爆炸 食物腐败(5天)
不同的化学反应进行的快慢干差万别,快 与慢是相对而言的,是一种定性的比较
情景引入
那么,如何定量的描述化学反应过程进行的快慢呢
情景引入
概念
表示方法
定义式
常用单位
用来衡量化学反应过程进行快慢程度的物理量
通常用单位时间内反应物浓度的减少量或生成 物浓度的增加量来表示(均取正 值)
一、化学反应速率
mol·L-1.s-1或mol.L-1·min-1
速率的单位也可表示为mol/(L·s)或mol/(L·min), 但是必须要加括号,错误的写法: mol/L · s
! 化学反应速率是物质在一段时间内的平均速率,而不是在某一时刻的瞬时速率,且均取正值 在反应中,用浓度变化表示化学反应速率只适用于气体和溶液中的溶质,纯液体和纯固体 的浓度是恒定不变的,因此对有纯液体或纯固体参加的化学反应,一般不用其浓度来表示 化学反应速率 同一化学反应中,选用不同物质表示化学反应速率,其数值可能相同也可能不相同,但表 示的意义相同,且化学反应速率之比=化学计量数之比。因此,表示化学反应速率时,必须 指明用哪种物质作标准,在v的后面将该物质的化学式用括号括起来
注意
●化学反应速率及其表示方法
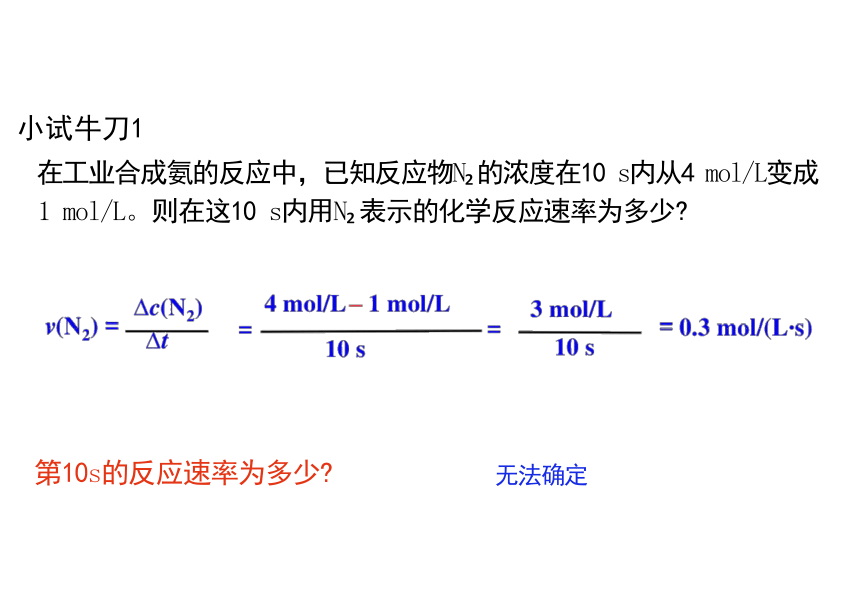
小试牛刀1
在工业合成氨的反应中,已知反应物N 的浓度在10 s内从4 mol/L变成
1 mol/L。则在这10 s内用N 表示的化学反应速率为多少
第10s的反应速率为多少 无法确定
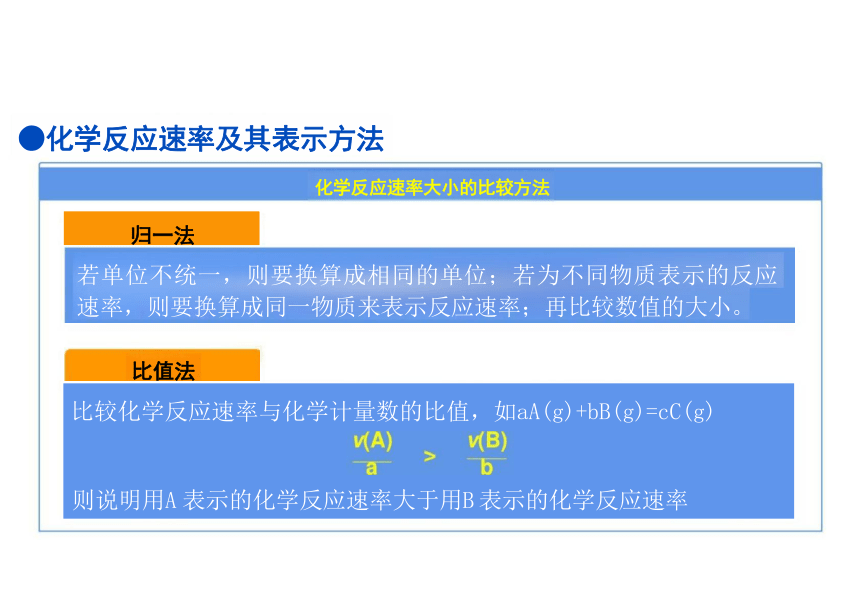
比值法
比较化学反应速率与化学计量数的比值,如aA(g)+bB(g)=cC(g)
则说明用A 表示的化学反应速率大于用B 表示的化学反应速率
若单位不统一,则要换算成相同的单位;若为不同物质表示的反应 速率,则要换算成同一物质来表示反应速率;再比较数值的大小。
●化学反应速率及其表示方法
化学反应速率大小的比较方法
归一法
小试牛刀2
1.在2A+B=3C+4D 反应中,表示该反应速率最快的是(B )
A.v(A)=0.5mol·L-1os-1
B.v(B)=0.3mol·L-1.s-1
C.v(C)=0.8mol·L-1.s-1
D.v(D)=1mol·L-1os-1
2.在一密闭容器中发生反应N +3H 高 、化 压 2NH ,反应开始时,N 和H 的浓度分别为8 mol/L、20 mol/L,2min末时,测得容器中N 的浓 度变为4 mol/L,求该反应2min内N 、H 和NH 的化学反应速率。
N +3H
起始浓度 (mol/L) 8 20
△C (mol/L)4 12
2min末浓度(mol/L)4
v [mol/(L·min)] 2 6 4
列“三段式”
2NH
0
8
高温、高压
催化剂
“减慢有害的化学反应” “加快有利的化学反应”
食物腐坏 钢铁腐蚀 炼钢 合成氨
【思考】对于下列反应,你是希望其反应速率越快越好还是越慢越好
有哪些因素能够影响化学反应速率呢
对于有些化学反应,我们希望其越慢越好,如食物的变质、橡胶和塑料
的老化、金属的锈蚀;有些则希望其快一些,如氨、硫酸等化工产品的生 产。调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
二 、影响化学反应速率的因素
请同学们回忆所学的化学知识并联系生活实际,思考哪些因素能够 影响化学反应速率
在相同条件下,金属与水的反应的剧烈程度: Na>Mg>Al 。这说明 什么
不同的金属和冷水反应,剧烈程度不同,这意味着物质自身的性质
是决定化学反应速率的主要因素(内因)。
方法导引——变量控制法
自变量(如浓 度、温度等)
因变量(如反 应速率)
确定研 不确定
究对象
(化学反应)
确定因变量
(反应速率) 的观测指标
【探究】影响化学反应速率的因素
改变单 一变量
结论
●影响化学反应速率的因素
实验探究
外界条件对化学反应速率的影响——温度对化学反应速率影响的探究
实 验 步 骤 》 在两支大小相同的试管中均加入2 mL 3%H O 溶液,同时滴入2滴1 mol/L FeCl 溶液。待试管中均有适量气泡出现时,将其中一支试管放入盛有冷水的烧杯中,另一支 试管放入盛有热水的烧杯中,观察现象并进行对比。
2 mL3%H O 溶液
(滴入2滴1 mol/L FeCl 溶
液)
冷水 热水
●影响化学反应速率的因素
实验探究
外界条件对化学反应速率的影响——温度对化学反应速率影响的探究
实验现象 》》
冷水中,产 生 气泡速率较慢
实验结论 》 温度升高,H O 的分解速率_加快
热水中,产 生 气泡速率较快
●影响化学反应速率的因素
实验探究
外界条件对化学反应速率的影响——浓度对化学反应速率影响的探究
实验步骤》》 在两支大小相同的试管中均加入同等量大理石小碎块,然后分别滴入5滴0.1 mol/L盐酸溶液和5滴1 mol/L 盐酸溶液,观察现象并进行对比。
0.1 mol/L
盐酸溶液
1 mol/L
盐酸溶液
实验现象 》》
0.1 mol/L盐酸溶液,
产生气泡速率较慢
实验结论 》 增大反应物浓度,能使反应速率_ 加快
外界条件对化学反应速率的影响——浓度对化学反应速率影响的探究
●影响化学反应速率的因素
1 mol/L盐酸溶液,
产生气泡速率较快
实验探究
●影响化学反应速率的因素
思维延伸
外界条件对化学反应速率的影响——压强对化学反应速率的影响
对于有气体参与的化学反应,改变压强往
往能引起气体物质浓度的变化,进而对化学 反应速率产生影响。只有压强的变化引起物 质浓度变化时才能改变化学反应速率。
结论:增大气态反应物的压强,化学反应速率加快,减小气态反
应物的压强,化学反应速率减慢。
【思考】
已知在密闭容器中发生化学反应:N (g)+O (g)=2NO(g)。 分析下
列条件的改变对该反应的化学反应速率的影响。
(1)缩小容器容积使体系压强增大,该反应的反应速率将如何变化
反应速率增大
(2)体积不变,充入氩气,使体系压强增大,该反应的反应速率将如何
变化
反应速率不变
(3)压强不变,充入氩气,该反应的反应速率将如何变化
反应速率减小
外界条件对化学反应速率的影响——催化剂对化学反应速率影响的探究
●影响化学反应速率的因素
实验结论 》 MnO 、FeCl 可以使H O 分解的速率 加 快
实验探究
实验现象 》》
浓度 反应物浓度越大
温度 温度越高
压强 气体反应的压强越大
催化剂 使用催化剂
其他因素 反应物接触面积,固体反应物的颗粒大小等
内因:化学反应速率的大小主要取决于反应物本身的性质。
外因:在其他条件相同时:
归纳总结
●影响化学反应速率的因素
影响因素及规律
化学反应 速率越大
燃烧 食物保存在冰箱里发面时加入适量酵母 蜂窝煤
反应物浓度 反应温度 催化剂 反应物接触面积
浓度越大,速率越快温度越低,速率越慢 催化剂加快速率 接触面积越大,速率
越快
【思考】这些生活实例是利用什么因素的改变来影响反应速率
请同学们试着分析为什么AB 段化学反应速率增大,
BC段化学反应速率减小
AB 段:反应放热,溶液温度逐渐升高,v 增大
BC段:溶液中c(H O )逐渐减小,v减小
结论:影响化学反应速率的因素可能是多方面的。
【思考】过氧化氢溶液分解的化学反应速率随时间的变化如下图所示。
选项 反应物 反应物浓度
反应温度
A H 和 F 均为0.02 mol.L-1
5℃
B H 和 B r 均为1 mol.L-1
200℃
C H 和 C l 均为1 mol ·L-1
100℃
D H 和 N 均为4 mol ·L-1
300℃
小试牛刀3
1.下列各组化学反应,反应速率最快的是( A )
组别 A B C D
E
盐酸浓度/mol.L-1 2.0 2.0 2.5 2.5
2.5
温度/℃ 25 30 30 50
50
锌粒状态 块状 粉末 粉末 块状
粉末
回答下列问题:
(1)探究浓度对化学反应速率的影响应选用哪两组实验数据BC。
(2)探究温度对化学反应速率的影响应选用哪两组实验数据 CE 。
2.用等质量的锌与等体积过量盐酸在不同条件下进行如下5组实验,测定收集相同条 件下等体积的氢气所用时间。
(3)探究接触面积对化学反应速率的影响应选用哪两组实验数据DE 。
(4)上述5组实验中测定收集等体积的氢气需要时间最短的是E 。
(5)实验完成后,某同学又用A组实验药品滴加两滴氯化铜,发现产生氢气的速率
明显加快,解释速率加快的原因是 Zn与Cu +反应生成Cu单质,在 锌块表面形成Zn—Cu原电池,加快化学反应速率
组别 A B C D
E
盐酸浓度/mol.L-1 2.0 2.0 2.5 2.5
2.5
温度/℃ 25 30 30 50
50
锌粒状态 块状 粉末 粉末 块状
粉末
2.用等质量的锌与等体积过量盐酸在不同条件下进行如下5组实验,测定收集相同条 件下等体积的氢气所用时间。
概念 表示方法 定义式 常用单位 注意事项
内因 温度 浓度 压强 催化剂
影响化学 反应速率 的因素
课堂小结
化学反应的速率
第六章化学反应与能量
课题:第二节化学反应的速率与限度
第1课时化学反应的速率
[学习目标]
1. 通过生活常识认识化学反应速率及其影响因素。
2. 能进行化学反应速率的计算、转化与比较,学会控制化学反应速率的常 用方法。
未经处理
经过防腐处理
粉尘爆炸 食物腐败(5天)
不同的化学反应进行的快慢干差万别,快 与慢是相对而言的,是一种定性的比较
情景引入
那么,如何定量的描述化学反应过程进行的快慢呢
情景引入
概念
表示方法
定义式
常用单位
用来衡量化学反应过程进行快慢程度的物理量
通常用单位时间内反应物浓度的减少量或生成 物浓度的增加量来表示(均取正 值)
一、化学反应速率
mol·L-1.s-1或mol.L-1·min-1
速率的单位也可表示为mol/(L·s)或mol/(L·min), 但是必须要加括号,错误的写法: mol/L · s
! 化学反应速率是物质在一段时间内的平均速率,而不是在某一时刻的瞬时速率,且均取正值 在反应中,用浓度变化表示化学反应速率只适用于气体和溶液中的溶质,纯液体和纯固体 的浓度是恒定不变的,因此对有纯液体或纯固体参加的化学反应,一般不用其浓度来表示 化学反应速率 同一化学反应中,选用不同物质表示化学反应速率,其数值可能相同也可能不相同,但表 示的意义相同,且化学反应速率之比=化学计量数之比。因此,表示化学反应速率时,必须 指明用哪种物质作标准,在v的后面将该物质的化学式用括号括起来
注意
●化学反应速率及其表示方法
小试牛刀1
在工业合成氨的反应中,已知反应物N 的浓度在10 s内从4 mol/L变成
1 mol/L。则在这10 s内用N 表示的化学反应速率为多少
第10s的反应速率为多少 无法确定
比值法
比较化学反应速率与化学计量数的比值,如aA(g)+bB(g)=cC(g)
则说明用A 表示的化学反应速率大于用B 表示的化学反应速率
若单位不统一,则要换算成相同的单位;若为不同物质表示的反应 速率,则要换算成同一物质来表示反应速率;再比较数值的大小。
●化学反应速率及其表示方法
化学反应速率大小的比较方法
归一法
小试牛刀2
1.在2A+B=3C+4D 反应中,表示该反应速率最快的是(B )
A.v(A)=0.5mol·L-1os-1
B.v(B)=0.3mol·L-1.s-1
C.v(C)=0.8mol·L-1.s-1
D.v(D)=1mol·L-1os-1
2.在一密闭容器中发生反应N +3H 高 、化 压 2NH ,反应开始时,N 和H 的浓度分别为8 mol/L、20 mol/L,2min末时,测得容器中N 的浓 度变为4 mol/L,求该反应2min内N 、H 和NH 的化学反应速率。
N +3H
起始浓度 (mol/L) 8 20
△C (mol/L)4 12
2min末浓度(mol/L)4
v [mol/(L·min)] 2 6 4
列“三段式”
2NH
0
8
高温、高压
催化剂
“减慢有害的化学反应” “加快有利的化学反应”
食物腐坏 钢铁腐蚀 炼钢 合成氨
【思考】对于下列反应,你是希望其反应速率越快越好还是越慢越好
有哪些因素能够影响化学反应速率呢
对于有些化学反应,我们希望其越慢越好,如食物的变质、橡胶和塑料
的老化、金属的锈蚀;有些则希望其快一些,如氨、硫酸等化工产品的生 产。调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
二 、影响化学反应速率的因素
请同学们回忆所学的化学知识并联系生活实际,思考哪些因素能够 影响化学反应速率
在相同条件下,金属与水的反应的剧烈程度: Na>Mg>Al 。这说明 什么
不同的金属和冷水反应,剧烈程度不同,这意味着物质自身的性质
是决定化学反应速率的主要因素(内因)。
方法导引——变量控制法
自变量(如浓 度、温度等)
因变量(如反 应速率)
确定研 不确定
究对象
(化学反应)
确定因变量
(反应速率) 的观测指标
【探究】影响化学反应速率的因素
改变单 一变量
结论
●影响化学反应速率的因素
实验探究
外界条件对化学反应速率的影响——温度对化学反应速率影响的探究
实 验 步 骤 》 在两支大小相同的试管中均加入2 mL 3%H O 溶液,同时滴入2滴1 mol/L FeCl 溶液。待试管中均有适量气泡出现时,将其中一支试管放入盛有冷水的烧杯中,另一支 试管放入盛有热水的烧杯中,观察现象并进行对比。
2 mL3%H O 溶液
(滴入2滴1 mol/L FeCl 溶
液)
冷水 热水
●影响化学反应速率的因素
实验探究
外界条件对化学反应速率的影响——温度对化学反应速率影响的探究
实验现象 》》
冷水中,产 生 气泡速率较慢
实验结论 》 温度升高,H O 的分解速率_加快
热水中,产 生 气泡速率较快
●影响化学反应速率的因素
实验探究
外界条件对化学反应速率的影响——浓度对化学反应速率影响的探究
实验步骤》》 在两支大小相同的试管中均加入同等量大理石小碎块,然后分别滴入5滴0.1 mol/L盐酸溶液和5滴1 mol/L 盐酸溶液,观察现象并进行对比。
0.1 mol/L
盐酸溶液
1 mol/L
盐酸溶液
实验现象 》》
0.1 mol/L盐酸溶液,
产生气泡速率较慢
实验结论 》 增大反应物浓度,能使反应速率_ 加快
外界条件对化学反应速率的影响——浓度对化学反应速率影响的探究
●影响化学反应速率的因素
1 mol/L盐酸溶液,
产生气泡速率较快
实验探究
●影响化学反应速率的因素
思维延伸
外界条件对化学反应速率的影响——压强对化学反应速率的影响
对于有气体参与的化学反应,改变压强往
往能引起气体物质浓度的变化,进而对化学 反应速率产生影响。只有压强的变化引起物 质浓度变化时才能改变化学反应速率。
结论:增大气态反应物的压强,化学反应速率加快,减小气态反
应物的压强,化学反应速率减慢。
【思考】
已知在密闭容器中发生化学反应:N (g)+O (g)=2NO(g)。 分析下
列条件的改变对该反应的化学反应速率的影响。
(1)缩小容器容积使体系压强增大,该反应的反应速率将如何变化
反应速率增大
(2)体积不变,充入氩气,使体系压强增大,该反应的反应速率将如何
变化
反应速率不变
(3)压强不变,充入氩气,该反应的反应速率将如何变化
反应速率减小
外界条件对化学反应速率的影响——催化剂对化学反应速率影响的探究
●影响化学反应速率的因素
实验结论 》 MnO 、FeCl 可以使H O 分解的速率 加 快
实验探究
实验现象 》》
浓度 反应物浓度越大
温度 温度越高
压强 气体反应的压强越大
催化剂 使用催化剂
其他因素 反应物接触面积,固体反应物的颗粒大小等
内因:化学反应速率的大小主要取决于反应物本身的性质。
外因:在其他条件相同时:
归纳总结
●影响化学反应速率的因素
影响因素及规律
化学反应 速率越大
燃烧 食物保存在冰箱里发面时加入适量酵母 蜂窝煤
反应物浓度 反应温度 催化剂 反应物接触面积
浓度越大,速率越快温度越低,速率越慢 催化剂加快速率 接触面积越大,速率
越快
【思考】这些生活实例是利用什么因素的改变来影响反应速率
请同学们试着分析为什么AB 段化学反应速率增大,
BC段化学反应速率减小
AB 段:反应放热,溶液温度逐渐升高,v 增大
BC段:溶液中c(H O )逐渐减小,v减小
结论:影响化学反应速率的因素可能是多方面的。
【思考】过氧化氢溶液分解的化学反应速率随时间的变化如下图所示。
选项 反应物 反应物浓度
反应温度
A H 和 F 均为0.02 mol.L-1
5℃
B H 和 B r 均为1 mol.L-1
200℃
C H 和 C l 均为1 mol ·L-1
100℃
D H 和 N 均为4 mol ·L-1
300℃
小试牛刀3
1.下列各组化学反应,反应速率最快的是( A )
组别 A B C D
E
盐酸浓度/mol.L-1 2.0 2.0 2.5 2.5
2.5
温度/℃ 25 30 30 50
50
锌粒状态 块状 粉末 粉末 块状
粉末
回答下列问题:
(1)探究浓度对化学反应速率的影响应选用哪两组实验数据BC。
(2)探究温度对化学反应速率的影响应选用哪两组实验数据 CE 。
2.用等质量的锌与等体积过量盐酸在不同条件下进行如下5组实验,测定收集相同条 件下等体积的氢气所用时间。
(3)探究接触面积对化学反应速率的影响应选用哪两组实验数据DE 。
(4)上述5组实验中测定收集等体积的氢气需要时间最短的是E 。
(5)实验完成后,某同学又用A组实验药品滴加两滴氯化铜,发现产生氢气的速率
明显加快,解释速率加快的原因是 Zn与Cu +反应生成Cu单质,在 锌块表面形成Zn—Cu原电池,加快化学反应速率
组别 A B C D
E
盐酸浓度/mol.L-1 2.0 2.0 2.5 2.5
2.5
温度/℃ 25 30 30 50
50
锌粒状态 块状 粉末 粉末 块状
粉末
2.用等质量的锌与等体积过量盐酸在不同条件下进行如下5组实验,测定收集相同条 件下等体积的氢气所用时间。
概念 表示方法 定义式 常用单位 注意事项
内因 温度 浓度 压强 催化剂
影响化学 反应速率 的因素
课堂小结
化学反应的速率
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
