6.2.2 化学电源及应用 (教学课件)- 高中化学人教版(2019)必修第二册(共17张PPT)
文档属性
| 名称 | 6.2.2 化学电源及应用 (教学课件)- 高中化学人教版(2019)必修第二册(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 592.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 12:52:19 | ||
图片预览






文档简介
(共17张PPT)
生活中常见的电池
干磨稳 涵酸职他 锂皂池
燃规鸱抛
化学电源
一、一次电池
放电后不可再充电,随着使用,反应物逐渐 被消耗到一定程度,电池不能再使用了。
电解质溶液制成胶状,不流动,也叫干电池。
放电后不能再充电
Zn(NH ) Cl : 二氯二氨合锌(Ⅱ),一种中性络合物,
氯离子和氨均为配位体
十
MnO(OH): 氢氧化氧锰,黑色固体,难溶于水
石墨棒
MnO 糊 ①锌筒为负极,过程中不断失电子。
NH Cl糊
锌筒 ②石墨棒为正极,过程中二氧化锰不断得电子被还原。
③NH Cl 糊作电解质。
1、普通锌锰干电池
总反应:Zn+2NH Cl+2MnO =Zn(NH ) Cl +2MnO(OH)
负极:Zn+2OH--2e~=Zn(OHD)
正极:2MnO +2H O+2e-=2MnO(OH)+2OH
①锌筒为负极,过程中不断失电子。
②二氧化锰为正极,过程中不断得电子被还原。 ③KOH作电解质。
十
锌 粉 和KOH 的混合物
MnO
金属外壳
2、碱性锌锰干电池
总反应:Zn+2MnO +2H O=2MnO(OH)+Zn(OH)
比普通锌锰干电池比能量高、储存电能时间长、性能好
· Zn+2OH--2e-=Zn(OH)
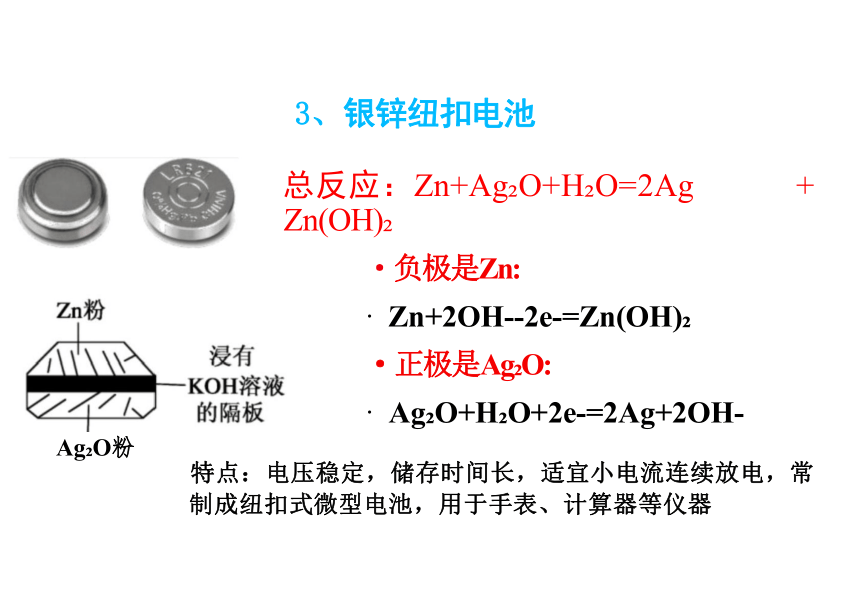
·正极是Ag O:
· Ag O+H O+2e-=2Ag+2OH-
Ag O粉
特点:电压稳定,储存时间长,适宜小电流连续放电,常
制成纽扣式微型电池,用于手表、计算器等仪器
3、银锌纽扣电池
总反应:Zn+Ag O+H O=2Ag +
Zn(OH)
·负极是Zn:
二、二次电池
(可充电电池、蓄电池)
特 点 :放电时所进行的氧化还原反应,在充电时 可以逆向进行,使电池恢复到放电前的状态。
实例:铅酸蓄电池、镍氢电池、锂离子电池等
应用:汽车;手机、笔记本电脑
能量转化:化 学 能
放电 充 电
电能
负极:Pb-2e+SO -=PbSO
正 极 :PbO +2e+4H++SO 2-=PbSO + 2H O
优点:可重复次数最多、使用方便、
电压稳定、安全可靠、价格低廉
缺点:比能量低、笨重、废弃电池污染环境
H SO 溶液
铅酸蓄电池
总反应:
放电
Pb+PbO +2H SO 2PbSO +2H O
充电
铅蓄电池构造示意图
三、燃料电池
利用氢气、天然气、甲醇、氨、肼、煤气等 燃料与氧气或空气进行电化学反应时释放出 来的化学能直接转化成电能的一类原电池。
目前燃料电池的能量转化率可达近80%,约 为火力发电的2倍。燃料电池的噪声及硫氧 化物、氮氧化物等废气污染都接近零。
“绿色发电站”
1、酸性氢氧燃料电池
总反应:2H +0 =2H O
负极:2H -4e-=4H+
正极:O +4H++4e-=2H O
2、碱性氢氧燃料电池
总反应:2H +O =2H O
负极:2H +40H--4er=4H O
正极:O +2H O+4e-=4OH-
连续电池:反应物不是储存在电
池内,燃料和氧化剂连续由外部 提供并在电极上反应,生成物被 不断排出,持续不断提供电能。
O (空气)
正极
电解质
→H O
H -
负极
H O*
H
练习:写出氢氧燃料电池的总反应方程式及电极反应式
①熔融Na O介质环境
总反应:2H +O =2H O
负极:H -2e-+O -— H O
正极:O +4e——2O -
②熔融Na CO 介质环境
总反应:2H +O =2H O
燃料电池电极反应式的书写
方法一:结合介质环境直接写电极反应式 总反应:燃料在氧气中的燃烧
正极:氧化剂(O )+n e-= 还原产物
①酸性溶液中与H+结合成H O O +4H++4e-=2H O
②碱性或中性溶液中与水结合成OH -O +2H O+4e-=40H-
③固态电解质(熔融金属氧化物,高温下能传导O -) O +4e-=2O -
④熔融碳酸盐与CO 结合形成CO 2-O +2CO +4e-=2CO -
固体电解质(高温下能传导O -)
或熔融碳酸盐环境下H转化为H O
固体电解质(高温下能传导O -)或
熔融碳酸盐环境下C将转化为CO
燃料电池电极反应式的书写
负极:还原剂(燃料)- n e-= 氧化产物
M 酸 性 溶 液
IV 碱性溶液 N
H+
H O
CO
CO 2-
酸性溶液
碱性溶液
碱性溶液
酸性溶液
H
燃料电池电极反应式的书写
方法二:
1、结合介质环境写总反应:燃料在氧气中的燃烧
2、写出正极反应式
3、负极=总反应-正极
O +4e +2CO ——2CO3- 熔融碳酸盐作介质
正极 O +4e-+2H O= 4OH 碱作介质
O +4e-— 2O - 熔融金属氧化物作介质
O +4e +4H+——2H O 酸作介质
将铂丝插入KOH溶液作电极,然后向两个电极上分别通
入甲烷和氧气,可以形成原电池,通入甲烷的一极为负极, 这一极的电极反应为 CH -8er+100H-=CO -+7H O
;
通入氧气的一极为 正极 ,电极反应为
O +4e-+2H O=4OH- --9
总反应为 CH +2O +2KOH=K CO +3H O
甲烷燃料电池
酸性条件:
总反应:CH +20 =CO +2H O
正极:20 +8H++8e~=4H O
负极:CH +2H O-8er=CO +8H+
碱性条件:
总反应:CH +20 +20H-=CO 2-+3H O
正极:20 +4H O+8e~=80H-
负极:CH +100H--8e~=CO -+7H O
练习:肼(N H ) 空气燃料电池
电解质为酸性时:
总反应方程式:N H +O =N +2H O
负极:N H -4e-+=N +4H+
正极:O +4e-+4H+=2H O
电解质为碱性时:
总反应方程式为:N H +O =N +2H O 负极:N H +4OH--4er=N +4H O
正极:O +4er+2H O=4OH-
我国拥有完全自主产权的氢氧燃料电池车已在北京奥运
会期间为运动员提供服务。某种氢氧燃料电池的电解液 为KOH 溶液,下列有关该电池的叙述不正确的是( D )
A. 正极反应式为:O,+2H,O+4e- 4OH-
B. 工作一段时间后,电解液中KOH 的物质的量不变
C. 总反应方程式为:2H,+O, 2H O
D. 该电池工作中,消耗了2.24 L H (标准状况),则有0.1 mol电子转移
生活中常见的电池
干磨稳 涵酸职他 锂皂池
燃规鸱抛
化学电源
一、一次电池
放电后不可再充电,随着使用,反应物逐渐 被消耗到一定程度,电池不能再使用了。
电解质溶液制成胶状,不流动,也叫干电池。
放电后不能再充电
Zn(NH ) Cl : 二氯二氨合锌(Ⅱ),一种中性络合物,
氯离子和氨均为配位体
十
MnO(OH): 氢氧化氧锰,黑色固体,难溶于水
石墨棒
MnO 糊 ①锌筒为负极,过程中不断失电子。
NH Cl糊
锌筒 ②石墨棒为正极,过程中二氧化锰不断得电子被还原。
③NH Cl 糊作电解质。
1、普通锌锰干电池
总反应:Zn+2NH Cl+2MnO =Zn(NH ) Cl +2MnO(OH)
负极:Zn+2OH--2e~=Zn(OHD)
正极:2MnO +2H O+2e-=2MnO(OH)+2OH
①锌筒为负极,过程中不断失电子。
②二氧化锰为正极,过程中不断得电子被还原。 ③KOH作电解质。
十
锌 粉 和KOH 的混合物
MnO
金属外壳
2、碱性锌锰干电池
总反应:Zn+2MnO +2H O=2MnO(OH)+Zn(OH)
比普通锌锰干电池比能量高、储存电能时间长、性能好
· Zn+2OH--2e-=Zn(OH)
·正极是Ag O:
· Ag O+H O+2e-=2Ag+2OH-
Ag O粉
特点:电压稳定,储存时间长,适宜小电流连续放电,常
制成纽扣式微型电池,用于手表、计算器等仪器
3、银锌纽扣电池
总反应:Zn+Ag O+H O=2Ag +
Zn(OH)
·负极是Zn:
二、二次电池
(可充电电池、蓄电池)
特 点 :放电时所进行的氧化还原反应,在充电时 可以逆向进行,使电池恢复到放电前的状态。
实例:铅酸蓄电池、镍氢电池、锂离子电池等
应用:汽车;手机、笔记本电脑
能量转化:化 学 能
放电 充 电
电能
负极:Pb-2e+SO -=PbSO
正 极 :PbO +2e+4H++SO 2-=PbSO + 2H O
优点:可重复次数最多、使用方便、
电压稳定、安全可靠、价格低廉
缺点:比能量低、笨重、废弃电池污染环境
H SO 溶液
铅酸蓄电池
总反应:
放电
Pb+PbO +2H SO 2PbSO +2H O
充电
铅蓄电池构造示意图
三、燃料电池
利用氢气、天然气、甲醇、氨、肼、煤气等 燃料与氧气或空气进行电化学反应时释放出 来的化学能直接转化成电能的一类原电池。
目前燃料电池的能量转化率可达近80%,约 为火力发电的2倍。燃料电池的噪声及硫氧 化物、氮氧化物等废气污染都接近零。
“绿色发电站”
1、酸性氢氧燃料电池
总反应:2H +0 =2H O
负极:2H -4e-=4H+
正极:O +4H++4e-=2H O
2、碱性氢氧燃料电池
总反应:2H +O =2H O
负极:2H +40H--4er=4H O
正极:O +2H O+4e-=4OH-
连续电池:反应物不是储存在电
池内,燃料和氧化剂连续由外部 提供并在电极上反应,生成物被 不断排出,持续不断提供电能。
O (空气)
正极
电解质
→H O
H -
负极
H O*
H
练习:写出氢氧燃料电池的总反应方程式及电极反应式
①熔融Na O介质环境
总反应:2H +O =2H O
负极:H -2e-+O -— H O
正极:O +4e——2O -
②熔融Na CO 介质环境
总反应:2H +O =2H O
燃料电池电极反应式的书写
方法一:结合介质环境直接写电极反应式 总反应:燃料在氧气中的燃烧
正极:氧化剂(O )+n e-= 还原产物
①酸性溶液中与H+结合成H O O +4H++4e-=2H O
②碱性或中性溶液中与水结合成OH -O +2H O+4e-=40H-
③固态电解质(熔融金属氧化物,高温下能传导O -) O +4e-=2O -
④熔融碳酸盐与CO 结合形成CO 2-O +2CO +4e-=2CO -
固体电解质(高温下能传导O -)
或熔融碳酸盐环境下H转化为H O
固体电解质(高温下能传导O -)或
熔融碳酸盐环境下C将转化为CO
燃料电池电极反应式的书写
负极:还原剂(燃料)- n e-= 氧化产物
M 酸 性 溶 液
IV 碱性溶液 N
H+
H O
CO
CO 2-
酸性溶液
碱性溶液
碱性溶液
酸性溶液
H
燃料电池电极反应式的书写
方法二:
1、结合介质环境写总反应:燃料在氧气中的燃烧
2、写出正极反应式
3、负极=总反应-正极
O +4e +2CO ——2CO3- 熔融碳酸盐作介质
正极 O +4e-+2H O= 4OH 碱作介质
O +4e-— 2O - 熔融金属氧化物作介质
O +4e +4H+——2H O 酸作介质
将铂丝插入KOH溶液作电极,然后向两个电极上分别通
入甲烷和氧气,可以形成原电池,通入甲烷的一极为负极, 这一极的电极反应为 CH -8er+100H-=CO -+7H O
;
通入氧气的一极为 正极 ,电极反应为
O +4e-+2H O=4OH- --9
总反应为 CH +2O +2KOH=K CO +3H O
甲烷燃料电池
酸性条件:
总反应:CH +20 =CO +2H O
正极:20 +8H++8e~=4H O
负极:CH +2H O-8er=CO +8H+
碱性条件:
总反应:CH +20 +20H-=CO 2-+3H O
正极:20 +4H O+8e~=80H-
负极:CH +100H--8e~=CO -+7H O
练习:肼(N H ) 空气燃料电池
电解质为酸性时:
总反应方程式:N H +O =N +2H O
负极:N H -4e-+=N +4H+
正极:O +4e-+4H+=2H O
电解质为碱性时:
总反应方程式为:N H +O =N +2H O 负极:N H +4OH--4er=N +4H O
正极:O +4er+2H O=4OH-
我国拥有完全自主产权的氢氧燃料电池车已在北京奥运
会期间为运动员提供服务。某种氢氧燃料电池的电解液 为KOH 溶液,下列有关该电池的叙述不正确的是( D )
A. 正极反应式为:O,+2H,O+4e- 4OH-
B. 工作一段时间后,电解液中KOH 的物质的量不变
C. 总反应方程式为:2H,+O, 2H O
D. 该电池工作中,消耗了2.24 L H (标准状况),则有0.1 mol电子转移
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
