6.1.2化学反应与热能 (教学课件)- 高中化学人教版(2019)必修第二册(共36张PPT)
文档属性
| 名称 | 6.1.2化学反应与热能 (教学课件)- 高中化学人教版(2019)必修第二册(共36张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 12:54:26 | ||
图片预览











文档简介
(共36张PPT)
第一节三化学反应与能量变化
化学能与热能(第二课时)
普 通 高 中 牧 书
化学
必 修
第二册
现代社会的一切活动都离不开能量,化学反应在发生
物质变化的同时伴随有能量变化,是人类获取能量的重要 途径。
为了更好地利用化学反应中的物质和能量变化,在化
学研究和工业生产中还需要关注化学反应的快慢和程度。 能量、速率与限度是认识和研究化学反应的重要视角。
第六章
化学反应与能量
· 化学反应与能量变化 · 化学反应的速率与限度
二:化学能与热能的相互转化
1.两条基本的自然规律
(1)质量守恒定律:自然界的物质发生转化时,总质量保持 不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式 的能量,但体系包含的总能量不变。
化学物质的化学能通过化学反应,进行生活、生产和科
研,为提供了人类生存和发展所需要的能量和动力;
而热能转化为化学能,使很多化学反应得以发生,为化工 生产、研究新物质提供了不可或缺的条件和途径。
煤、石油、天然气的燃烧
化学反应
高温冶炼金属、分解化合物
化学能
热 能
(1)吸热反应和放热反应
①吸热反应: 吸收热量的化学反应。
②放热反应: 放出热量的化学反应。
放热反应
吸热反应
定义 释放热量的化学反应
吸收热量的化学反应
宏观 解释 反应物具有的总能量大 于生成物具有的总能量
反应物具有的总能量小于 生成物具有的总能量
微观 解释 生成物分子成键时释放 的总能量大于反应物分 子断键时吸收的总能量
生成物分子成键时释放的 总能量小于反应物分子断 键时吸收的总能量
(2)吸热反应与放热反应的比较
图示 反应物 △E 生成物 反应过程
肇
生成物
反应物
E
反应过程
实例 N a O H 十 H C l = = = NaCl+H O
Ba(OH) ·8H O+2NH Cl===
BaC l +2NH 个+10H O
能量
规 律 吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量的相对大小判断——决定因素。
若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应。
(2)根据化学键断裂或形成时的能量变化判断——用于计算。
若断裂反应物中的化学键所吸收的总能量小于形成生成物中化学键所放出 的总能量,属于放热反应,反之是吸热反应。
(3)根据反应物和生成物的相对稳定性判断。
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之 为吸热反应。
(4)根据反应条件判断。凡是持续加热才能进行的反应一般是吸热反应。
特别提醒
(1)三个“不一定”:
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;
②放热反应常温下不一定容易发生,如铝热反应;
③吸热反应也不一定需要加热,如Ba(OH) ·8H O晶体和NH Cl 晶体的反应。
(2)吸热反应和放热反应都是化学变化。NaOH 固体溶于水是放热过程,但不 是放热反应;升华、蒸发、蒸馏等过程是吸热过程,但不是吸热反应。
(3)吸热反应不一定需要加热,放热反应不一定不需要加热
(4)化学变化一定伴随着能量变化,有能量变化不一定是化学变化
1判断正误
(1)苛性钠溶于水放出热量,该变化为放热反应(× )
(2)化学反应既有物质变化,又有能量变化( )
(3)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全
部转化为热能(× )
(4)吸热反应需要加热才能进行(× )
(5)火药爆炸时所释放的能量包括热、光、声、机械能等多种能 量形式( √ )
2.根据日常生活和回忆已学化学反应,对下列变化按吸热或放
热的标准分类:
①钠投入水中②煅烧石灰石制生石灰③食物腐烂④炸药 爆炸⑤氢气在氯气中燃烧⑥生石灰与水作用制熟石灰⑦ 碳与水蒸气制取水煤气(CO 和H )⑧ 硫酸与氢氧化钠的中和反 应⑨氦气球受热爆炸
(1)属于放热反应的有:①③④⑤⑥⑧( 填序号,下同)。
(2)属于吸热反应的有:②⑦ 。
3.把下列物质分别加入装有水的锥形瓶里,立即塞紧带U形管的塞子,已知
U 形管内预先装有少量水(为使水容易观察,预先染成红色),如图所示,结 果U形管左边液面升高,则加入的物质可能是
A.NaOH固体
B.浓H SO
C. NH NO 晶体
D.Na O 固体
解析 U 形管左侧液面升高,原因只能是锥形瓶内气体压强减小,造成压强 减小的因素只能是温度降低。NaOH 固体溶于水、浓H SO 稀释温度均升高, NH NO 晶体溶于水温度降低,Na O 和水反应放热且有气体生成。
123
【 规 律 方 法 】放热反应和吸热反应判断“四”方法
(1)依据反应条件判断。通常需要持续加热的反应为吸热反应。
(2)依据能量变化图象判断。反应物的总能量大于生成物的总能量, 则反应为放热反应;反之,则为吸热反应。
(3)依据断键和成键所吸收和释放的能量数据判断。如果旧键断裂 吸收的能量大于新键形成释放的能量,则为吸热反应;反之,为放热 反应。
(4)经验判断法:根据常见的放热反应、吸热反应的类型判断。
3.化学能与热能相互转化的意义
化学能过程(1)热能
过程(2)
过程(1):提供了人类生存和发展所需要的 能量和动力。
过程(2):人类进行化工生产、研制新物质不可或缺的条件
和途径。
能源是人类赖以生存和发展的物
质基础,我们每时每刻、分分秒秒都 离不开它。迄今为止,人类所能利用 的能源主要是化学能、电能、以及核 能等等。但是,由于人类大量开发和 浪费资源,造成了资源的不合理利用 从而引发了不可回避的能源危机。
三、化学能的应用
5.1%
2.1%
16.6%
□煤
□石油
□天然气 □水电
76.2%
我国化石燃料和水电能源消耗构成图
常见的能源主要有以下十种:
太阳能、化石能源、水能、风能、潮汝能、 地热能、生物质能、核能以及氢能。
树利用光能解造
化合物,后者诸
备了化学能
树木燃体时,所 储存的化学能 放为热便
太阳的疆射德 被级收,使水 英发并上升
大阳的辐射能从
大阳钢达地球
动的水型动水力 发电机,将水的动 能材换为电度
水的一部分势 能转换为雨演 降落的动能
电能转换为光能,用 于街道和住宅的照明
图22-太阳能与人类生存
形成云的水嘉 气具有势能
1000
750
500
250
0
(×10 kj/d)
社会发展与能源利用
原始社会人均耗能 8×10 kJ/d
使用简单机械工业社会人均耗能 3×10 kJ/d
早期的农业社会人均耗能
5×10 kJ/d
用电脑控制生产的
现代信息社会人均耗能
I×10"kJ/d
业化的进程
主要能源 可再生能源和清洁能源(绿色能源)主要 多能源 包括太阳能、氢能、核能、生物质能等 结构时期 主要贡献提高了能源的利用率,最大限度减少
对环境的污染
进化和物质文明的发展
化石燃料:煤、石油、天然气
推动了近代产业革命,加速了现代工
人类利用能源的三个阶段
柴草 时期
化石能 源时期
主要贡献推动了人类文明的进步,促进了人的
主要能源
主要贡献
树枝、杂草
主要能源
中国古代制陶图
柴草时期
1.化石燃料利用过程中亟待解决的两方面问题
(1)一是其短期内不可再生,储量有限;
(2)二是煤和石油产品燃烧排放的粉尘、SO 、NO、CO 等是大气污染物的 主要来源。
2.在燃料利用过程中,节能的主要环节:
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰 等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以 及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效 提高能量利用率。
一个是燃料燃烧阶段,可通过改进锅炉的炉型 和燃料空气比、清理积灰等方法提高燃料的燃 烧效率;
另一个环节是能量利用阶段,可通过使用节能 灯,改进电动机的材料和结构,以及发电厂、 钢铁厂余热与城市供热联产等措施促进能源循 环利用,有效提高能源利用率。
寻找新能源太阳能、风能、
地热能、海洋能 和氢能等
3.解决 办法
节能
4.新能源
(1)特点:资源丰富、可以再生,对环境无污染。
(2)人们比较关注的新能源:太阳能、风 能、地热能、 海洋能和氢能等。
【思考】2019中国(山西)国际清洁能源博览会于2019年6月28日
上午在太原开幕。
本次展会以“清洁低碳、绿色发展”为主题,聚焦煤炭清洁 利用、新能源、储能、节能环保等领域,展示新技术新产品新应 用,搭建中西部清洁能源及设备供需平台,促进煤改电、煤改气、 煤改清洁采暖在中西部的实施,加强雾霾的治理,有效改善呼吸 环境。
(1)提高燃料的燃烧效率应该从哪些方面考虑
提 示 :使燃料与氧气充分接触,如将煤粉碎、液化和气化;通入充足 的氧气。
(2)日常生产、生活中常常采用下列能源:
①煤;②石油;③天然气;④太阳能;⑤水能;⑥氢能;⑦核能;⑧风 能;⑨地热能等,属于清洁能源的有哪些
提 示 :④⑤⑥⑦⑧⑨。清洁能源即绿色能源,是指不排放污染物、能够直接 用于生产生活的能源,它包括核能和可再生能源。可再生能源是指原材料 可以再生的能源,如水力发电、风力发电、太阳能、水能、生物能(沼气)、 地热能(包括地源和水源)、海潮能等能源。
[思考]1.有化学键断裂的变化一定是化学变化吗
[提示] 有化学键断裂的变化不一定是化学变化。如:HCl 溶 于水时,在水分子的作用下,H-Cl 键被破坏,但是无新化学键的 生成,不是化学变化。
2.放热反应是否一定不需加热 吸热反应是否一定必须加热
[提示] 根据2Na+O △(=====)Na O 和NH CI与
Ba(OH) ·8H O 反应可知,放热反应可能需要加热,吸热反 应也可能不需加热。因此化学反应是吸热还是放热与反 应条件无关,而是决定于反应物总能量与生成物总能量的
相对大小。
3. (1)物质发生化学反应都伴随着能量的变化,那么有能量变化的
物质变化一定是化学变化吗
(2)化学反应中的能量变化是否只表现为热量的变化
[提示](1)不一定。物质发生物理变化时也会伴有能量变化。
如浓硫酸的稀释、氢氧化钠的溶解、冰融化成液态的水等都有 能量的变化。
(2)不是。化学反应中一定有能量的变化,通常表现为热量的变化 ,但也可能有其他的能量形式,如电能或光能等。
概念
实验探究
异 同
判断方法
实例
柴草时期
化石能源时期
多能源结构时期
吸热反 应与放 热反应
人类利 用能源
的三个
阶段
化学键的断
裂与形成
反应物和 生成物的
总能量
化学键 与化学 反应中 能量变 化的关
系
质量守恒定律
能量守恒定律
微观 角度
宏观 角度
两个基本 的自然规
律
化学能与热能
1.下列变化过程需要吸收能量的是( D )
A.氢气球遇火发生爆炸
B .向污染的河水中投放生石灰
解析 氢气的燃烧爆炸、CaO与水的反应、形成化学键的过程都要放 出能量,断裂化学键时需要吸收能量。
C.
D.
2.现在人类直接利用的主要化石能源是( D )
A.太阳能 B. 核能 C. 氢 能 D. 煤
解析 化石能源包括石油、煤和天然气。
3.如图为某化学反应的能量—反应进程图,由此可判断该
反应( B ) 能
量
生成物
反应物
0 反应进程
A.为放热反应 B. 为吸热反应
C. 属于燃烧反应 D. 属于中和反应
解 析 由图像可知该反应反应物的总能量低于生成物的总能量,该反 应是吸热反应,而物质的燃烧反应、酸碱中和反应是放热反应。
4.下列有关能量转化的认识不正确的是( D )
A.通过植物的光合作用,太阳能转化为化学能
B.人类使用照明设备,将电能转化为光能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能 量转化更为合理、有效
D.燃料燃烧,只是将化学能转化为了热能
解 析 A 项,植物的光合作用是在太阳光作用下合成了新物质,太阳能转化为化 学能,正确;B 项,人类使用照明设备照明是电能转化为光能,正确;C 项,生物体内 的化学变化过程在能量转化上更为合理、有效,正确;D 项,燃烧是剧烈的发光放热的 氧化还原反应,反应过程中可产生光能、热能等,错误。
第一节三化学反应与能量变化
化学能与热能(第二课时)
普 通 高 中 牧 书
化学
必 修
第二册
现代社会的一切活动都离不开能量,化学反应在发生
物质变化的同时伴随有能量变化,是人类获取能量的重要 途径。
为了更好地利用化学反应中的物质和能量变化,在化
学研究和工业生产中还需要关注化学反应的快慢和程度。 能量、速率与限度是认识和研究化学反应的重要视角。
第六章
化学反应与能量
· 化学反应与能量变化 · 化学反应的速率与限度
二:化学能与热能的相互转化
1.两条基本的自然规律
(1)质量守恒定律:自然界的物质发生转化时,总质量保持 不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式 的能量,但体系包含的总能量不变。
化学物质的化学能通过化学反应,进行生活、生产和科
研,为提供了人类生存和发展所需要的能量和动力;
而热能转化为化学能,使很多化学反应得以发生,为化工 生产、研究新物质提供了不可或缺的条件和途径。
煤、石油、天然气的燃烧
化学反应
高温冶炼金属、分解化合物
化学能
热 能
(1)吸热反应和放热反应
①吸热反应: 吸收热量的化学反应。
②放热反应: 放出热量的化学反应。
放热反应
吸热反应
定义 释放热量的化学反应
吸收热量的化学反应
宏观 解释 反应物具有的总能量大 于生成物具有的总能量
反应物具有的总能量小于 生成物具有的总能量
微观 解释 生成物分子成键时释放 的总能量大于反应物分 子断键时吸收的总能量
生成物分子成键时释放的 总能量小于反应物分子断 键时吸收的总能量
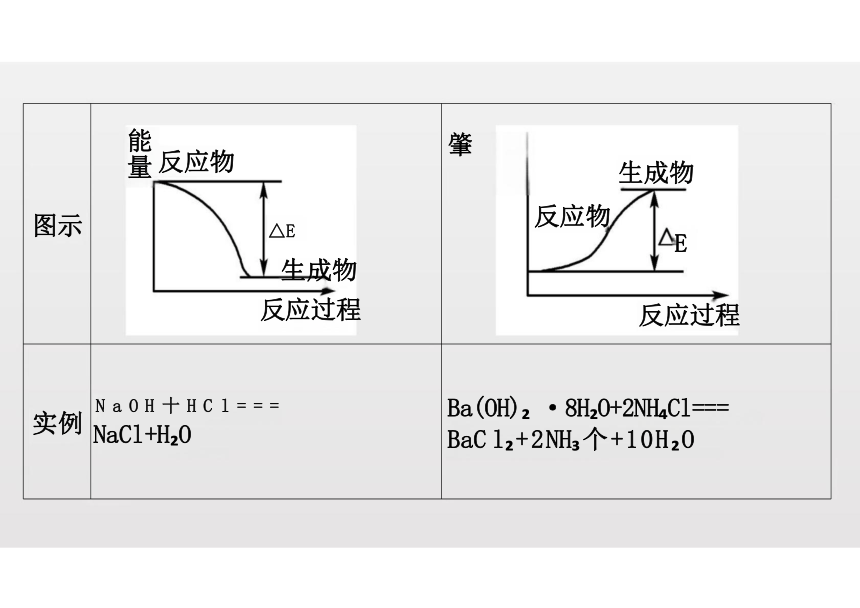
(2)吸热反应与放热反应的比较
图示 反应物 △E 生成物 反应过程
肇
生成物
反应物
E
反应过程
实例 N a O H 十 H C l = = = NaCl+H O
Ba(OH) ·8H O+2NH Cl===
BaC l +2NH 个+10H O
能量
规 律 吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量的相对大小判断——决定因素。
若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应。
(2)根据化学键断裂或形成时的能量变化判断——用于计算。
若断裂反应物中的化学键所吸收的总能量小于形成生成物中化学键所放出 的总能量,属于放热反应,反之是吸热反应。
(3)根据反应物和生成物的相对稳定性判断。
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之 为吸热反应。
(4)根据反应条件判断。凡是持续加热才能进行的反应一般是吸热反应。
特别提醒
(1)三个“不一定”:
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;
②放热反应常温下不一定容易发生,如铝热反应;
③吸热反应也不一定需要加热,如Ba(OH) ·8H O晶体和NH Cl 晶体的反应。
(2)吸热反应和放热反应都是化学变化。NaOH 固体溶于水是放热过程,但不 是放热反应;升华、蒸发、蒸馏等过程是吸热过程,但不是吸热反应。
(3)吸热反应不一定需要加热,放热反应不一定不需要加热
(4)化学变化一定伴随着能量变化,有能量变化不一定是化学变化
1判断正误
(1)苛性钠溶于水放出热量,该变化为放热反应(× )
(2)化学反应既有物质变化,又有能量变化( )
(3)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全
部转化为热能(× )
(4)吸热反应需要加热才能进行(× )
(5)火药爆炸时所释放的能量包括热、光、声、机械能等多种能 量形式( √ )
2.根据日常生活和回忆已学化学反应,对下列变化按吸热或放
热的标准分类:
①钠投入水中②煅烧石灰石制生石灰③食物腐烂④炸药 爆炸⑤氢气在氯气中燃烧⑥生石灰与水作用制熟石灰⑦ 碳与水蒸气制取水煤气(CO 和H )⑧ 硫酸与氢氧化钠的中和反 应⑨氦气球受热爆炸
(1)属于放热反应的有:①③④⑤⑥⑧( 填序号,下同)。
(2)属于吸热反应的有:②⑦ 。
3.把下列物质分别加入装有水的锥形瓶里,立即塞紧带U形管的塞子,已知
U 形管内预先装有少量水(为使水容易观察,预先染成红色),如图所示,结 果U形管左边液面升高,则加入的物质可能是
A.NaOH固体
B.浓H SO
C. NH NO 晶体
D.Na O 固体
解析 U 形管左侧液面升高,原因只能是锥形瓶内气体压强减小,造成压强 减小的因素只能是温度降低。NaOH 固体溶于水、浓H SO 稀释温度均升高, NH NO 晶体溶于水温度降低,Na O 和水反应放热且有气体生成。
123
【 规 律 方 法 】放热反应和吸热反应判断“四”方法
(1)依据反应条件判断。通常需要持续加热的反应为吸热反应。
(2)依据能量变化图象判断。反应物的总能量大于生成物的总能量, 则反应为放热反应;反之,则为吸热反应。
(3)依据断键和成键所吸收和释放的能量数据判断。如果旧键断裂 吸收的能量大于新键形成释放的能量,则为吸热反应;反之,为放热 反应。
(4)经验判断法:根据常见的放热反应、吸热反应的类型判断。
3.化学能与热能相互转化的意义
化学能过程(1)热能
过程(2)
过程(1):提供了人类生存和发展所需要的 能量和动力。
过程(2):人类进行化工生产、研制新物质不可或缺的条件
和途径。
能源是人类赖以生存和发展的物
质基础,我们每时每刻、分分秒秒都 离不开它。迄今为止,人类所能利用 的能源主要是化学能、电能、以及核 能等等。但是,由于人类大量开发和 浪费资源,造成了资源的不合理利用 从而引发了不可回避的能源危机。
三、化学能的应用
5.1%
2.1%
16.6%
□煤
□石油
□天然气 □水电
76.2%
我国化石燃料和水电能源消耗构成图
常见的能源主要有以下十种:
太阳能、化石能源、水能、风能、潮汝能、 地热能、生物质能、核能以及氢能。
树利用光能解造
化合物,后者诸
备了化学能
树木燃体时,所 储存的化学能 放为热便
太阳的疆射德 被级收,使水 英发并上升
大阳的辐射能从
大阳钢达地球
动的水型动水力 发电机,将水的动 能材换为电度
水的一部分势 能转换为雨演 降落的动能
电能转换为光能,用 于街道和住宅的照明
图22-太阳能与人类生存
形成云的水嘉 气具有势能
1000
750
500
250
0
(×10 kj/d)
社会发展与能源利用
原始社会人均耗能 8×10 kJ/d
使用简单机械工业社会人均耗能 3×10 kJ/d
早期的农业社会人均耗能
5×10 kJ/d
用电脑控制生产的
现代信息社会人均耗能
I×10"kJ/d
业化的进程
主要能源 可再生能源和清洁能源(绿色能源)主要 多能源 包括太阳能、氢能、核能、生物质能等 结构时期 主要贡献提高了能源的利用率,最大限度减少
对环境的污染
进化和物质文明的发展
化石燃料:煤、石油、天然气
推动了近代产业革命,加速了现代工
人类利用能源的三个阶段
柴草 时期
化石能 源时期
主要贡献推动了人类文明的进步,促进了人的
主要能源
主要贡献
树枝、杂草
主要能源
中国古代制陶图
柴草时期
1.化石燃料利用过程中亟待解决的两方面问题
(1)一是其短期内不可再生,储量有限;
(2)二是煤和石油产品燃烧排放的粉尘、SO 、NO、CO 等是大气污染物的 主要来源。
2.在燃料利用过程中,节能的主要环节:
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰 等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以 及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效 提高能量利用率。
一个是燃料燃烧阶段,可通过改进锅炉的炉型 和燃料空气比、清理积灰等方法提高燃料的燃 烧效率;
另一个环节是能量利用阶段,可通过使用节能 灯,改进电动机的材料和结构,以及发电厂、 钢铁厂余热与城市供热联产等措施促进能源循 环利用,有效提高能源利用率。
寻找新能源太阳能、风能、
地热能、海洋能 和氢能等
3.解决 办法
节能
4.新能源
(1)特点:资源丰富、可以再生,对环境无污染。
(2)人们比较关注的新能源:太阳能、风 能、地热能、 海洋能和氢能等。
【思考】2019中国(山西)国际清洁能源博览会于2019年6月28日
上午在太原开幕。
本次展会以“清洁低碳、绿色发展”为主题,聚焦煤炭清洁 利用、新能源、储能、节能环保等领域,展示新技术新产品新应 用,搭建中西部清洁能源及设备供需平台,促进煤改电、煤改气、 煤改清洁采暖在中西部的实施,加强雾霾的治理,有效改善呼吸 环境。
(1)提高燃料的燃烧效率应该从哪些方面考虑
提 示 :使燃料与氧气充分接触,如将煤粉碎、液化和气化;通入充足 的氧气。
(2)日常生产、生活中常常采用下列能源:
①煤;②石油;③天然气;④太阳能;⑤水能;⑥氢能;⑦核能;⑧风 能;⑨地热能等,属于清洁能源的有哪些
提 示 :④⑤⑥⑦⑧⑨。清洁能源即绿色能源,是指不排放污染物、能够直接 用于生产生活的能源,它包括核能和可再生能源。可再生能源是指原材料 可以再生的能源,如水力发电、风力发电、太阳能、水能、生物能(沼气)、 地热能(包括地源和水源)、海潮能等能源。
[思考]1.有化学键断裂的变化一定是化学变化吗
[提示] 有化学键断裂的变化不一定是化学变化。如:HCl 溶 于水时,在水分子的作用下,H-Cl 键被破坏,但是无新化学键的 生成,不是化学变化。
2.放热反应是否一定不需加热 吸热反应是否一定必须加热
[提示] 根据2Na+O △(=====)Na O 和NH CI与
Ba(OH) ·8H O 反应可知,放热反应可能需要加热,吸热反 应也可能不需加热。因此化学反应是吸热还是放热与反 应条件无关,而是决定于反应物总能量与生成物总能量的
相对大小。
3. (1)物质发生化学反应都伴随着能量的变化,那么有能量变化的
物质变化一定是化学变化吗
(2)化学反应中的能量变化是否只表现为热量的变化
[提示](1)不一定。物质发生物理变化时也会伴有能量变化。
如浓硫酸的稀释、氢氧化钠的溶解、冰融化成液态的水等都有 能量的变化。
(2)不是。化学反应中一定有能量的变化,通常表现为热量的变化 ,但也可能有其他的能量形式,如电能或光能等。
概念
实验探究
异 同
判断方法
实例
柴草时期
化石能源时期
多能源结构时期
吸热反 应与放 热反应
人类利 用能源
的三个
阶段
化学键的断
裂与形成
反应物和 生成物的
总能量
化学键 与化学 反应中 能量变 化的关
系
质量守恒定律
能量守恒定律
微观 角度
宏观 角度
两个基本 的自然规
律
化学能与热能
1.下列变化过程需要吸收能量的是( D )
A.氢气球遇火发生爆炸
B .向污染的河水中投放生石灰
解析 氢气的燃烧爆炸、CaO与水的反应、形成化学键的过程都要放 出能量,断裂化学键时需要吸收能量。
C.
D.
2.现在人类直接利用的主要化石能源是( D )
A.太阳能 B. 核能 C. 氢 能 D. 煤
解析 化石能源包括石油、煤和天然气。
3.如图为某化学反应的能量—反应进程图,由此可判断该
反应( B ) 能
量
生成物
反应物
0 反应进程
A.为放热反应 B. 为吸热反应
C. 属于燃烧反应 D. 属于中和反应
解 析 由图像可知该反应反应物的总能量低于生成物的总能量,该反 应是吸热反应,而物质的燃烧反应、酸碱中和反应是放热反应。
4.下列有关能量转化的认识不正确的是( D )
A.通过植物的光合作用,太阳能转化为化学能
B.人类使用照明设备,将电能转化为光能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能 量转化更为合理、有效
D.燃料燃烧,只是将化学能转化为了热能
解 析 A 项,植物的光合作用是在太阳光作用下合成了新物质,太阳能转化为化 学能,正确;B 项,人类使用照明设备照明是电能转化为光能,正确;C 项,生物体内 的化学变化过程在能量转化上更为合理、有效,正确;D 项,燃烧是剧烈的发光放热的 氧化还原反应,反应过程中可产生光能、热能等,错误。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
