6.2.3化学反应限度 (教学课件)- 高中化学人教版(2019)必修第二册(共18张PPT)
文档属性
| 名称 | 6.2.3化学反应限度 (教学课件)- 高中化学人教版(2019)必修第二册(共18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
一定条件下,分别对反应C(s)+CO (g)=2CO(g) 进行如下操作:
①升高反应体系的温度;②减小CO 的浓度;③缩小反应体系的体 积;④减小压强。
上述措施中一定能使反应速率显著变大的是( D )
A.①②③④ B.①③④ C.①② D.①③
课前检查
学习评价1
概念辨析
【思考与讨论】
1、为什么尾气中总是有CO
2、为什么高炉增高后,尾气中
CO 的含量没有改变
法国化学家勒夏特列( H.-L.Le Chatelier,
1850-1936 )经过深入的研究,才将这
一谜底揭开。原来,产生上述现象的原
因 是 :C+CO —2C0 是一个可逆反应,
并且自下而上发生在高炉中有焦炭的地方。
后来的研究证明,在高炉中Fe O 与C O反应
也不能全部转化为Fe 和CO
炼铁高炉尾气之谜:
高炉炼铁的主要反应是:
其中产生CO 的反应是:
生产中炼制生铁所需焦炭的实际用量, 远高于按照化学方程式计算所需的量,而且 从高炉炉顶出来的气体中总是含有没有利用 的CO 。开始,炼铁工程师们认为是CO 与 铁矿石接触不充分造成的,于是设法增加 高炉的高度。然而,令人吃惊的是,高炉 增高后,高炉尾气中CO 的比例竟然没有改 变。这成了炼铁技术中的科学悬念,人们一
情境引入
第六章化学反应与能量
第二节化学反应的速率与限度
第3课时化学反应限度 教学目标
1.知道可逆反应的概念及特点。
2.理解可逆反应的最大限度是达到化学平衡 状态。
知识回顾
可逆反应:
1.定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进 行的反应。
注:向生成物方向进行的反应叫做正反应, 反应物 逆反应 生成物
向反应物方向进行的反应叫做逆反应。
书写可逆反应的化学方程式时,不用“===”,用“— “
2.特征: 双向性 反应物 正向反应 生成物
逆向反应
双同性 —正、逆反应是在同一条件下同时进行的
共存性—反应物和生成物同时存在,反应物转化率小于100%
正反应
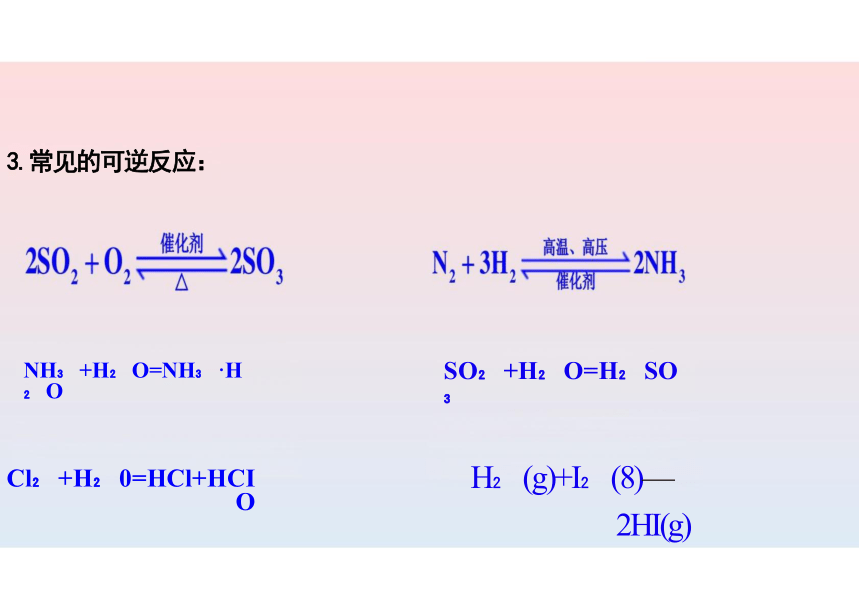
3.常见的可逆反应:
NH +H O=NH ·H O
Cl +H 0=HCl+HCIO
SO +H O=H SO
H (g)+I (8)—2HI(g)
√ 学习评价1 概念辨析 课堂练习
1.对于可逆反应2SO +O 催化剂 2SO , 在混合气体中充入一定量的18O , 足 够长的时间后,180原子( D )
A.只存在于O 中 B.只存在于O 和SO 中
C.只存在于O 和SO 中 D.存在于SO 、O 和SO 中
2.14CO +C— CO, 达到化学平衡后,平衡混合物中含14C 的粒子
有14CO 、 4C、 CO。
一、化学反应的限度
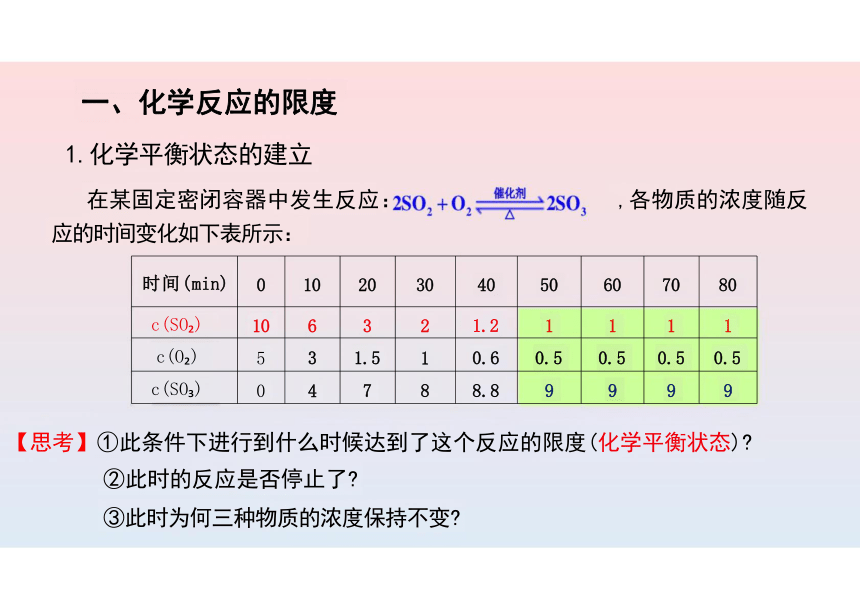
1.化学平衡状态的建立
在某固定密闭容器中发生反应: ,各物质的浓度随反
应的时间变化如下表所示:
时间(min) 0 10 20 30 40 50 60 70
80
c(SO ) 10 6 3 2 1.2 1 1 1
1
c(O ) 5 3 1.5 1 0.6 0.5 0.5 0.5
0.5
c(SO ) 0 4 7 8 8.8 9 9 9
9
【思考】①此条件下进行到什么时候达到了这个反应的限度(化学平衡状态)
②此时的反应是否停止了
③此时为何三种物质的浓度保持不变
开始时 c(SO )、c(O )最大,→v(正)最大,
c(SO )=0→v(逆)=0 v( 正 ) 平衡状态
反应过程中 v(逆)
c(SO )、c(O )逐渐减小 ,v(正)逐渐减小,0 t 时间(t)
c(SO )逐渐增大,v(逆逐渐增大
正逆反应都进行,v(逆)≠0, v(正)>v(逆)
反应到t 时刻
v(正)=v(逆) 动态平衡
化学平衡的建立过程
反应速率
V正最大
V逆为0
V正逐渐减小
逆逐渐增大
V正=v逆≠0
正反应
逆反应
时 间
反应物浓度最大 生成物浓度为0
反应物浓度减小 生成物浓度增大
各物质的浓度 不再改变
生成物
反应物
→时间
反应
开始
反应
过程
达到
平衡
0
浓度
速率
0
2.化学平衡状态的定义
在一定条件下,可逆反应中,当正、逆两个方向的反应速率相等时,反应物 的浓度和生成物的浓度都不在改变,达到了一种表面静止的状态,我们称之 为“化学平衡状态”。
化学平衡状态是可逆反应在一定条件下所能达到或完成的最大程度,即该反 应的限度。
化学反应的限度决定了反应物在一定条件下的最大转化率。
转化率=(已被转化的反应物的物质的量/反应物初始的物质的量)×100%
3.特征
达到乎衡
V 正=V
逆
时间
t
条件改变,原平衡被破坏,在新的条件下 建立新的平衡
可逆反应
v(正)=v(逆)≠0
动态平衡
判断可逆反应是 否达到平衡状态 的标志。
逆(前提)
等(本质)
动(特点)
定(结果)各组分的浓度保持不变
V 正
V逆
0 t
变(发展)
应 速 率
反A
学习评价1 概念辨析 课堂练习
3.(1)1 mol N 和3 mol H 在一定条件下可完全生成2 mol NH ×)
(2)在一定条件下, 一个可逆反应达到的平衡状态就是该反应所能达到的最大
限度( √)
(3)化学反应在一定条件下建立平衡状态时,化学反应将会停止(
(4)一定条件,可以通过延长化学反应的时间来改变反应物的最大转化率 (
(5)可逆反应达到平衡状态时,各反应物、生成物的浓度相等 (
(6)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速 率和生成速率相等,若用不同物质表示时,反应速率不一定相等 ()
4.对于化学反应的限度的叙述,错误的是( D )
A. 任何可逆反应都有一定的限度
B. 化学反应达到限度时,正逆反应速率相等
C. 化学反应的限度与时间的长短无关
D. 化学反应的限度是不可改变的
提高原料利用率
促进有利反应
提高反应速率
降低 反应速率
抑制有害反应减少甚至消除 有害物质的产生 控制副反应的发生
改变反 改变化学反应的 速率
应条件
改变可逆反应进行的 程度
生产的 成 本
实际可能性
目的
方法
二、化学反应条件的控制
问题
考虑
1、合成氨工业反应条件的控制
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。
但温度低,反应速率小 ,生产成本高,工业上通常选择在400~500℃下进行。 压强越大,对动力和生产设备的要求也越高,采用的压强通常为10~30MPa 。
400~500℃ 既有利于加快反应速率,
又适合所用催化剂的活性温度
化工生产中控制反应条件的原则
原则:在化工生产中,为了提高反应进行的程度而调控反应条件时,
需要考虑控制反应条件的成本和实际可能性
控制生产成本 反应实际可能性
2、煤燃烧反应条件的控制
①将固体煤粉碎以增大接触面积,同时空气适当过量,以提 高转化率。
②炉膛材料尽量选择保温性能好的,烟道废气中的热量用来 加热水、发电等,以提高热量利用率。
思考与讨论:
为提高燃料的燃烧效率,应如何调控燃烧反应的条件 (提示:可以 从以下几方面考虑,如燃料的状态、空气用量、炉膛材料、烟道废气中 热能的利用,等等。)
3.应选择保温隔热且耐热的炉(灶)膛材料。尽管煤燃烧是放热反应,但反应过程中煤燃
烧需要提供部分能量才能进行,而利用煤燃烧放出的部分热量就可维持反应的持续进行。
选用保温隔热材料的目的,是为防止热量散失。
2.空气充足,煤燃烧得充分,产物主要为CO , 放热量大;空气不足,则煤燃烧不充分 部分生成CO,CO 排放到空气中造成污染,且生成CO时,放出的热量大大减小。
1.煤被研得越细,粉末越小,与空气中O 的接触面积越大,燃烧越充分,反应速率越快。
逆:研究对象是可逆反应
动:达到平衡时反应仍在进行, 是一种动态平衡状态
等:平衡时,v(正)=v(逆)
定:各组分的质量或浓度保持不变
变:条件改变,原有的化学平衡 状态可能会发生改变
v(正)=v(逆)
可逆反应
化学平衡
各物质浓度不变 控制反应速率
控制反应限度
课堂小结
特点
判断
特点
化学反应
的限度
化学反应条
件的控制
判断
一定条件下,分别对反应C(s)+CO (g)=2CO(g) 进行如下操作:
①升高反应体系的温度;②减小CO 的浓度;③缩小反应体系的体 积;④减小压强。
上述措施中一定能使反应速率显著变大的是( D )
A.①②③④ B.①③④ C.①② D.①③
课前检查
学习评价1
概念辨析
【思考与讨论】
1、为什么尾气中总是有CO
2、为什么高炉增高后,尾气中
CO 的含量没有改变
法国化学家勒夏特列( H.-L.Le Chatelier,
1850-1936 )经过深入的研究,才将这
一谜底揭开。原来,产生上述现象的原
因 是 :C+CO —2C0 是一个可逆反应,
并且自下而上发生在高炉中有焦炭的地方。
后来的研究证明,在高炉中Fe O 与C O反应
也不能全部转化为Fe 和CO
炼铁高炉尾气之谜:
高炉炼铁的主要反应是:
其中产生CO 的反应是:
生产中炼制生铁所需焦炭的实际用量, 远高于按照化学方程式计算所需的量,而且 从高炉炉顶出来的气体中总是含有没有利用 的CO 。开始,炼铁工程师们认为是CO 与 铁矿石接触不充分造成的,于是设法增加 高炉的高度。然而,令人吃惊的是,高炉 增高后,高炉尾气中CO 的比例竟然没有改 变。这成了炼铁技术中的科学悬念,人们一
情境引入
第六章化学反应与能量
第二节化学反应的速率与限度
第3课时化学反应限度 教学目标
1.知道可逆反应的概念及特点。
2.理解可逆反应的最大限度是达到化学平衡 状态。
知识回顾
可逆反应:
1.定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进 行的反应。
注:向生成物方向进行的反应叫做正反应, 反应物 逆反应 生成物
向反应物方向进行的反应叫做逆反应。
书写可逆反应的化学方程式时,不用“===”,用“— “
2.特征: 双向性 反应物 正向反应 生成物
逆向反应
双同性 —正、逆反应是在同一条件下同时进行的
共存性—反应物和生成物同时存在,反应物转化率小于100%
正反应
3.常见的可逆反应:
NH +H O=NH ·H O
Cl +H 0=HCl+HCIO
SO +H O=H SO
H (g)+I (8)—2HI(g)
√ 学习评价1 概念辨析 课堂练习
1.对于可逆反应2SO +O 催化剂 2SO , 在混合气体中充入一定量的18O , 足 够长的时间后,180原子( D )
A.只存在于O 中 B.只存在于O 和SO 中
C.只存在于O 和SO 中 D.存在于SO 、O 和SO 中
2.14CO +C— CO, 达到化学平衡后,平衡混合物中含14C 的粒子
有14CO 、 4C、 CO。
一、化学反应的限度
1.化学平衡状态的建立
在某固定密闭容器中发生反应: ,各物质的浓度随反
应的时间变化如下表所示:
时间(min) 0 10 20 30 40 50 60 70
80
c(SO ) 10 6 3 2 1.2 1 1 1
1
c(O ) 5 3 1.5 1 0.6 0.5 0.5 0.5
0.5
c(SO ) 0 4 7 8 8.8 9 9 9
9
【思考】①此条件下进行到什么时候达到了这个反应的限度(化学平衡状态)
②此时的反应是否停止了
③此时为何三种物质的浓度保持不变
开始时 c(SO )、c(O )最大,→v(正)最大,
c(SO )=0→v(逆)=0 v( 正 ) 平衡状态
反应过程中 v(逆)
c(SO )、c(O )逐渐减小 ,v(正)逐渐减小,0 t 时间(t)
c(SO )逐渐增大,v(逆逐渐增大
正逆反应都进行,v(逆)≠0, v(正)>v(逆)
反应到t 时刻
v(正)=v(逆) 动态平衡
化学平衡的建立过程
反应速率
V正最大
V逆为0
V正逐渐减小
逆逐渐增大
V正=v逆≠0
正反应
逆反应
时 间
反应物浓度最大 生成物浓度为0
反应物浓度减小 生成物浓度增大
各物质的浓度 不再改变
生成物
反应物
→时间
反应
开始
反应
过程
达到
平衡
0
浓度
速率
0
2.化学平衡状态的定义
在一定条件下,可逆反应中,当正、逆两个方向的反应速率相等时,反应物 的浓度和生成物的浓度都不在改变,达到了一种表面静止的状态,我们称之 为“化学平衡状态”。
化学平衡状态是可逆反应在一定条件下所能达到或完成的最大程度,即该反 应的限度。
化学反应的限度决定了反应物在一定条件下的最大转化率。
转化率=(已被转化的反应物的物质的量/反应物初始的物质的量)×100%
3.特征
达到乎衡
V 正=V
逆
时间
t
条件改变,原平衡被破坏,在新的条件下 建立新的平衡
可逆反应
v(正)=v(逆)≠0
动态平衡
判断可逆反应是 否达到平衡状态 的标志。
逆(前提)
等(本质)
动(特点)
定(结果)各组分的浓度保持不变
V 正
V逆
0 t
变(发展)
应 速 率
反A
学习评价1 概念辨析 课堂练习
3.(1)1 mol N 和3 mol H 在一定条件下可完全生成2 mol NH ×)
(2)在一定条件下, 一个可逆反应达到的平衡状态就是该反应所能达到的最大
限度( √)
(3)化学反应在一定条件下建立平衡状态时,化学反应将会停止(
(4)一定条件,可以通过延长化学反应的时间来改变反应物的最大转化率 (
(5)可逆反应达到平衡状态时,各反应物、生成物的浓度相等 (
(6)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速 率和生成速率相等,若用不同物质表示时,反应速率不一定相等 ()
4.对于化学反应的限度的叙述,错误的是( D )
A. 任何可逆反应都有一定的限度
B. 化学反应达到限度时,正逆反应速率相等
C. 化学反应的限度与时间的长短无关
D. 化学反应的限度是不可改变的
提高原料利用率
促进有利反应
提高反应速率
降低 反应速率
抑制有害反应减少甚至消除 有害物质的产生 控制副反应的发生
改变反 改变化学反应的 速率
应条件
改变可逆反应进行的 程度
生产的 成 本
实际可能性
目的
方法
二、化学反应条件的控制
问题
考虑
1、合成氨工业反应条件的控制
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。
但温度低,反应速率小 ,生产成本高,工业上通常选择在400~500℃下进行。 压强越大,对动力和生产设备的要求也越高,采用的压强通常为10~30MPa 。
400~500℃ 既有利于加快反应速率,
又适合所用催化剂的活性温度
化工生产中控制反应条件的原则
原则:在化工生产中,为了提高反应进行的程度而调控反应条件时,
需要考虑控制反应条件的成本和实际可能性
控制生产成本 反应实际可能性
2、煤燃烧反应条件的控制
①将固体煤粉碎以增大接触面积,同时空气适当过量,以提 高转化率。
②炉膛材料尽量选择保温性能好的,烟道废气中的热量用来 加热水、发电等,以提高热量利用率。
思考与讨论:
为提高燃料的燃烧效率,应如何调控燃烧反应的条件 (提示:可以 从以下几方面考虑,如燃料的状态、空气用量、炉膛材料、烟道废气中 热能的利用,等等。)
3.应选择保温隔热且耐热的炉(灶)膛材料。尽管煤燃烧是放热反应,但反应过程中煤燃
烧需要提供部分能量才能进行,而利用煤燃烧放出的部分热量就可维持反应的持续进行。
选用保温隔热材料的目的,是为防止热量散失。
2.空气充足,煤燃烧得充分,产物主要为CO , 放热量大;空气不足,则煤燃烧不充分 部分生成CO,CO 排放到空气中造成污染,且生成CO时,放出的热量大大减小。
1.煤被研得越细,粉末越小,与空气中O 的接触面积越大,燃烧越充分,反应速率越快。
逆:研究对象是可逆反应
动:达到平衡时反应仍在进行, 是一种动态平衡状态
等:平衡时,v(正)=v(逆)
定:各组分的质量或浓度保持不变
变:条件改变,原有的化学平衡 状态可能会发生改变
v(正)=v(逆)
可逆反应
化学平衡
各物质浓度不变 控制反应速率
控制反应限度
课堂小结
特点
判断
特点
化学反应
的限度
化学反应条
件的控制
判断
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
