7.4.1 糖类和蛋白质 (教学课件) -高中化学人教版(2019)必修第二册(共32张PPT)
文档属性
| 名称 | 7.4.1 糖类和蛋白质 (教学课件) -高中化学人教版(2019)必修第二册(共32张PPT) | 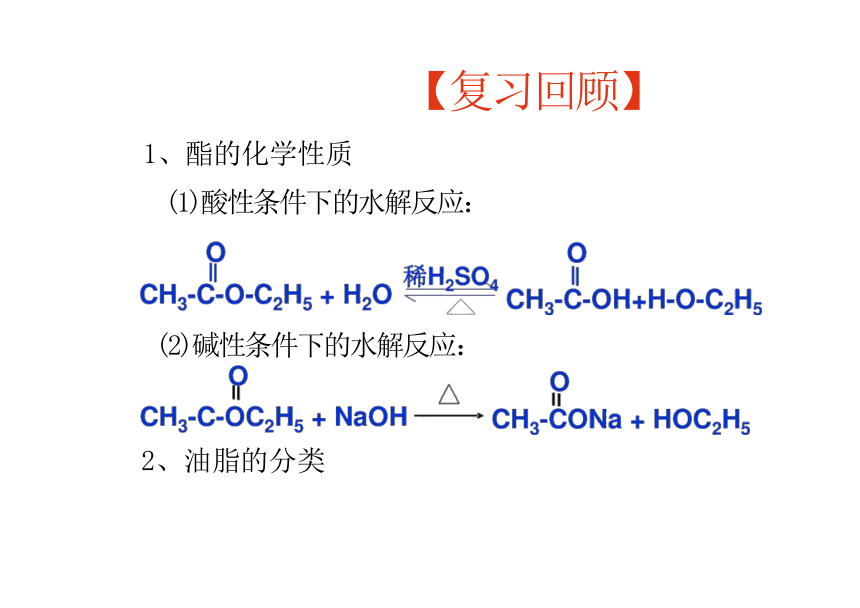 | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 13:00:05 | ||
图片预览











文档简介
(共32张PPT)
【复习回顾】
1、酯的化学性质
(1)酸性条件下的水解反应:
(2)碱性条件下的水解反应:
2、油脂的分类
糖类和蛋白质
学 习 目 标
1.了解糖类的分类以及葡萄糖和蔗糖的结构和
性质。
2.了解淀粉和纤维素对人体的作用。
3.掌握蛋白质的组成元素、基本性质和用途。
重点:葡萄糖与新制氧化铜的实验及葡萄 糖的性质
难点:蛋白质的基本性质
【自主学习】
阅读课本。
—一时间3min
要求:仔细阅读课本,标出相关内容, 并记忆。
一、糖类
1、来源:绿色植物光合作用的产物。
2、组成:糖类由C 、H 、0 三种元素 组成,其组成大多可以用通式_C (H O)m来 表示。因此过去曾把它们称为碳水化合物 葡萄糖、蔗糖、淀粉、纤维素等都属于 糖类。
3、分类:根据是否水解以及水解产物的 不同分为 单糖、二糖、多 糖。
分类 特征 代表物 化学式
是否互为 同分异构体
单糖 不能再水解成 更小的糖分子 葡萄糖 果糖 C H 20
是
低聚糖 1mol双糖水解 麦 芽 糖
(双糖) 成2mol单糖 蔗糖 C 2H 2011
是
多糖 1mol多糖水解 成n mol单糖 淀粉 纤维素 (C H 00 )n
否
知识拓展
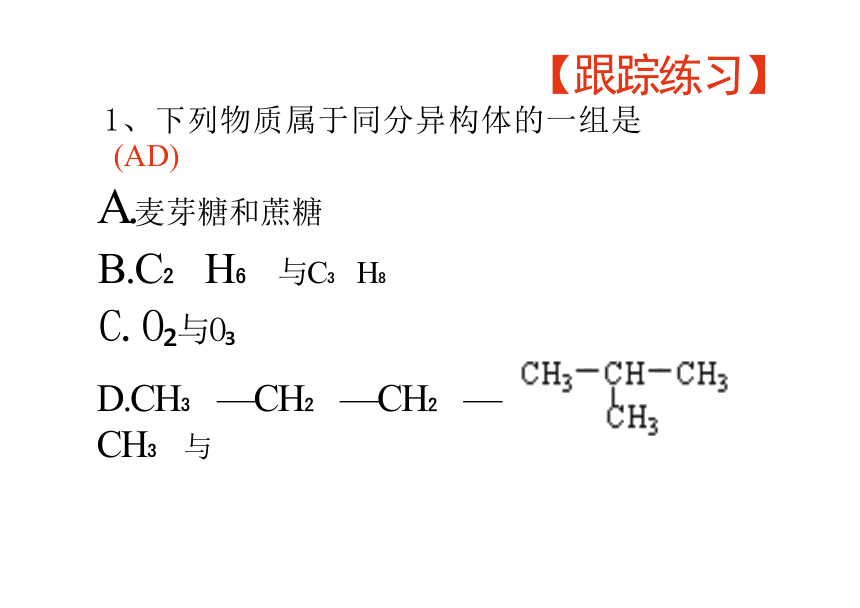
A.麦芽糖和蔗糖
B.C H 与C H
C.O 与O
D.CH —CH —CH —CH 与
【跟踪练习】
1、下列物质属于同分异构体的一组是
(AD)
1.单糖——葡萄糖、果糖(C H120 )
(1)物理性质:白色晶体,有甜味,能溶于水。
(2)组成与结构
分子式:C H 20
最简式:CH O
结构简式:CH OH(CHOH) CHO (葡萄糖)
CH —CH —CH —CH —CHCHO
OH OH OH OH OH (葡萄糖)
【思考与交流】
根据结构推测葡萄糖的化学性质有哪些
葡萄糖:CH —CH —CH —CH —CH CHO
OH OH OH OH OH
羟基一 醛基
—OH所具有的性质:
①与金属钠反应:1mol葡萄糖最多可以消 耗 5 mol钠。
②酯化反应:生成某酸葡萄糖酯
③催化氧化
—CHO所具有的性质:
与新制Cu(OH) 悬浊液反应:
现象:在碱性条件下,加热煮沸,反应产生红
色的Cu O沉淀。
注意事项:
(1)要在碱性条件下 (NaOH过量)进行实验才 能成功。
(2)Cu(OH) 悬浊液要现用现制: 应将少量
CuSO 滴入NaOH溶液中。
【迁移应用】
工业上如何制得葡萄糖 葡萄糖在人体内如 何提供能量
提示:工业上通常用淀粉催化水解法制取葡萄糖。
催化剂
(C H 00 )n+nH O— →nC H 20
在人体内发生缓慢氧化,为生命活动提 供能量:
C H 20 (s)+60 (g)→ 6CO (g)+6H O(1)+能量
2.多糖——淀粉和纤维素
不是同分异构体,均属天然高分子化合物。
(1)淀粉
①淀粉的存在:植物的种子或块根中
如:大米中淀粉含量约有80%;小麦中淀粉含
量约有70%;马铃薯中淀粉含量约有20%
②淀粉的物理性质
白色、无气味、无味道、
不溶于冷水,热水中“糊化”。
③淀粉的化学性质
a.遇碘变蓝色
b. 在催化剂(如酸或酶)作用或加热时会逐步水
解,生成一系列比淀粉分子小的化合物,最终
生成葡萄糖。
(C H 00 )n+n
淀粉
H O催化剂
n C H 20
葡萄糖
催化剂
(C H 00 )n+n H O n C H 20
淀粉 △ 葡萄糖
酒化酶
C H 20 2C H OH +2CO 个
葡萄糖
淀粉 麦芽糖 葡萄糖一 酒精
④淀粉的用途:
a.人体的重要能源—淀粉在人体内水解:
唾液淀粉酶,胰液淀粉酶。
b.工业制葡萄糖和酒精。
淀粉酶 麦芽糖酶 酒化酶
一般的有机溶剂。 ③化学性质:
能水解,最终生成葡萄糖 催化剂
(C H100 )n+nH O— nC H 20
纤维素
葡萄糖
(2)纤维素
①存在:一切植物中。是构成 植物细胞壁的基本成分。
②物理性质:白 色、无嗅无味 、不 溶于水和
棉花
【跟踪练习】
下列说法中,错误的是( D )
A.纤维素和淀粉水解的最终产物都是葡萄糖
B.碘化钾溶液不能使淀粉变蓝色
C.多糖一般没有还原性,不能被新制Cu(OH) 悬 浊液氧化
D.用淀粉制酒精仅发生了水解反应
一、蛋白质的存在、组成及氨基酸的性质 1.蛋白质的存在和组成
(1)存在
广泛存在于 生物体 内,是组成 细胞 的基础物 质。
(2)组成
由 C、H、0、N、S 等元素组成,是相对分子质 量很大的一类天然有机高分子 化合物。
2.构成蛋白质的基本单位:氨基酸
蛋白质 水解 多种氨基酸
3.氨基酸
(1)定义:羧酸分子里烃基上氢原子被氨基取代 后的生成物。
(2)三种重要氨基酸:
甘氨酸(α-氨基乙酸) 丙氨酸(α-氨基丙酸) 谷氨酸(α-氨基戊二酸)
天然蛋白质水解生成的氨基酸都是α-氨基酸。
【思考与交流】
氨基酸有哪些官能团 推测氨基酸具有什么
性质 R- CH-{C00H
NH
氨基酸的两性:氨基 羧基
H N-CH -C00H +NaOH→H N-CH -C00Na +H O
显酸性
H00C-CH -NH +HCl →H00C-CH -NH Cl
显碱性
二 、蛋白质的性质 【实验探究】
取少许鸡蛋清溶液分别放入4支洁净
的试管里(已编号):
(1)给1试管加热;
(2)向2试管中加入饱和Na SO 溶液;
(3)向3试管滴加少量硫酸铜溶液;
(4)向4试管中加入浓硝酸溶液;
向4支试管中再滴加蒸馏水,观察沉淀是 否溶解。
(1)给1试管加热; 变 性
蛋白质凝聚,加水沉淀不溶解。
(2)向2试管中加入饱和Na SO 溶液; 盐析
蛋白质凝聚,加水沉淀溶解。
(3)向3试管滴加少量硫酸铜溶液; 变 性
蛋白质凝聚,加水沉淀不溶解。
(4)向4试管中加入浓硝酸溶液;
蛋白质呈黄色。 蛋白质的显色反应
1.水解
蛋白质在蛋白酶的作用下水解生成各种氨基酸。
2.显色反应:——能用于检验蛋白质的存在。
有些蛋白质遇浓硝酸呈黄色
3.盐析:——是可逆的物理变化
向蛋白质溶液中加入浓的盐溶液(轻金属盐) , 会使蛋白质的溶解度降低而从溶液中析出。
注意:要分清轻金属盐是少量还是浓溶液,少 量促进溶解,浓溶液蛋白质析出。
盐析后继续加水,析出的蛋白质能够溶解, 因为蛋白质没有失去生理活性。
盐析的用途:可用于分离、提纯蛋白质。
4.变性:——不可逆的化学变化
向蛋白质溶液中加入酸、碱、重金属盐、有 机物,对其进行紫外线照射或加热等,都会 使蛋白质因发生性质上的改变而聚沉。
变性后继续加水,析出的蛋白质不能够溶解, 因为蛋白质失去了生理活性。
用途:可用于杀菌、消毒。
5.灼烧:蛋白质灼烧时具有烧焦羽毛的气味。
用途:可用于蛋白质的鉴别(毛织物和棉织 物 ) 。
是棉线
是 毛 线
是毛线。
【学与用】
1.为什么生物实验室用甲醛溶液(福尔马林)
保存动物标本
提示:甲醛溶液能使动物标本失去生理
活性,更长时间保存。
2.误服重金属盐后为什么要喝大量的牛奶或鸡蛋清
提示:牛奶或鸡蛋清的主要成分是蛋白质,误服的重 金属盐离子与喝入的大量的蛋白质反应,从而减轻重 金属盐离子对机体的伤害。
各种生物酶
均是蛋白质
牛奶中的蛋白质 与甲醛制酪素塑
料
蛋白 质的
主要用途
驴皮熬制的胶是 一种药材——阿
胶
动物的毛、蚕 丝是很好的纺 织原料
动物的皮革 是衣服的原
料
三、蛋白质的主要用途
人类的主要食品
二、蛋白质的性质
1.两性:既能与盐酸反应,又能与NaOH溶液反应。 2.盐析:
注意:蛋白质盐析和变性的区别
3.变性:
4.显色反应:有些蛋白质遇浓硝酸呈黄色。 5.灼烧:灼烧时具有烧焦羽毛的气味。
课堂小结
单糖
二糖:葡萄糖+新制Cu(OH)2悬浊液反应
多糖:淀粉、纤维素
一、糖类
【当堂检测】
1.医院里检验糖尿病的方法是将病人尿液加入到 CuSO 和NaOH的混合液中,加热后产生红色沉淀说明 病人的尿中含有 ( D )
A. 脂肪 B. 乙酸
C. 蛋白质 D.葡萄糖
2.蔬菜、水果中富含纤维素,纤维素被食入人体后 在作用是 ( D )
A. 为人体内的化学反应提供原料
B. 为维持人体生命活动提供能量
C. 加强胃肠蠕动,具有通便功能
D. 人体中没有水解纤维素的酶,所以纤维素在人 体中没有任何作用
3.下列过程中,不可逆的是( C )
A.蛋白质的盐析 B.酯的水解
C.蛋白质的变性 D.工业合成氨
4.欲将蛋白质从水中析出又不改变其性质应加 ( C )
A.甲醛溶液 B.CuSO 溶液
C.饱和Na SO 溶液 D.浓硫酸
5.下列实例中利用了蛋白质变性的是( A )
①利用过氧乙酸对环境、物品进行消毒;
②利用高温、紫外线对医疗器械进行消毒;
③蒸煮鸡蛋食用;
④松花蛋的腌制;
⑤用蛋白质灌服重金属中毒的病人。
A. 全部 B.①②③④
C.①②③ D.①②
【复习回顾】
1、酯的化学性质
(1)酸性条件下的水解反应:
(2)碱性条件下的水解反应:
2、油脂的分类
糖类和蛋白质
学 习 目 标
1.了解糖类的分类以及葡萄糖和蔗糖的结构和
性质。
2.了解淀粉和纤维素对人体的作用。
3.掌握蛋白质的组成元素、基本性质和用途。
重点:葡萄糖与新制氧化铜的实验及葡萄 糖的性质
难点:蛋白质的基本性质
【自主学习】
阅读课本。
—一时间3min
要求:仔细阅读课本,标出相关内容, 并记忆。
一、糖类
1、来源:绿色植物光合作用的产物。
2、组成:糖类由C 、H 、0 三种元素 组成,其组成大多可以用通式_C (H O)m来 表示。因此过去曾把它们称为碳水化合物 葡萄糖、蔗糖、淀粉、纤维素等都属于 糖类。
3、分类:根据是否水解以及水解产物的 不同分为 单糖、二糖、多 糖。
分类 特征 代表物 化学式
是否互为 同分异构体
单糖 不能再水解成 更小的糖分子 葡萄糖 果糖 C H 20
是
低聚糖 1mol双糖水解 麦 芽 糖
(双糖) 成2mol单糖 蔗糖 C 2H 2011
是
多糖 1mol多糖水解 成n mol单糖 淀粉 纤维素 (C H 00 )n
否
知识拓展
A.麦芽糖和蔗糖
B.C H 与C H
C.O 与O
D.CH —CH —CH —CH 与
【跟踪练习】
1、下列物质属于同分异构体的一组是
(AD)
1.单糖——葡萄糖、果糖(C H120 )
(1)物理性质:白色晶体,有甜味,能溶于水。
(2)组成与结构
分子式:C H 20
最简式:CH O
结构简式:CH OH(CHOH) CHO (葡萄糖)
CH —CH —CH —CH —CHCHO
OH OH OH OH OH (葡萄糖)
【思考与交流】
根据结构推测葡萄糖的化学性质有哪些
葡萄糖:CH —CH —CH —CH —CH CHO
OH OH OH OH OH
羟基一 醛基
—OH所具有的性质:
①与金属钠反应:1mol葡萄糖最多可以消 耗 5 mol钠。
②酯化反应:生成某酸葡萄糖酯
③催化氧化
—CHO所具有的性质:
与新制Cu(OH) 悬浊液反应:
现象:在碱性条件下,加热煮沸,反应产生红
色的Cu O沉淀。
注意事项:
(1)要在碱性条件下 (NaOH过量)进行实验才 能成功。
(2)Cu(OH) 悬浊液要现用现制: 应将少量
CuSO 滴入NaOH溶液中。
【迁移应用】
工业上如何制得葡萄糖 葡萄糖在人体内如 何提供能量
提示:工业上通常用淀粉催化水解法制取葡萄糖。
催化剂
(C H 00 )n+nH O— →nC H 20
在人体内发生缓慢氧化,为生命活动提 供能量:
C H 20 (s)+60 (g)→ 6CO (g)+6H O(1)+能量
2.多糖——淀粉和纤维素
不是同分异构体,均属天然高分子化合物。
(1)淀粉
①淀粉的存在:植物的种子或块根中
如:大米中淀粉含量约有80%;小麦中淀粉含
量约有70%;马铃薯中淀粉含量约有20%
②淀粉的物理性质
白色、无气味、无味道、
不溶于冷水,热水中“糊化”。
③淀粉的化学性质
a.遇碘变蓝色
b. 在催化剂(如酸或酶)作用或加热时会逐步水
解,生成一系列比淀粉分子小的化合物,最终
生成葡萄糖。
(C H 00 )n+n
淀粉
H O催化剂
n C H 20
葡萄糖
催化剂
(C H 00 )n+n H O n C H 20
淀粉 △ 葡萄糖
酒化酶
C H 20 2C H OH +2CO 个
葡萄糖
淀粉 麦芽糖 葡萄糖一 酒精
④淀粉的用途:
a.人体的重要能源—淀粉在人体内水解:
唾液淀粉酶,胰液淀粉酶。
b.工业制葡萄糖和酒精。
淀粉酶 麦芽糖酶 酒化酶
一般的有机溶剂。 ③化学性质:
能水解,最终生成葡萄糖 催化剂
(C H100 )n+nH O— nC H 20
纤维素
葡萄糖
(2)纤维素
①存在:一切植物中。是构成 植物细胞壁的基本成分。
②物理性质:白 色、无嗅无味 、不 溶于水和
棉花
【跟踪练习】
下列说法中,错误的是( D )
A.纤维素和淀粉水解的最终产物都是葡萄糖
B.碘化钾溶液不能使淀粉变蓝色
C.多糖一般没有还原性,不能被新制Cu(OH) 悬 浊液氧化
D.用淀粉制酒精仅发生了水解反应
一、蛋白质的存在、组成及氨基酸的性质 1.蛋白质的存在和组成
(1)存在
广泛存在于 生物体 内,是组成 细胞 的基础物 质。
(2)组成
由 C、H、0、N、S 等元素组成,是相对分子质 量很大的一类天然有机高分子 化合物。
2.构成蛋白质的基本单位:氨基酸
蛋白质 水解 多种氨基酸
3.氨基酸
(1)定义:羧酸分子里烃基上氢原子被氨基取代 后的生成物。
(2)三种重要氨基酸:
甘氨酸(α-氨基乙酸) 丙氨酸(α-氨基丙酸) 谷氨酸(α-氨基戊二酸)
天然蛋白质水解生成的氨基酸都是α-氨基酸。
【思考与交流】
氨基酸有哪些官能团 推测氨基酸具有什么
性质 R- CH-{C00H
NH
氨基酸的两性:氨基 羧基
H N-CH -C00H +NaOH→H N-CH -C00Na +H O
显酸性
H00C-CH -NH +HCl →H00C-CH -NH Cl
显碱性
二 、蛋白质的性质 【实验探究】
取少许鸡蛋清溶液分别放入4支洁净
的试管里(已编号):
(1)给1试管加热;
(2)向2试管中加入饱和Na SO 溶液;
(3)向3试管滴加少量硫酸铜溶液;
(4)向4试管中加入浓硝酸溶液;
向4支试管中再滴加蒸馏水,观察沉淀是 否溶解。
(1)给1试管加热; 变 性
蛋白质凝聚,加水沉淀不溶解。
(2)向2试管中加入饱和Na SO 溶液; 盐析
蛋白质凝聚,加水沉淀溶解。
(3)向3试管滴加少量硫酸铜溶液; 变 性
蛋白质凝聚,加水沉淀不溶解。
(4)向4试管中加入浓硝酸溶液;
蛋白质呈黄色。 蛋白质的显色反应
1.水解
蛋白质在蛋白酶的作用下水解生成各种氨基酸。
2.显色反应:——能用于检验蛋白质的存在。
有些蛋白质遇浓硝酸呈黄色
3.盐析:——是可逆的物理变化
向蛋白质溶液中加入浓的盐溶液(轻金属盐) , 会使蛋白质的溶解度降低而从溶液中析出。
注意:要分清轻金属盐是少量还是浓溶液,少 量促进溶解,浓溶液蛋白质析出。
盐析后继续加水,析出的蛋白质能够溶解, 因为蛋白质没有失去生理活性。
盐析的用途:可用于分离、提纯蛋白质。
4.变性:——不可逆的化学变化
向蛋白质溶液中加入酸、碱、重金属盐、有 机物,对其进行紫外线照射或加热等,都会 使蛋白质因发生性质上的改变而聚沉。
变性后继续加水,析出的蛋白质不能够溶解, 因为蛋白质失去了生理活性。
用途:可用于杀菌、消毒。
5.灼烧:蛋白质灼烧时具有烧焦羽毛的气味。
用途:可用于蛋白质的鉴别(毛织物和棉织 物 ) 。
是棉线
是 毛 线
是毛线。
【学与用】
1.为什么生物实验室用甲醛溶液(福尔马林)
保存动物标本
提示:甲醛溶液能使动物标本失去生理
活性,更长时间保存。
2.误服重金属盐后为什么要喝大量的牛奶或鸡蛋清
提示:牛奶或鸡蛋清的主要成分是蛋白质,误服的重 金属盐离子与喝入的大量的蛋白质反应,从而减轻重 金属盐离子对机体的伤害。
各种生物酶
均是蛋白质
牛奶中的蛋白质 与甲醛制酪素塑
料
蛋白 质的
主要用途
驴皮熬制的胶是 一种药材——阿
胶
动物的毛、蚕 丝是很好的纺 织原料
动物的皮革 是衣服的原
料
三、蛋白质的主要用途
人类的主要食品
二、蛋白质的性质
1.两性:既能与盐酸反应,又能与NaOH溶液反应。 2.盐析:
注意:蛋白质盐析和变性的区别
3.变性:
4.显色反应:有些蛋白质遇浓硝酸呈黄色。 5.灼烧:灼烧时具有烧焦羽毛的气味。
课堂小结
单糖
二糖:葡萄糖+新制Cu(OH)2悬浊液反应
多糖:淀粉、纤维素
一、糖类
【当堂检测】
1.医院里检验糖尿病的方法是将病人尿液加入到 CuSO 和NaOH的混合液中,加热后产生红色沉淀说明 病人的尿中含有 ( D )
A. 脂肪 B. 乙酸
C. 蛋白质 D.葡萄糖
2.蔬菜、水果中富含纤维素,纤维素被食入人体后 在作用是 ( D )
A. 为人体内的化学反应提供原料
B. 为维持人体生命活动提供能量
C. 加强胃肠蠕动,具有通便功能
D. 人体中没有水解纤维素的酶,所以纤维素在人 体中没有任何作用
3.下列过程中,不可逆的是( C )
A.蛋白质的盐析 B.酯的水解
C.蛋白质的变性 D.工业合成氨
4.欲将蛋白质从水中析出又不改变其性质应加 ( C )
A.甲醛溶液 B.CuSO 溶液
C.饱和Na SO 溶液 D.浓硫酸
5.下列实例中利用了蛋白质变性的是( A )
①利用过氧乙酸对环境、物品进行消毒;
②利用高温、紫外线对医疗器械进行消毒;
③蒸煮鸡蛋食用;
④松花蛋的腌制;
⑤用蛋白质灌服重金属中毒的病人。
A. 全部 B.①②③④
C.①②③ D.①②
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
