金属矿物的开发利用(教学课件)——高中化学人教版(2019)必修第二册(共23张PPT)
文档属性
| 名称 | 金属矿物的开发利用(教学课件)——高中化学人教版(2019)必修第二册(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 13:03:41 | ||
图片预览








文档简介
(共23张PPT)
第八章化学与可持续发展
第一节自然资源的开发利用 第1课时金属矿物的开发利用
【核心素养】
1.宏观辨识与微观探析:通过宏观上认识自然资源一金属矿物的开发利用, 能从分析、探究金属冶炼的原理和一般方法。
2.证据推理和模型认知:通过金属冶炼原理的学习和冶炼方法的归纳,理解 氧化还原反应在金属矿物开发中的应用,构建金属冶炼的思维模型。
3.科学态度和社会责任:体会化学在自然资源开发和利用中的意义和作用, 解释化学与可持续发展的重要关系,树立资源保护意识及合理开发意识。
【教学重难点】
重点:金属冶炼原理及方法
难点:金属活动性顺序与金属冶炼方法的关系
金矿 铂矿 铝矿 蓝铜矿 孔 雀 石 赤铜矿 黄铜矿
① 极少数的不活泼金属(金、铂等)以游离态的形式存在。
②绝大多数金属以化合物的形式存在。
③在地壳中,含量最高的金属元素是铝,其次是铁。
金属元素在自然界的存在
富集:除去杂质,提高矿物中有用成分的含量
冶炼:将金属元素还原为单质
精炼:采用适当方法提纯金属
赤铁矿 纯铁
(Fe O )
一、金属的冶炼
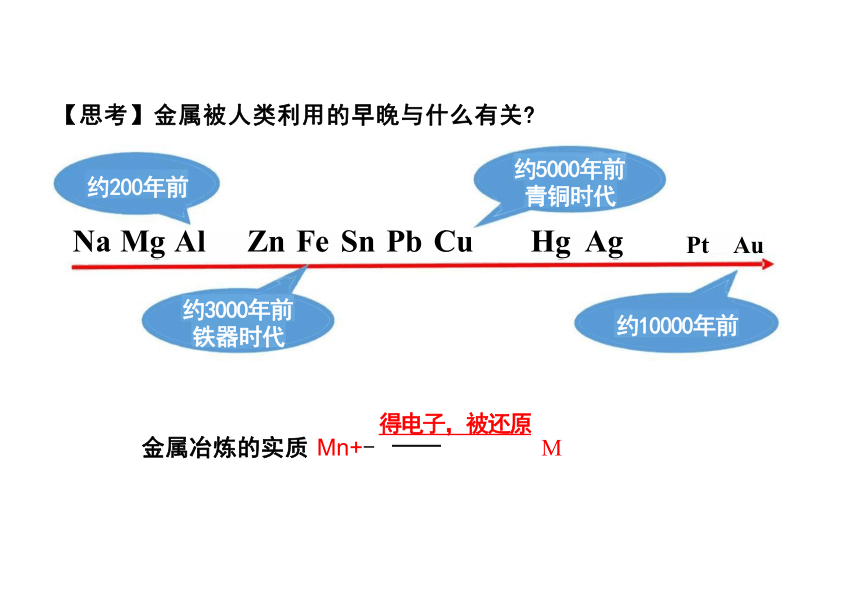
1.基本原理:将金属元素从其化合物中还原出来得到金属单质。 2.表示方法:Mn++ne-=M (得电子,被还原)
3.从金属矿物中提炼金属的一般步骤
约200年前 约5000年前 青铜时代
Na Mg Al Zn Fe Sn Pb Cu Hg Ag
Pt Au
得电子,被还原
金属冶炼的实质 Mn+- M
【思考】金属被人类利用的早晚与什么有关
约3000年前 铁器时代
约10000年前
二、金属冶炼的方法
1.依据:金属活泼性不同,将其由化合态还原为游离态的难易程度不同。 2.金属冶炼的方法
① 物理富集:适合极不活泼金属,如Pt、Au
《浪淘沙》-刘禹锡
干淘万漉虽辛苦, 吹尽狂沙始到金。 美人首饰侯王印, 尽是沙中浪底来。
“沙土淘金”
2HgO=△=2Hg+O 个
2Ag O=全=4Ag+O 个 Hgs △=2Hg+S^
(丹砂、朱砂)
②热分解法:适合一些不活泼金属
丹砂烧之成水银一《抱朴子》
注意:①“熔融”是熔融态而不是水溶液。
②必须是离子化合物,共价化合物熔融不导电。
③电解法:适合一些非常活泼金属
(1)工业上为什么常用电解熔融MgCl 的方法生产金属镁,而不用电解 MgO 的方法生产镁
MgO 熔点比MgCl 高很多,熔融时消耗的能量大
(2)工业上为什么常用电解Al O 冰晶石熔融混合物的方法生产金属铝, 而不用电解AICl 的方法生产铝
因为AICl 是共价化合物,熔融状态下不导电。故冶炼金属铝是用 电解熔融Al O 的方法。加入冰晶石(Na AIF ), 以降低熔化温度。
物质 MgCl MgO AICl
Al O
熔点/℃ 714 2852 190
2054
【思考】
④热还原法:适用于大部分金属
常用还原剂:C、CO、H 、活泼金属如AI等
C+2CuO= 高温=2Cu+CO 个
3CO+Fe O 高温=2Fe+3CO (高炉炼铁) H +CuO=全=Cu+H O
2Al+Fe O =高温=2Fe+Al O
用矿(硫化矿,主要成分为 Cu S) 二百五十箩.....入大旋风炉,
连烹(灼烧)三日三夜,方见成铜 ——明 陆容《菽园杂记》。
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾 则成铜。熬胆矾铁釜,久之异化为铜。——沈括《梦溪笔谈》
高温
火法炼铜:Cu S+0 =====2Cu+SO
湿法炼铜:Fe+CuSO =FeSO +Cu
> 其他方法
小 结 :
K Ca Na Mg Al|Zn Fe Sn Pb(H)Cu | HgAg| Pt Au
电解法 热还原法 热分解法富集法
【课堂练习】
1.判断正误(1)在金属化合物中金属元素都显正价( )(2)金属冶炼
过程中,金属化合物得电子,发生氧化反应( )
X
(3)铁器时代比青铜器时代要早些( × )(4)黄金的冶炼可用热分解法
( )(5)铝的冶炼方法是电解熔融的A ICl ( )
×
·2.下列化工生产原理正确的是( A
·A. 用电解熔融NaCl的方法来制取金属钠
·B. 用电解熔融AlCl 的方法来制取金属铝
·C. 用钠加入MgCl 溶液的方法制取金属镁
·D. 用铝粉与NaCl晶体共热的方法制取金属钠
·3.利用金属活动性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所 描述的冶炼方法不可能实现的是( )
D
A.2Al O (熔融)电 石 4Al+30 ↑
B.Fe O +2AI 高 温 2Fe+Al O
C.Fe+CuSO ===FeSO +Cu
D.MgCl (水溶液) 电解 Mg+Cl 个
朝代 利用矿物 历史记载的材料
冶炼方法
夏朝 金矿 “干淘万漉虽辛苦,吹尽狂沙始到金”
物理富集法
东晋 硫化汞矿 炼丹家葛洪《抱朴子》“丹砂(HgS) 烧之成水银”。
热分解法
西汉 硫酸铜矿 西汉刘安《淮南万毕术》“曾青得铁则 化为铜”。
湿法炼铜
商朝 孔雀石矿 西汉贾谊《鹏鸟赋》且夫天地为炉兮, 造化为工;阴阳为炭兮,万物为铜。
热还原法
战国 赤铁矿 《秋浦歌》炉火照天地,红星乱紫烟。
热还原法
4.阅读历史文献记载,总结下列有关金属的冶炼方法
【补充】铝热反应
铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应
实验现象:镁条剧烈燃烧, 放出大量的热,发出耀眼 白光,纸漏斗的下部被烧 穿,有熔融物落入细沙中。
纸漏斗 镁条
氯酸钾
氧化铁和铝
粉的混合物
细沙
高温
Fe O +2Al===2Fe +Al O
铝热剂
原理:
【 注 意 】
①镁条为引燃剂(实验前镁带要打磨)
②氯酸钾为助燃剂
③引发操作:在铝热剂上放KCIO ,插入镁条并 将镁条点燃,促使氯酸钾分解,释放出氧气,从 而引发Al和Fe O 发生反应。
④纸漏斗要用水润湿,以防高温物质从四周溅出。
⑤因为铝热反应放出的大量热量,所以要垫细沙。
一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
氧化铁和铝 粉的混合物
细沙
镁条
氯酸钾
纸漏斗
其它铝热反应
高温
Fe O +2Al===2Fe+Al O
高温
3MnO +4Al===3Mn+2Al O
Cr O +2AI 2Cr+Al O
高温
3Co O +8AI === 9Co+4Al O
焊接钢轨
冶炼熔点较高且比铝不活泼的金属(如钨、钒、铬、锰等)
应 用
【课堂练习】
1.铝能用于冶炼熔点高的金属(如V、Cr、Mn 等),用到的铝的性质是( D )
A.银白色金属
B.熔、沸点相对较低
C.导电、导热性能好
D.还原性强,在反应中释放出大量的热
(1)纸漏斗中铺在氧化铁和铝粉的混合物上面的物质是_氯酸钾 o
(2)引发铝热反应的操作为_在铝热剂上放KCIO , 插入镁条并将镁条点燃
(3)若将氧化铁换成氧化镁,该反应能否发生 不能 (填“能” 或“不能”),理由是镁的活泼性比铝强,铝不能置换出镁。
2.如图为铝热反应的实验装置,请回答下列问题:
a.酸溶法的工艺流程
沉 淀
加过量
NaOH
过 滤
②
滤 液
NaHCO
上述过程残渣和沉淀的化学式分别为 SiO 、Fe(OH) 前后滤液的主要阳
离子的符号分别为 Al + 、Fe + Na+ 写出该过程①离子方程式分别为
① AL,O +6H+=2Al ++3H,O Fe,O +6H+=2Fe ++3H,O
3.铝土矿的主要成分是Al O 和SiO 、Fe O 等。因此从铝土矿中提Al O 的 流程可以设计成两种方案。
通 CO 并 控制反应
条 件
过 滤
滤液 沉淀
铝土矿
Al(OH)
洗 涤
①
Al O
HCl
上述过程残渣和沉淀的化学式分别为Fe O 、 H SiO 前后滤液的主要
阳离子的符号分别为 Na+ Al + 写出该过程①②离子方程式分别为① Al O +2OH-+3H O=2[Al(OH) I SiO +20H-=SiO 2-+H O
②A] ++3NH .H O==Al(OH) +3NH ;
反应③的化学方程式 2 AI(OH)= L0 +3H
较 纯 的
Al O
③
②
足量 Al(OH)3
NH 悬 浊 液
涤
滤
洗
过
b.碱溶法的工艺流程:
NaOH 溶 液
沉淀
滤 液
1
铝土矿
残 渣
滤 液
足 量 盐 酸
悬浊液
过 滤
过 滤
三 、合理开发和利用金属矿物资源
(1)提高金属矿物的利用率
(2)开发环保高效的金属冶炼方法
(3)防止金属的腐蚀
(4)加强废旧金属的回收和再利用
(5)使用其他材料代替金属材料
第八章化学与可持续发展
第一节自然资源的开发利用 第1课时金属矿物的开发利用
【核心素养】
1.宏观辨识与微观探析:通过宏观上认识自然资源一金属矿物的开发利用, 能从分析、探究金属冶炼的原理和一般方法。
2.证据推理和模型认知:通过金属冶炼原理的学习和冶炼方法的归纳,理解 氧化还原反应在金属矿物开发中的应用,构建金属冶炼的思维模型。
3.科学态度和社会责任:体会化学在自然资源开发和利用中的意义和作用, 解释化学与可持续发展的重要关系,树立资源保护意识及合理开发意识。
【教学重难点】
重点:金属冶炼原理及方法
难点:金属活动性顺序与金属冶炼方法的关系
金矿 铂矿 铝矿 蓝铜矿 孔 雀 石 赤铜矿 黄铜矿
① 极少数的不活泼金属(金、铂等)以游离态的形式存在。
②绝大多数金属以化合物的形式存在。
③在地壳中,含量最高的金属元素是铝,其次是铁。
金属元素在自然界的存在
富集:除去杂质,提高矿物中有用成分的含量
冶炼:将金属元素还原为单质
精炼:采用适当方法提纯金属
赤铁矿 纯铁
(Fe O )
一、金属的冶炼
1.基本原理:将金属元素从其化合物中还原出来得到金属单质。 2.表示方法:Mn++ne-=M (得电子,被还原)
3.从金属矿物中提炼金属的一般步骤
约200年前 约5000年前 青铜时代
Na Mg Al Zn Fe Sn Pb Cu Hg Ag
Pt Au
得电子,被还原
金属冶炼的实质 Mn+- M
【思考】金属被人类利用的早晚与什么有关
约3000年前 铁器时代
约10000年前
二、金属冶炼的方法
1.依据:金属活泼性不同,将其由化合态还原为游离态的难易程度不同。 2.金属冶炼的方法
① 物理富集:适合极不活泼金属,如Pt、Au
《浪淘沙》-刘禹锡
干淘万漉虽辛苦, 吹尽狂沙始到金。 美人首饰侯王印, 尽是沙中浪底来。
“沙土淘金”
2HgO=△=2Hg+O 个
2Ag O=全=4Ag+O 个 Hgs △=2Hg+S^
(丹砂、朱砂)
②热分解法:适合一些不活泼金属
丹砂烧之成水银一《抱朴子》
注意:①“熔融”是熔融态而不是水溶液。
②必须是离子化合物,共价化合物熔融不导电。
③电解法:适合一些非常活泼金属
(1)工业上为什么常用电解熔融MgCl 的方法生产金属镁,而不用电解 MgO 的方法生产镁
MgO 熔点比MgCl 高很多,熔融时消耗的能量大
(2)工业上为什么常用电解Al O 冰晶石熔融混合物的方法生产金属铝, 而不用电解AICl 的方法生产铝
因为AICl 是共价化合物,熔融状态下不导电。故冶炼金属铝是用 电解熔融Al O 的方法。加入冰晶石(Na AIF ), 以降低熔化温度。
物质 MgCl MgO AICl
Al O
熔点/℃ 714 2852 190
2054
【思考】
④热还原法:适用于大部分金属
常用还原剂:C、CO、H 、活泼金属如AI等
C+2CuO= 高温=2Cu+CO 个
3CO+Fe O 高温=2Fe+3CO (高炉炼铁) H +CuO=全=Cu+H O
2Al+Fe O =高温=2Fe+Al O
用矿(硫化矿,主要成分为 Cu S) 二百五十箩.....入大旋风炉,
连烹(灼烧)三日三夜,方见成铜 ——明 陆容《菽园杂记》。
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾 则成铜。熬胆矾铁釜,久之异化为铜。——沈括《梦溪笔谈》
高温
火法炼铜:Cu S+0 =====2Cu+SO
湿法炼铜:Fe+CuSO =FeSO +Cu
> 其他方法
小 结 :
K Ca Na Mg Al|Zn Fe Sn Pb(H)Cu | HgAg| Pt Au
电解法 热还原法 热分解法富集法
【课堂练习】
1.判断正误(1)在金属化合物中金属元素都显正价( )(2)金属冶炼
过程中,金属化合物得电子,发生氧化反应( )
X
(3)铁器时代比青铜器时代要早些( × )(4)黄金的冶炼可用热分解法
( )(5)铝的冶炼方法是电解熔融的A ICl ( )
×
·2.下列化工生产原理正确的是( A
·A. 用电解熔融NaCl的方法来制取金属钠
·B. 用电解熔融AlCl 的方法来制取金属铝
·C. 用钠加入MgCl 溶液的方法制取金属镁
·D. 用铝粉与NaCl晶体共热的方法制取金属钠
·3.利用金属活动性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所 描述的冶炼方法不可能实现的是( )
D
A.2Al O (熔融)电 石 4Al+30 ↑
B.Fe O +2AI 高 温 2Fe+Al O
C.Fe+CuSO ===FeSO +Cu
D.MgCl (水溶液) 电解 Mg+Cl 个
朝代 利用矿物 历史记载的材料
冶炼方法
夏朝 金矿 “干淘万漉虽辛苦,吹尽狂沙始到金”
物理富集法
东晋 硫化汞矿 炼丹家葛洪《抱朴子》“丹砂(HgS) 烧之成水银”。
热分解法
西汉 硫酸铜矿 西汉刘安《淮南万毕术》“曾青得铁则 化为铜”。
湿法炼铜
商朝 孔雀石矿 西汉贾谊《鹏鸟赋》且夫天地为炉兮, 造化为工;阴阳为炭兮,万物为铜。
热还原法
战国 赤铁矿 《秋浦歌》炉火照天地,红星乱紫烟。
热还原法
4.阅读历史文献记载,总结下列有关金属的冶炼方法
【补充】铝热反应
铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应
实验现象:镁条剧烈燃烧, 放出大量的热,发出耀眼 白光,纸漏斗的下部被烧 穿,有熔融物落入细沙中。
纸漏斗 镁条
氯酸钾
氧化铁和铝
粉的混合物
细沙
高温
Fe O +2Al===2Fe +Al O
铝热剂
原理:
【 注 意 】
①镁条为引燃剂(实验前镁带要打磨)
②氯酸钾为助燃剂
③引发操作:在铝热剂上放KCIO ,插入镁条并 将镁条点燃,促使氯酸钾分解,释放出氧气,从 而引发Al和Fe O 发生反应。
④纸漏斗要用水润湿,以防高温物质从四周溅出。
⑤因为铝热反应放出的大量热量,所以要垫细沙。
一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
氧化铁和铝 粉的混合物
细沙
镁条
氯酸钾
纸漏斗
其它铝热反应
高温
Fe O +2Al===2Fe+Al O
高温
3MnO +4Al===3Mn+2Al O
Cr O +2AI 2Cr+Al O
高温
3Co O +8AI === 9Co+4Al O
焊接钢轨
冶炼熔点较高且比铝不活泼的金属(如钨、钒、铬、锰等)
应 用
【课堂练习】
1.铝能用于冶炼熔点高的金属(如V、Cr、Mn 等),用到的铝的性质是( D )
A.银白色金属
B.熔、沸点相对较低
C.导电、导热性能好
D.还原性强,在反应中释放出大量的热
(1)纸漏斗中铺在氧化铁和铝粉的混合物上面的物质是_氯酸钾 o
(2)引发铝热反应的操作为_在铝热剂上放KCIO , 插入镁条并将镁条点燃
(3)若将氧化铁换成氧化镁,该反应能否发生 不能 (填“能” 或“不能”),理由是镁的活泼性比铝强,铝不能置换出镁。
2.如图为铝热反应的实验装置,请回答下列问题:
a.酸溶法的工艺流程
沉 淀
加过量
NaOH
过 滤
②
滤 液
NaHCO
上述过程残渣和沉淀的化学式分别为 SiO 、Fe(OH) 前后滤液的主要阳
离子的符号分别为 Al + 、Fe + Na+ 写出该过程①离子方程式分别为
① AL,O +6H+=2Al ++3H,O Fe,O +6H+=2Fe ++3H,O
3.铝土矿的主要成分是Al O 和SiO 、Fe O 等。因此从铝土矿中提Al O 的 流程可以设计成两种方案。
通 CO 并 控制反应
条 件
过 滤
滤液 沉淀
铝土矿
Al(OH)
洗 涤
①
Al O
HCl
上述过程残渣和沉淀的化学式分别为Fe O 、 H SiO 前后滤液的主要
阳离子的符号分别为 Na+ Al + 写出该过程①②离子方程式分别为① Al O +2OH-+3H O=2[Al(OH) I SiO +20H-=SiO 2-+H O
②A] ++3NH .H O==Al(OH) +3NH ;
反应③的化学方程式 2 AI(OH)= L0 +3H
较 纯 的
Al O
③
②
足量 Al(OH)3
NH 悬 浊 液
涤
滤
洗
过
b.碱溶法的工艺流程:
NaOH 溶 液
沉淀
滤 液
1
铝土矿
残 渣
滤 液
足 量 盐 酸
悬浊液
过 滤
过 滤
三 、合理开发和利用金属矿物资源
(1)提高金属矿物的利用率
(2)开发环保高效的金属冶炼方法
(3)防止金属的腐蚀
(4)加强废旧金属的回收和再利用
(5)使用其他材料代替金属材料
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
