乙醇 (教学课件)-高中化学人教版(2019)必修第二册(共28张PPT)
文档属性
| 名称 | 乙醇 (教学课件)-高中化学人教版(2019)必修第二册(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 13:06:54 | ||
图片预览





文档简介
(共28张PPT)
第一课时醇
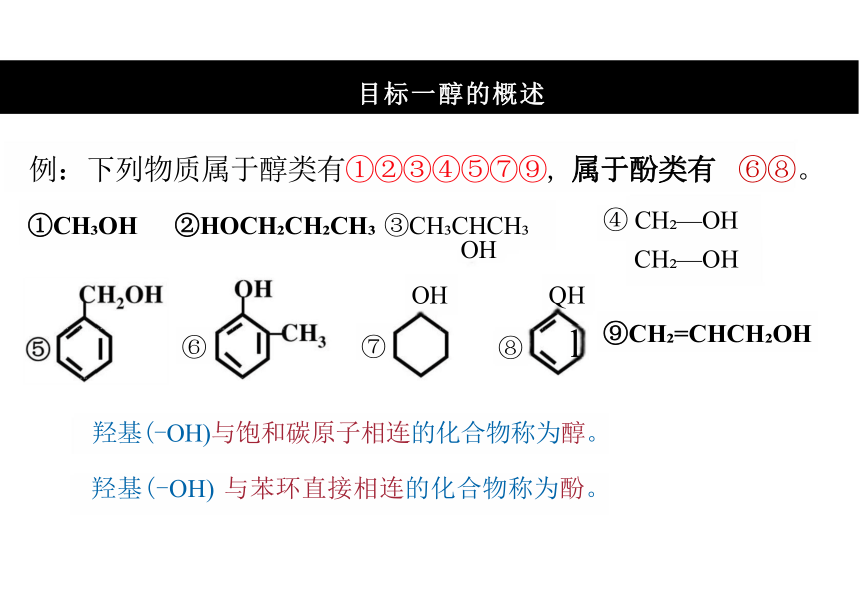
羟基(-OH)与饱和碳原子相连的化合物称为醇。
羟基(-OH) 与苯环直接相连的化合物称为酚。
目标一醇的概述
④ CH —OH
CH —OH
⑨CH =CHCH OH
例:下列物质属于醇类有①②③④⑤⑦⑨, 属于酚类有 ⑥⑧。
①CH OH ②HOCH CH CH ③CH CHCH OH
OH QH
⑦ ⑧ l
⑥
羟基与饱和碳原子相连的化合物
羟基( -OH)
官能团
结构
定义
1.醇的概念
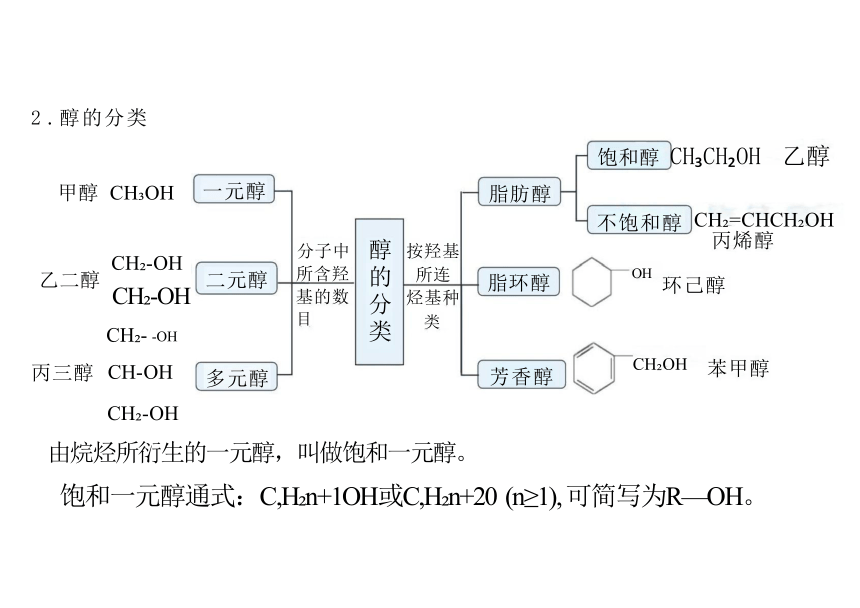
由烷烃所衍生的一元醇,叫做饱和一元醇。
饱和一元醇通式:C,H n+1OH或C,H n+20 (n≥1), 可简写为R—OH。
CH OH
CH -OH CH -OH
CH - -OH
CH-OH CH -OH
一元醇
二元醇
多元醇
脂肪醇
脂环醇
芳香醇
甲醇
乙二醇
丙三醇
饱和醇 CH CH OH 乙醇
CH =CHCH OH 丙烯醇
按羟基
所连
烃基种
类
分子中 所含羟 基的数 目
CH OH 苯甲醇
2 .醇的分类
醇的分类
不饱和醇
环己醇
OH
3、醇的命名:
(1)选主链:选择含官能团的最长碳链,按主链上的碳原子数目定“某醇”
(2)定编号:从离官能团近的一端编号,遵循位次序号之和最小原则。
(3)写名称:从简入繁,先写烃基,再写母体,注意用阿拉伯数字表明官能团所处碳 原子序号。
编号顺序: 碳碳三键或碳碳双键>-OH> 烃基>卤素原子>-NO
CH CH CH OH
1-丙醇(正丙醇) 2-丙醇(异丙醇) 2-甲基-2,3-丁二醇
苯甲醇 邻甲基苯酚 环己醇 苯酚 丙烯醇
H
⑨CH =CHCH OH
②CH CH CH OH
1-丙醇
CH —OH
CH —OH
乙二醇
③CH CHCH OH
2-丙醇
①CH OH
甲醇
CH OH
⑤
练习1:写出下列醇的名称
OH
⑥
H
⑦
CH
④
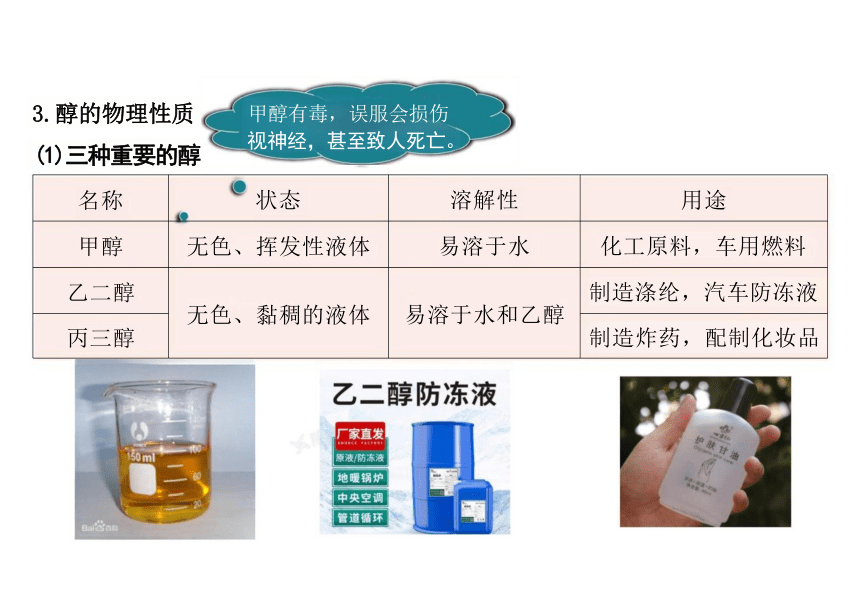
名称 状态 溶解性
用途
甲醇 无色、挥发性液体 易溶于水
化工原料,车用燃料
乙二醇 无色、黏稠的液体 易溶于水和乙醇
制造涤纶,汽车防冻液
丙三醇
制造炸药,配制化妆品
甲醇有毒,误服会损伤 视神经,甚至致人死亡。
3.醇的物理性质
(1)三种重要的醇
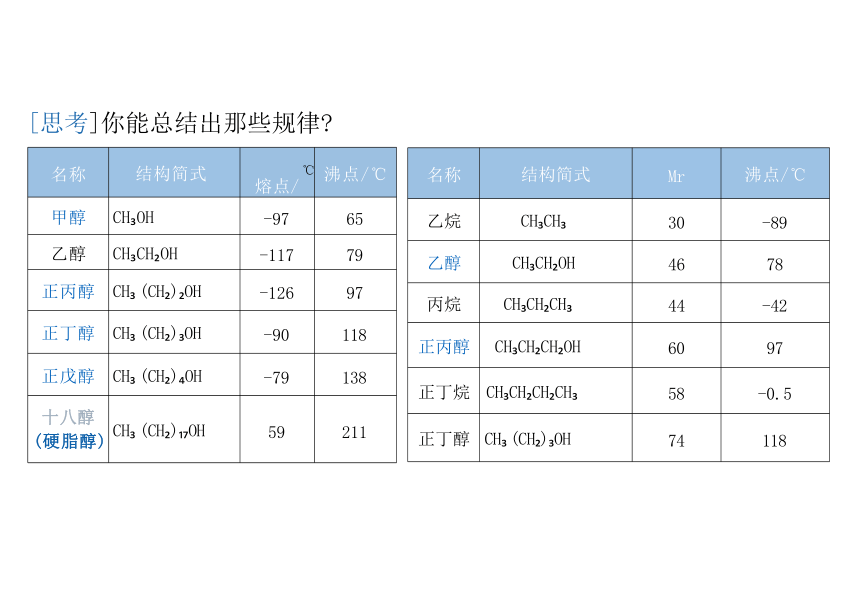
名称 结构简式 Mr
沸点/℃
乙烷 CH CH 30
-89
乙醇 CH CH OH 46
78
丙烷 CH CH CH 44
-42
正丙醇 CH CH CH OH 60
97
正丁烷 CH CH CH CH 58
-0.5
正丁醇 CH (CH ) OH 74
118
名称 结构简式 ℃ 熔点/
沸点/℃
甲醇 CH OH -97
65
乙醇 CH CH OH -117
79
正丙醇 CH (CH ) OH -126
97
正丁醇 CH (CH ) OH -90
118
正戊醇 CH (CH ) OH -79
138
十八醇 (硬脂醇) CH (CH ) OH 59
211
[思考]你能总结出那些规律
沸 点 :①饱和一元醇的沸点随碳原子个数的增加而升高。
原 相对分子质量个,范德华力个
图含碳原子数相同的醇沸点随羟基个数的增加而升高。
。 原 由于羟基数目增多分子间形成的氢键增多,沸点升高
图对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点 原 因: 分 子 间 形 成 的 氢 键
溶解性:低级脂肪醇易溶于水,饱和一元醇溶解度随C原子递增而减小
甲醇、乙醇、丙醇、乙二醇、丙三醇等可与水以任意比例混溶。
原因:醇分子间存在氢键。
密 度 :醇的密度比水的密度小。
1、下列物质的沸点按由高到低的顺序排列正确的是(C)
①丙三醇②丙烷 ③乙二醇 ④乙醇
A.①②③④ B.④③②①
C.①③④② D.①③②④
2、只用水就能鉴别的一组物质是(A )
A.苯 乙醇 四氯化碳 B.乙醇 乙酸 戊烷
C.乙二醇 甘油 溴乙烷 D.苯 己 烷 甲苯
3.下列各组物质中互为同系物的是
A.乙二醇与丙三醇
B. O H 与 CH OH
c 乙醇与2-丙醇
D. OH 与 CH OH
分析醇分子结构中的官能团和化学键。
H H
lδ+δ-δ+
H —C—C—0—H
|(2) ①
H H
醇的化学性质主要由羟基官能团所决定。在醇分子中,由于氧原子吸引电子 的能力比氢原子和碳原子的强,使O—H 和C—O 的电子都向氧原子偏移。
①中的O-H键易断裂,使羟基氢原子被取代
②中的C-O 键易断裂,脱羟基,发生取代反应/消去反应
目标二醇的化学性质(以乙醇为例)
1.置换反应
乙醇与金属钠发生置换反应:2C H OH+2Na—→2C H ONa+H 个
现象:反应缓慢,先沉后浮。不熔、不游、不响(对比Na与水的反应)。
结论:通过与金属钠的反应可测定醇分子中羟基的个数
思考:写出乙二醇、丙三醇与钠反应化学方程式。
乙醚:无色、易挥发的液体,有特殊气味,有麻醉作用,易溶于有机溶剂
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。 醚的结构可用R—O—R′ 来表示。
2.取代反应
(1)醇与浓氢卤酸的取代反应 例如:乙醇与浓氢溴酸混合加热
(2)醇分子间脱水成醚的取代反应
反应机理:一分子脱羟基,另一分子脱羟基氢,生成醚和水
R-OH 十H0-R`→R-0-R`+H O
【练习】试写出甲醇分子间脱水的化学反应方程式
【练习】试写出甲醇和乙醇脱水的化学反应方程式
【思考】试写出乙二醇分子间脱水的化学反应方程式
CH 2 CH 浓硫酸 CH ——CH
0
OH OH CH ——CH
1,4-二氧六环乙醚
取代反应
o+H O
2
CH CO -OH+H O-C H
乙醇
浓硫
酸
乙酸
碎瓷片一
(防止暴沸)
CH COOC H +H O
①中和乙酸
②溶解乙醇
③降低酯在水中的溶解度
(3)酯化反应 酸脱羟基,醇脱氢
乙醇与乙酸发生酯化反应的化学方程式:
浓硫酸,
饱和Na CO 溶液
mL, 放入几片碎瓷片(防止暴沸),加热,使液体温度迅速升至170℃。
②将产生的气体先通入氢氧化钠溶液除去杂质,再分别通入酸性高锰酸钾 溶液和溴的四氯化碳溶液中
实验现象: 酸性高锰酸钾溶液褪色,溴的四氯化碳溶液褪色
实验操作:①在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20
2.消去反应
(1)实验探究
实验装置:
温度计
乙醇和 浓硫酸 混合液
碎瓷片
酸性高锰
酸钾溶液
氢氧化
钠溶液
溴的四 氯化碳 溶液
10%氢 氧化钠 溶液
酸性 KMn0 溶液
4
溴的四氯 化碳溶液
H H
H— —H O CH ==CH 个+H O
H H
实验室制乙烯常用此方法
杂质来源
C H OH+2H SO (浓)→2C+2SO 个+5H O
C+2H SO △CO +2SO +2H O
℃
S
0
H
17
浓
(2)实验结论
乙醇在浓硫酸作用下,加热到170℃,发生了消去反应,生成乙烯。
③混合液变黑的原因是什么 浓硫酸将无水乙醇氧化生成碳的单质
④氢氧化钠溶液的作用是什么 除去乙烯中混有的CO 、SO , 以及挥发出来的 乙醇等气体
⑤使液体温度迅速升到170℃的原因是什么
无水乙醇和浓硫酸混合物在140℃时脱水生成乙醚。
(3)实验注意事项
①浓硫酸和碎瓷片的作用是什么
②温度计水银球的位置 反应液中
浓硫酸:催化剂和脱水剂;
碎瓷片:防止暴沸。
★醇发生消去反应的必备条件:
连有羟基(—OH)的碳原子必须有相邻的碳原子,且相邻的碳原子上 必须连有氢原子
判断下列醇能否发生消去反应 若能,请写出反应方程式。
OH
OH
【练习】试写出CH —CH —CH—CH 消去反应的化学反应方程式
OH
★若醇分子中与—OH 相连的碳原子有两个或三个邻位碳原子,且邻位
碳原子上均有氢原子时,发生消去反应可能生成不同的产物。
【练习】试写出 CH —CH 消去反应的化学反应方程式
OH OH
★二元醇发生消去反应后可能在有机化合物中引入碳碳三键或两个碳碳
双键。
反应机理:
Cu丝红色又变为黑色
反应过程为:
②CH CH OH+CuO—△→CH CHO+H O+Cu
由①+②×2得:2CH CH OH+O Cu>2CH CHO+2H
反应中Cu作催化剂,CuO为中间产物。
吨吨0 吨 … Cu丝黑色又变为红色,
液体有刺激性气味
有机物的氧化反应:得O 或去H
有机物的还原反应:去O 或 得H
乙醇在铜或银作催化剂、加热的条件下与空气中的氧气反应生成乙醛。
3.氧化反应
(1)催化氧化
CHO +2H O
A 不可被氧化
CH OH 十O
CH OH
(CH ) COH 十O
【练习】写出下列有机物催化氧化的反应方程式:
醇能被催化氧化必须有α-H
[拓展]醇的催化氧化规律
乙醇与酸性重铬酸钾
溶液的反应
思考:所有的醇都能使酸性高 锰酸钾溶液褪色吗
氧化 氧化
CH CH OH—→CH CHO—→CH COOH。
乙醇 乙醛 乙酸
乙醇能被酸性重铬酸钾(或KMnO ) 溶液氧化,其过程分为两个阶段:
(2)强氧化剂氧化
C,H OH+30, 点燃2CO,+3H,O
淡蓝色火焰
(2)强氧化剂氧化
酸性重铬酸钾(K Cr O )
Cr O2-—→Cr +
酸性高锰酸钾(K Cr O )
MnO4—→ Mn +
(橙红色) (暗绿色)
(紫红色) ( 无色)
(3)燃烧
0
反应
断键位置
与金属反应
①
催化氧化
①③
消去反应
②④
分子间脱水
①②
与HX反应
②
课堂小结
谢 谢 !
第一课时醇
羟基(-OH)与饱和碳原子相连的化合物称为醇。
羟基(-OH) 与苯环直接相连的化合物称为酚。
目标一醇的概述
④ CH —OH
CH —OH
⑨CH =CHCH OH
例:下列物质属于醇类有①②③④⑤⑦⑨, 属于酚类有 ⑥⑧。
①CH OH ②HOCH CH CH ③CH CHCH OH
OH QH
⑦ ⑧ l
⑥
羟基与饱和碳原子相连的化合物
羟基( -OH)
官能团
结构
定义
1.醇的概念
由烷烃所衍生的一元醇,叫做饱和一元醇。
饱和一元醇通式:C,H n+1OH或C,H n+20 (n≥1), 可简写为R—OH。
CH OH
CH -OH CH -OH
CH - -OH
CH-OH CH -OH
一元醇
二元醇
多元醇
脂肪醇
脂环醇
芳香醇
甲醇
乙二醇
丙三醇
饱和醇 CH CH OH 乙醇
CH =CHCH OH 丙烯醇
按羟基
所连
烃基种
类
分子中 所含羟 基的数 目
CH OH 苯甲醇
2 .醇的分类
醇的分类
不饱和醇
环己醇
OH
3、醇的命名:
(1)选主链:选择含官能团的最长碳链,按主链上的碳原子数目定“某醇”
(2)定编号:从离官能团近的一端编号,遵循位次序号之和最小原则。
(3)写名称:从简入繁,先写烃基,再写母体,注意用阿拉伯数字表明官能团所处碳 原子序号。
编号顺序: 碳碳三键或碳碳双键>-OH> 烃基>卤素原子>-NO
CH CH CH OH
1-丙醇(正丙醇) 2-丙醇(异丙醇) 2-甲基-2,3-丁二醇
苯甲醇 邻甲基苯酚 环己醇 苯酚 丙烯醇
H
⑨CH =CHCH OH
②CH CH CH OH
1-丙醇
CH —OH
CH —OH
乙二醇
③CH CHCH OH
2-丙醇
①CH OH
甲醇
CH OH
⑤
练习1:写出下列醇的名称
OH
⑥
H
⑦
CH
④
名称 状态 溶解性
用途
甲醇 无色、挥发性液体 易溶于水
化工原料,车用燃料
乙二醇 无色、黏稠的液体 易溶于水和乙醇
制造涤纶,汽车防冻液
丙三醇
制造炸药,配制化妆品
甲醇有毒,误服会损伤 视神经,甚至致人死亡。
3.醇的物理性质
(1)三种重要的醇
名称 结构简式 Mr
沸点/℃
乙烷 CH CH 30
-89
乙醇 CH CH OH 46
78
丙烷 CH CH CH 44
-42
正丙醇 CH CH CH OH 60
97
正丁烷 CH CH CH CH 58
-0.5
正丁醇 CH (CH ) OH 74
118
名称 结构简式 ℃ 熔点/
沸点/℃
甲醇 CH OH -97
65
乙醇 CH CH OH -117
79
正丙醇 CH (CH ) OH -126
97
正丁醇 CH (CH ) OH -90
118
正戊醇 CH (CH ) OH -79
138
十八醇 (硬脂醇) CH (CH ) OH 59
211
[思考]你能总结出那些规律
沸 点 :①饱和一元醇的沸点随碳原子个数的增加而升高。
原 相对分子质量个,范德华力个
图含碳原子数相同的醇沸点随羟基个数的增加而升高。
。 原 由于羟基数目增多分子间形成的氢键增多,沸点升高
图对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点 原 因: 分 子 间 形 成 的 氢 键
溶解性:低级脂肪醇易溶于水,饱和一元醇溶解度随C原子递增而减小
甲醇、乙醇、丙醇、乙二醇、丙三醇等可与水以任意比例混溶。
原因:醇分子间存在氢键。
密 度 :醇的密度比水的密度小。
1、下列物质的沸点按由高到低的顺序排列正确的是(C)
①丙三醇②丙烷 ③乙二醇 ④乙醇
A.①②③④ B.④③②①
C.①③④② D.①③②④
2、只用水就能鉴别的一组物质是(A )
A.苯 乙醇 四氯化碳 B.乙醇 乙酸 戊烷
C.乙二醇 甘油 溴乙烷 D.苯 己 烷 甲苯
3.下列各组物质中互为同系物的是
A.乙二醇与丙三醇
B. O H 与 CH OH
c 乙醇与2-丙醇
D. OH 与 CH OH
分析醇分子结构中的官能团和化学键。
H H
lδ+δ-δ+
H —C—C—0—H
|(2) ①
H H
醇的化学性质主要由羟基官能团所决定。在醇分子中,由于氧原子吸引电子 的能力比氢原子和碳原子的强,使O—H 和C—O 的电子都向氧原子偏移。
①中的O-H键易断裂,使羟基氢原子被取代
②中的C-O 键易断裂,脱羟基,发生取代反应/消去反应
目标二醇的化学性质(以乙醇为例)
1.置换反应
乙醇与金属钠发生置换反应:2C H OH+2Na—→2C H ONa+H 个
现象:反应缓慢,先沉后浮。不熔、不游、不响(对比Na与水的反应)。
结论:通过与金属钠的反应可测定醇分子中羟基的个数
思考:写出乙二醇、丙三醇与钠反应化学方程式。
乙醚:无色、易挥发的液体,有特殊气味,有麻醉作用,易溶于有机溶剂
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。 醚的结构可用R—O—R′ 来表示。
2.取代反应
(1)醇与浓氢卤酸的取代反应 例如:乙醇与浓氢溴酸混合加热
(2)醇分子间脱水成醚的取代反应
反应机理:一分子脱羟基,另一分子脱羟基氢,生成醚和水
R-OH 十H0-R`→R-0-R`+H O
【练习】试写出甲醇分子间脱水的化学反应方程式
【练习】试写出甲醇和乙醇脱水的化学反应方程式
【思考】试写出乙二醇分子间脱水的化学反应方程式
CH 2 CH 浓硫酸 CH ——CH
0
OH OH CH ——CH
1,4-二氧六环乙醚
取代反应
o+H O
2
CH CO -OH+H O-C H
乙醇
浓硫
酸
乙酸
碎瓷片一
(防止暴沸)
CH COOC H +H O
①中和乙酸
②溶解乙醇
③降低酯在水中的溶解度
(3)酯化反应 酸脱羟基,醇脱氢
乙醇与乙酸发生酯化反应的化学方程式:
浓硫酸,
饱和Na CO 溶液
mL, 放入几片碎瓷片(防止暴沸),加热,使液体温度迅速升至170℃。
②将产生的气体先通入氢氧化钠溶液除去杂质,再分别通入酸性高锰酸钾 溶液和溴的四氯化碳溶液中
实验现象: 酸性高锰酸钾溶液褪色,溴的四氯化碳溶液褪色
实验操作:①在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20
2.消去反应
(1)实验探究
实验装置:
温度计
乙醇和 浓硫酸 混合液
碎瓷片
酸性高锰
酸钾溶液
氢氧化
钠溶液
溴的四 氯化碳 溶液
10%氢 氧化钠 溶液
酸性 KMn0 溶液
4
溴的四氯 化碳溶液
H H
H— —H O CH ==CH 个+H O
H H
实验室制乙烯常用此方法
杂质来源
C H OH+2H SO (浓)→2C+2SO 个+5H O
C+2H SO △CO +2SO +2H O
℃
S
0
H
17
浓
(2)实验结论
乙醇在浓硫酸作用下,加热到170℃,发生了消去反应,生成乙烯。
③混合液变黑的原因是什么 浓硫酸将无水乙醇氧化生成碳的单质
④氢氧化钠溶液的作用是什么 除去乙烯中混有的CO 、SO , 以及挥发出来的 乙醇等气体
⑤使液体温度迅速升到170℃的原因是什么
无水乙醇和浓硫酸混合物在140℃时脱水生成乙醚。
(3)实验注意事项
①浓硫酸和碎瓷片的作用是什么
②温度计水银球的位置 反应液中
浓硫酸:催化剂和脱水剂;
碎瓷片:防止暴沸。
★醇发生消去反应的必备条件:
连有羟基(—OH)的碳原子必须有相邻的碳原子,且相邻的碳原子上 必须连有氢原子
判断下列醇能否发生消去反应 若能,请写出反应方程式。
OH
OH
【练习】试写出CH —CH —CH—CH 消去反应的化学反应方程式
OH
★若醇分子中与—OH 相连的碳原子有两个或三个邻位碳原子,且邻位
碳原子上均有氢原子时,发生消去反应可能生成不同的产物。
【练习】试写出 CH —CH 消去反应的化学反应方程式
OH OH
★二元醇发生消去反应后可能在有机化合物中引入碳碳三键或两个碳碳
双键。
反应机理:
Cu丝红色又变为黑色
反应过程为:
②CH CH OH+CuO—△→CH CHO+H O+Cu
由①+②×2得:2CH CH OH+O Cu>2CH CHO+2H
反应中Cu作催化剂,CuO为中间产物。
吨吨0 吨 … Cu丝黑色又变为红色,
液体有刺激性气味
有机物的氧化反应:得O 或去H
有机物的还原反应:去O 或 得H
乙醇在铜或银作催化剂、加热的条件下与空气中的氧气反应生成乙醛。
3.氧化反应
(1)催化氧化
CHO +2H O
A 不可被氧化
CH OH 十O
CH OH
(CH ) COH 十O
【练习】写出下列有机物催化氧化的反应方程式:
醇能被催化氧化必须有α-H
[拓展]醇的催化氧化规律
乙醇与酸性重铬酸钾
溶液的反应
思考:所有的醇都能使酸性高 锰酸钾溶液褪色吗
氧化 氧化
CH CH OH—→CH CHO—→CH COOH。
乙醇 乙醛 乙酸
乙醇能被酸性重铬酸钾(或KMnO ) 溶液氧化,其过程分为两个阶段:
(2)强氧化剂氧化
C,H OH+30, 点燃2CO,+3H,O
淡蓝色火焰
(2)强氧化剂氧化
酸性重铬酸钾(K Cr O )
Cr O2-—→Cr +
酸性高锰酸钾(K Cr O )
MnO4—→ Mn +
(橙红色) (暗绿色)
(紫红色) ( 无色)
(3)燃烧
0
反应
断键位置
与金属反应
①
催化氧化
①③
消去反应
②④
分子间脱水
①②
与HX反应
②
课堂小结
谢 谢 !
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
