6.2.1 化学反应速率 (课件) -高中化学人教版(2019)必修第二册(共48张PPT)
文档属性
| 名称 | 6.2.1 化学反应速率 (课件) -高中化学人教版(2019)必修第二册(共48张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 19.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 13:08:15 | ||
图片预览










文档简介
(共48张PPT)
第六章化学反应与能量
第一节化学反应速率与限度
第1课时 化学反应速率
环节一:提出问题,引入新课
◆ 体会不同化学反应的快慢
>不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我们以上的判断 方法都是定性地描述反应的快慢。
在科学研究和实际应用中,往往需要定量地描述一个反应的快慢。
定性描述
光的传播速度是很快的;
> 光在空气中的传播速度3×108m/s 。 定量描述
定量描述
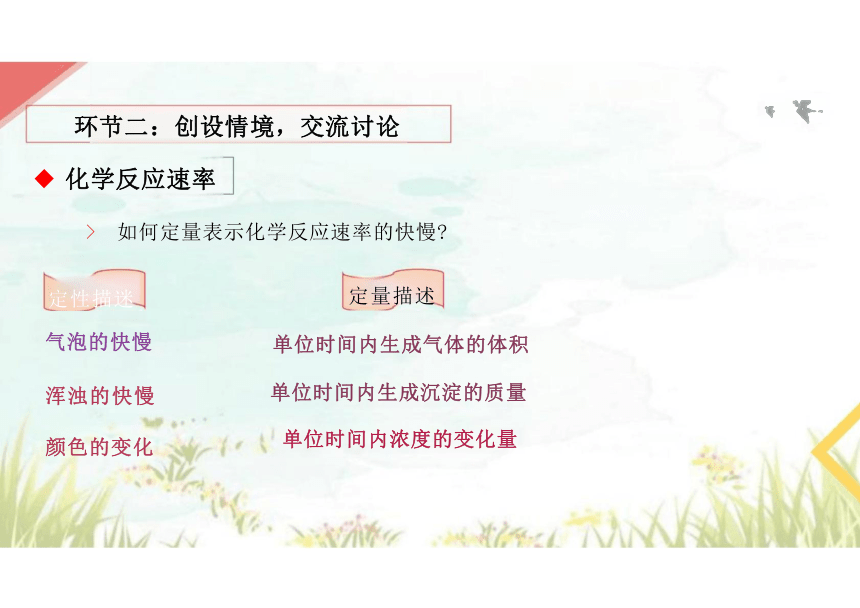
单位时间内生成气体的体积
单位时间内生成沉淀的质量
单位时间内浓度的变化量
◆ 化学反应速率
> 如何定量表示化学反应速率的快慢
定性描迷
气泡的快慢
浑浊的快慢
颜色的变化
环节二:创设情境,交流讨论
环节二:创设情境,交流讨论
◆ 化学反应速率
◆定义 化学反应速率是用来衡量化学反应过程进行的快慢的物理量。
(均取正值)表示。
mol/(L·min) 或 mol/(L·s) 或mol-L- min-1
◆ 表示方法
◆表达式
◆ 常用单位
通常用单位时间内 反应物浓度的减少量或生成物浓度的增加量
环节二:创设情境,交流讨论
◆ 化学反应速率
例1 某反应中反应物A的浓度在5min内由6mol/L变成了2mol/L, 求该反应物
这段时间内的平均反应速率。
v(A)= 6mol/L-2mol/L =0.8 mol/(L·min)
5min
环节二:创设情境,交流讨论
◆ 化学反应速率
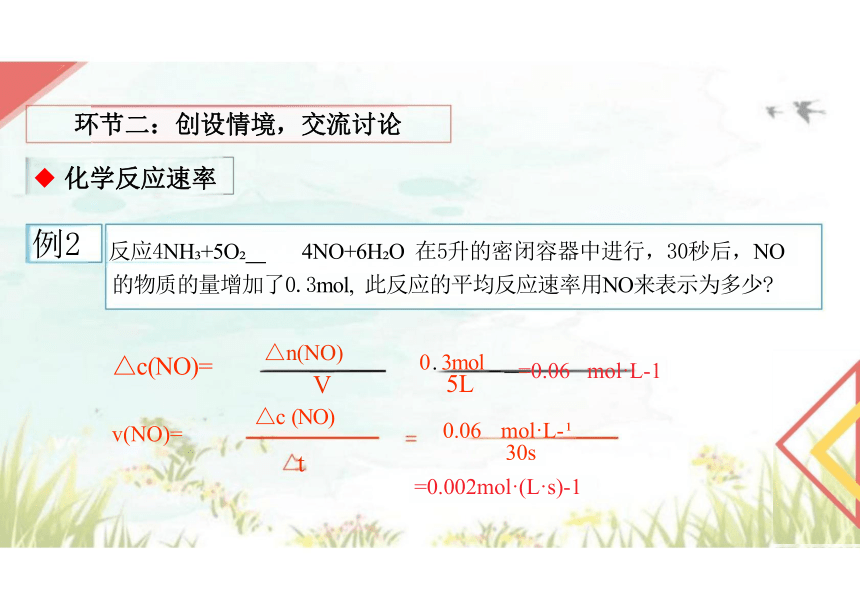
例2 反应4NH +5O 4NO+6H O 在5升的密闭容器中进行,30秒后,NO 的物质的量增加了0.3mol, 此反应的平均反应速率用NO来表示为多少
—=0.06 mol·L-1
mol·L-
30s
△n(NO)
V
△c (NO)
t
△c(NO)=
v(NO)=
0 . 3mol
5L
0.06
=0.002mol·(L·s)-1
环节二:创设情境,交流讨论
◆ 化学反应速率
注意事项 > 化学反应速率只取正值,没有负值。
通过公式计算出的化学反应速率是一段时间内的平均速率,而不是 瞬时速率。不同时刻的化学反应速率不一定相同。
> 对于固体物质或纯液体物质,由于我们认为它们的“浓度”是不变
的,所以一般不用固体或纯液体表示一个化学反应的速率。
对于同一化学反应,用不同的物质表示化学反应速率,其数值可能
不相同。各物质表示的反应速率比等于该反应方程式中化学计量数
的比。
◆ 探究:影响化学反应速率的因素
催化剂是现代化学中关键而神奇的物质之一。剧统计,有80%以
上的化工生产过程使用了催化剂,目的是增大反应速率,提高生
产效率。在资源利用、能源开发、医药制造、环境保护等领域,
催化剂有着广泛的应用。
催化剂十分神奇,它能极大地提高化学反应速率,而自身的组成、化学性质和质量在 反应前后不发生变化;它和一些反应体系的关系就像钥匙与锁的关系,具有一定的选
择性。
催化剂神奇面纱至今尚未完全解开,对催化剂的研究是当代化学一个极具魅力和应用
前景的重要课题。
环节三:提出假设,实验验证
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
[问题]
我们已经知道催化剂可以影响化学反应速率,此外,还有哪些反应条件会影
响化学反应的速率
[假设]
反应温度、反应物浓度。
[用品]
5%H O 溶液、1 mol/LFeCl 溶液、0.1mol/L盐酸、1mol/L盐酸、大理石碎块、 冷 水 、热水、试管、试管夹、烧杯、量筒、胶头滴管。
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
√ 反应温度的影响
在两支大小相同的试管中均加入2mL5%H O 溶液,同时滴入2滴1mol/LFeCl ,
不同温度环境
实验现象
冷水
产生气泡速率较慢
热水
产生气泡速率较快
溶液。待试管中均有适量气泡出现时,将其中一支试管放入盛有冷水的烧杯中,另
一支试管放入盛有热水的烧杯中,观察现象并进行对比。
其他条件相同, 升高温度,加快反应速率。
步骤与试剂
比较各试管中的现象
试管1 5滴1 mol/L的HCl溶液; 各加入等量 大理石小碎 块
试管1气泡产生较快
试管2气泡产生较慢
试管2 5滴0.1mol/L的HCl溶液;
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
√ 反应物浓度的影响
其他条件相同,增大反应物浓度,加快反应速率。
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
√ 固体表面积的影响
取两支大小相同的试管,分别加入1g块状碳酸钙和1g粉末状碳酸钙,同时向两支试 管中滴加10mL 、1mol/L的盐酸,观察现象并进行对比
碳酸钙状态
实验现象
块状
产生气泡较慢
粉末状
产生气泡较快
其它条件不变时,
固体反应物表面积越大,化学反应速率增大
图6-16压强增大,气体浓度增大
其他条件相同,增大压强(减小容器容积),相当于增大反应物浓度,增大反应速率。
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
c(B) =
√ 压强的影响
n(B)
V
规律(在其它条件相同时)
反应物的化学性质越活泼,化学反应速率越快;反之则越慢
升高温度,化学反应速率加快;反之减慢
增大反应物的浓度,化学反应加快;反之减慢
使用催化剂,化学反应速率加快
增大反应物固体面积,化学反应加快;反之减慢
有气体参加的反应,增大压强,化学反应速率增大 ;反之减慢
影响化学反应 速率的因素
内 因 性 质
外 因 温 度
反应物的浓度
催化剂
反应物表面积
压强
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
变量控制探究影响化学反应速率因素的一般原则是“定多变一”,
即要保持其他变量不变,改变其中一个变量的值进行实验,测定数
据,通过系列实验,找出变量对反应速率的影响。其探究流程为
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
自变量(如浓 度、温度等)
因变量(如反 应速率)
确定研不确定
究对象
(化学反应)
确定因变量 (反应速率) 的观测指标
改变单 一变量
◆方法导引
结论
下列调控反应速率的措施或实验中,分别利用或体现了哪 (1)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。 些影响反应速率的因素
固体反应物表面积
(2)把食物存放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。
温度
(3)做化学实验时,为加速反应的进行,通常将块状或颗粒 混匀,或者将固体试剂溶于水配成溶液后再进行实验。 状的固体药品研细并
固体反应物表面积
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。 反应物的浓度
环节三:提出假设,实验验证
探究:影响化学反应速率的因素
o(B)=Ac(B
表示化学反应进行的快慢
浓度、温度、压强、催化 剂、状态、表面积等
◆ 归纳整理
化学反 应速率
表达式
含义
影响因素
环节四:归纳整理,巩固提升
◆ 巩固提升
1.将4mol A气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:
2A(g)+B(g)=2C(g)。若经2s后测得C 的物质的量浓度为1.2mol-L-1,下列说法正确
的 是( C
A. 用物质A 表示的反应速率为1.2mol-L-1.s-1
B. 用物质B表示的反应速率为0.6mol·L-1.s-1
C.2s 时物质A的转化率为30%
D.2s时物质B的物质的量浓度为0.6mol-L-1
环节四:归纳整理,巩固提升
◆ 巩固提升
2、在恒温下,使反应C(s)+H O(g)====CO(g)+H (g)
在一容积可变的密闭容器中进行,改变下列条件,其反应速率如何变化
①若加压将容器的体积缩小一半 增大。
②若保持体积不变,充入N 使体系压强增大不 变。
③若保持压强不变,充入N 使容器体积变大减 小。
环节四:归纳整理,巩固提升
◆ 巩固提升
3、在2A+B=3C+4D 反应中,表示该反应速率最快的是( B ) A.v(A)=0.5mol·L-1.s-1
B.v(B)=0.3mol.L-1.s-1
C.v(C)=0.8mol-L-1.s-1
D.v(D)=1mol-L- .s-1
环节四:归纳整理,巩固提升
◆ 巩固提升
4、某小组设计如图实验,欲使甲中试管先出现浑浊,下列操作一定达不到目
的的是D )
A.向甲烧杯中加入适量CaO
B.向甲中试管内滴加适量浓硫酸
C.向乙烧杯中加入适量冰块
D. 增大甲装置所在环境的压强
5 mL 0.1 mol/L
Na S O 溶液
和5 mL0.5 mol/L
H SO 溶液
水(室温) .
乙
环节四:归纳整理,巩固提升
5 mL 0.1 mol/L Na S O 溶液
和5 mL0.5 mol/L
H SO 溶液
甲
可逆反应 教师点拨25min
1.概念:在相同条件下,既能向 正反应方向进行
同时又能向_ 的反应。
逆反应方向进行
2.特征:
双向 )—反应物延向反应生成物
两同 —相同条件下,正、逆反应同一条件下 同时进行
共存 一反应物、生成物同时存在
3.表示:化学方程式中用 表示。 一
可逆反应
4.很多化学反应都有一定的可逆性,不同反应的可逆性不同,有些化学反应在同
一条件下可逆程度很小,如2Na+2H O=2NaOH+H ^ ,视 为“不可逆”反应。
[自学检测对于可逆反应2SO +O 2SO , 长时间后,180原子()
A. 只存在于O 中
B. 只存在于O 和SO 中
在 混 充入一定量的18O , 足 够
D
[思考]对于可逆反应而言,反应物会转变成生成物, 而生成物又会分解成反应物,那岂不是无穷无尽也
正逆反应同时进行
反应物、生成物同时存在
C. 只存在于O 和SO 中
D. 存在于O 、SO 和SO 中
时间 (min) 0 10 20 30 40 50
60
c(SO ) 1.00 0.70 0.50 0.38 0.30 0.30
0.30
c(O ) 0.50 0.35 0.25 0.19 0.15 0.15
0.15
c(SO ) 0 0.30 0.50 0.62 0.70 0.70
0.70
(1)当反应刚开始时,反应物和生成物的浓度哪个大
(2)当反应刚开始时,正反应与逆反应哪个反应速率大
(3)随着反应的进行,反应物和生成物浓度如何变化
(4)随着反应的进行,v (正)与v (逆)怎样变化
v (正)↓ v (逆)个
化学平衡状态的建立
在某密闭容器中发生反应:2SO +O 化剂2SO
时间 (min) 0 10 20 30 40 50
60
c(SO ) 1.00 0.70 0.50 0.38 0.30 0.30
0.30
c(O ) 0.50 0.35 0.25 0.19 0.15 0.15
0.15
c(SO ) 0 0.30 0.50 0.62 0.70 0.70
0.70
c/mol-L-1
1.0
t/min
化学平衡状态的建立 催化剂
在某密闭容器中发生反应:2SO +O <△2SO
对于此浓度-时间图像,为何40 min后3种物 质的浓度保持不变 是反应停止了吗
浓度-时间图像
化学平衡状态的建立 -y: (mol/L·min)-
[思考] 从浓度对反应速率的 影响入手,分析正、逆反应 速率随时间是如何变化的 用速率时间象来表示此变 化过程弟 V表观
浓度- 时间图像 40 t/min
①开始阶段: 开始时c(SO )、c(O ) 大 ,c(SO )=0 只有正反应进行,v(逆)=0
②反应的发生阶段: 瞬间后c(N ) 、c(H ) 变小,c(NH )≠0 正逆反应都进行,v(逆)≠0,v (正)>v (逆)
一段时间后c(SO )、c(O )逐渐变小,c(SO )逐渐增大, 三种物质的浓度达到一个特定值 v (正)=v (逆)≠0
化学平衡状态
1.定义:
在一定条件下,可逆反应中,当正、逆两个方向的反应速率相等时,反应物的浓度 和生成物的浓度都不在改变。达到了一种表面静止的状态,我们称之为“化学平衡 状态”,即达到了化学反应的限度,化学反应的限度决定了反应物在该条件下转化 为生成物的最大转化率。
定 各组分的浓度保持不变
变 条件改变,原平衡被破坏,在新的条件下建立新的平衡
温度,浓度改变都能使平衡移动 、加催化剂不能
可逆反应
v (正)=v (逆)
动态平衡
化学平衡状态
2.特征:
判断可逆反应是否达到 平衡的直接标志。
熔勤平能
V正=V逆
逆 等 动
V正
V逆
反应速率
0 t
时间t
≠0
[例] 对于可逆反应N (g)+3H (g)=2NH (g),判 断 :
①一段时间v正(N ):v正(NH )=1:2 ,证明达平衡( )
②一段时间v正(N ):v逆(H )=1:3 ,证明达平衡 ()
③一段时间v正(H ):v逆(NH )=2:3, 证明达平衡( ) 3:2
(1)正、逆反应速率相等
①同种物质: V 正 =V 逆≠0
②不同种物质: V正(A) V逆(B)
步骤①判断有无正逆
②判断是否成比例
A 化学计量数
二
B化学计量数
化学平衡状态的判定
直接标志
[例] 对于可逆反应N (g)+3H (g)=2NH (g), 判 断 :
①单位时间内断裂1mol N=N的同时断裂3mol H-H,证明达平衡。()
②单位时间内断裂1molXN 的同时断裂2mol N-H,证明达平衡。()
化学平衡状态的判定
拓展:根据化学键的断键与成键
反应物断键、生成物成键:正向 生成物断键、反应物成键:逆向
步骤①判断有无正逆
②判断是否成比例
X
6mol
化学平衡状态的判定
直接标志
(2)各组分的浓度保持一定
①各组分的浓度不随时间的改变而改变;
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
X P为定值,任意时刻都保持不变
[例]在恒温恒容的密闭容器中发生反应:
2NO(g)+O (g)=2NO (g),当容器中压强不变时,说明反应已达到平衡状态()
入 P为变量
达到平衡状态。()
P为定值,任意时刻都保持不变
[例]在恒温恒容的容器中发生反应
A(s)+3B(g)=2C(g)+D(g)当容器的压强不发生改变时,化学反应达到平衡状态。()
间接标志—— “变量不变”
①体系中的总压强不变 有压强,关注气体系数 (适用于反应前后气体化学计量数和不等的反应)。
[例]在密闭容器中发生反应:X(g)+Y(g)=2Z(g)。恒温恒容时,容器内压强不变,表明该反应
化学平衡状态的判定
X
化学平衡状态的判定
间接标志—— “变量不变”
②体系中颜色不再改变
(适用于反应混合物中存在有颜色变化的物质)。
[例]对于反应:
2HI(g)=H (g)+1 (g),当反应体系颜色不再变化,说明反应已达到平衡状态()
化学平衡状态的判定
间接标志——“变量不变”
③平均相对分子质量不变
(适用于全是气体参加的反应前后化学计量数和不等的反应)。
[ 例 ]在恒容密闭容器中发生反应:
CO(g)+H O(g)=CO (g)+H (g),当容器中混合气体的平均相对分子质量恒定不变时,反 应达到平衡状态。()
X
[例]密闭容器中,发生反应:N (g)+3H (g)=2NH (g), 当容器中混合气体的平均相对分子 质量恒定不变时,反应达到平衡状态。()
化学平衡状态的判定
间接标志——“变量不变”
③平均相对分子质量不变
(适用于全是气体参加的反应前后化学计量数和不等的反应)。
[ 例 ]一定温度下,在恒容容器中投入又定量纯净的氨基甲酸铵,发生下列反应:
NH COONH (s)=2NH (g)+CO (g)气体的平均摩尔质量不变时,达到化学平衡状态()
X
平均摩尔质量=混合物中各组成部分的摩尔质量×该组成部分的物质的量分数( 若 是氢
体组成可以是体积分数)
[ 例 ]一定温度下,在恒容容器中发生下列反应:
NH COONH (s)=2NH (g)+CO (g),当氨气的体积分数保持不变时,则达到化学平衡状态 ()
X
[例]恒温恒容密闭容器中,发生反应:PCl (g)+Cl (g)=PCl (g)当混合气体的密度不再改变时, 可以表示反应达到平衡状态。()
X
[例]相同温度下,恒容密闭容器均进行反应:X(g)+Y(s)=Z(g)气体密度不再改变,说明达 到平衡状态。()
间 接 标 志——“变量不变”
④对绝热密闭容器,温度保持不变。
⑤对恒压容器全是气体参加,反应前后非等体积气体的反应,密度保持不变。
总之,选定反应中“变量”,即随反应进行而变化的量,当变量 不再变化时,反应已达平衡状态。
化学平衡状态的判定
有固体,密度紫脏行
[实战演练2min]可逆反应2NO (g)=2NO(g)+O (g) 在 体积固定的密闭容器中进行, 达到平衡状态的标志是 (填序号)。
①单位时间内生成n mol O 的同时生成2n mol NO
②单位时间两重成②0IO 的同时生成2n mol NO
③用NO 、NO、O 表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的压强不再改变的状态
混合气体的平均相对分子质量不再改变的状态
⑧v(NO )=2v(O ) 的状态
⑨v正(NO )=2v 逆(O )的状态
⑩h(O )不 再改变的状态
判一判● (正确的打“ √”,错误的打“×”)
(2)可逆反应达到平衡时,v 项 漂 组分浓度相等。
(3)可逆反应达到平时,反应停企各组分浓度不变。
(4)通过改变反应条件,可以使2 mol SO (g)和过量的O (g)反应得到2 mol SO 。
( )
平衡时,各组分浓度不再改变,并非相等
(1)2H +o 点燃2H 0与2H O电2H ↑+O 1互为可逆反应。()
( ) ( )
X
X
实战演练
可逆反应,2molSO 不能完全转化
动态平衡(依然进行)
1.在一密闭容器中,N +3H =2NH 反应达到平衡后,下
列说法中正确的是(c )
A.N 与H 不再化合,NH 不再分解合成氨反应属于 可逆反应
B. 单位时间内,消耗1 mol N 的同时消耗3 mol H
Q 容器内的总压强不随时间而变化
变量不变达平衡
b. N 、H 、NH 的物质的量浓度相等
实战演练
有压强,关注气体系数
中不能说明反应已达到平衡状态的是( D )
A. 容器内温度不变
B. 混合气体的密度不变 有固体,密度紫脏行
C. 混合气体的平均相对分子质量不变
单位时间内生成n mol D,同时消耗2n mol A
2.在一绝热(不与外界发生热交换)的恒容容器中,
发生放热反应2A(g)+B(s)=C(g)+D(g), 下列描述
实战演练
实战演练
3.CO和H 在一定条件下可以合成乙醇2CO(g)+
4H (g)=CH CH OH(g)+H O(g). 下列叙述中能说明
上述反应在一定条件下已达到平衡状态的是(B )
A.CO 全部转化为乙醇
反应体系中乙醇的物质的量浓度不再变化
C. 正反应和逆反应的化学反应速率均为零
D.CO 和H 以1:2的物质的量之比反应生成乙醇
学习目标
1.了解控制反应条件在生产、生活和科学 研究中的作用。
化学反应条件的控制 教 师 点 拨 2 5min
化工生产中化学反应条件的控制
1 . 目的:抑制有害的化学反应_ 和_促进有利的化学反应 2.方法: 改变化学反应的速度
改变条件
改变可逆反应进行的程度(限度)
3.实例:合成氨生产条件的选择
400~500℃: 温度较低时氨的产率较高,但温度低时 反应速率小,达到平衡需要的时间很长生产成本高。
10 MPa~30 MPa:压强越大,氨的产率越高,但对 动力和生产设备的要求越高。
实战演练
判一判o (正确的打“ √ ”,错误的打“×”)
(1)压强越大,合成氨的生产效率越高,所以应尽可能选
择高压条件。 强越大,对材料强度和设备制造的要 (× )
(2)化石燃料在燃烧过程中能产生污染环境的CO 、SO 等
大
压
有害气体。
(3)在工业生产实际中,反应速率越快越好。
用适当的反应条件获取适宜的反应速率
(√ ) (×)
下列措施可以提高燃料燃烧效率的是 C
①提高燃料的着火点②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化
⑤将煤气化处理 ⑥通入足量的空气
A.①③④⑤ B.②③⑤⑥
③④⑤⑥ D.①②③④
解析 燃料的着火点不可改变且与燃烧效率无关。
实战演练
实战演练
1.在一定条件下,对于密闭容器中进行的反应2SO (g) +O (g)=2SO (g), 下列说法中,能充分说明该反应 已经达到化学平衡状态的是( C )
A. 反应混合物中SO 、O 、SO 的物质的量之比为 2:1:2
B. 消耗SO 的速率与生成SO 的速率相等
反应混合物中SO 、O 、SO 的百分组成不再改
变
D. 生成O 的速率与生成SO 的速率相等
不成比例
实战演练
2.恒温恒容条件下.发生化学反应H (g)+I (g)=2HI(g),
下列选项中不能作为达到平衡状态的标志的是( B ) A. 混合气体颜色不再变化
单 位时间内形成n mol H—H的同时断裂2n mol H—I
C. 若该反应在隔热密闭体积恒定的容器中进行反应,体
系的温度不再变化
D.2v(H ) 正=v(HI)逆
第六章化学反应与能量
第一节化学反应速率与限度
第1课时 化学反应速率
环节一:提出问题,引入新课
◆ 体会不同化学反应的快慢
>不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我们以上的判断 方法都是定性地描述反应的快慢。
在科学研究和实际应用中,往往需要定量地描述一个反应的快慢。
定性描述
光的传播速度是很快的;
> 光在空气中的传播速度3×108m/s 。 定量描述
定量描述
单位时间内生成气体的体积
单位时间内生成沉淀的质量
单位时间内浓度的变化量
◆ 化学反应速率
> 如何定量表示化学反应速率的快慢
定性描迷
气泡的快慢
浑浊的快慢
颜色的变化
环节二:创设情境,交流讨论
环节二:创设情境,交流讨论
◆ 化学反应速率
◆定义 化学反应速率是用来衡量化学反应过程进行的快慢的物理量。
(均取正值)表示。
mol/(L·min) 或 mol/(L·s) 或mol-L- min-1
◆ 表示方法
◆表达式
◆ 常用单位
通常用单位时间内 反应物浓度的减少量或生成物浓度的增加量
环节二:创设情境,交流讨论
◆ 化学反应速率
例1 某反应中反应物A的浓度在5min内由6mol/L变成了2mol/L, 求该反应物
这段时间内的平均反应速率。
v(A)= 6mol/L-2mol/L =0.8 mol/(L·min)
5min
环节二:创设情境,交流讨论
◆ 化学反应速率
例2 反应4NH +5O 4NO+6H O 在5升的密闭容器中进行,30秒后,NO 的物质的量增加了0.3mol, 此反应的平均反应速率用NO来表示为多少
—=0.06 mol·L-1
mol·L-
30s
△n(NO)
V
△c (NO)
t
△c(NO)=
v(NO)=
0 . 3mol
5L
0.06
=0.002mol·(L·s)-1
环节二:创设情境,交流讨论
◆ 化学反应速率
注意事项 > 化学反应速率只取正值,没有负值。
通过公式计算出的化学反应速率是一段时间内的平均速率,而不是 瞬时速率。不同时刻的化学反应速率不一定相同。
> 对于固体物质或纯液体物质,由于我们认为它们的“浓度”是不变
的,所以一般不用固体或纯液体表示一个化学反应的速率。
对于同一化学反应,用不同的物质表示化学反应速率,其数值可能
不相同。各物质表示的反应速率比等于该反应方程式中化学计量数
的比。
◆ 探究:影响化学反应速率的因素
催化剂是现代化学中关键而神奇的物质之一。剧统计,有80%以
上的化工生产过程使用了催化剂,目的是增大反应速率,提高生
产效率。在资源利用、能源开发、医药制造、环境保护等领域,
催化剂有着广泛的应用。
催化剂十分神奇,它能极大地提高化学反应速率,而自身的组成、化学性质和质量在 反应前后不发生变化;它和一些反应体系的关系就像钥匙与锁的关系,具有一定的选
择性。
催化剂神奇面纱至今尚未完全解开,对催化剂的研究是当代化学一个极具魅力和应用
前景的重要课题。
环节三:提出假设,实验验证
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
[问题]
我们已经知道催化剂可以影响化学反应速率,此外,还有哪些反应条件会影
响化学反应的速率
[假设]
反应温度、反应物浓度。
[用品]
5%H O 溶液、1 mol/LFeCl 溶液、0.1mol/L盐酸、1mol/L盐酸、大理石碎块、 冷 水 、热水、试管、试管夹、烧杯、量筒、胶头滴管。
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
√ 反应温度的影响
在两支大小相同的试管中均加入2mL5%H O 溶液,同时滴入2滴1mol/LFeCl ,
不同温度环境
实验现象
冷水
产生气泡速率较慢
热水
产生气泡速率较快
溶液。待试管中均有适量气泡出现时,将其中一支试管放入盛有冷水的烧杯中,另
一支试管放入盛有热水的烧杯中,观察现象并进行对比。
其他条件相同, 升高温度,加快反应速率。
步骤与试剂
比较各试管中的现象
试管1 5滴1 mol/L的HCl溶液; 各加入等量 大理石小碎 块
试管1气泡产生较快
试管2气泡产生较慢
试管2 5滴0.1mol/L的HCl溶液;
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
√ 反应物浓度的影响
其他条件相同,增大反应物浓度,加快反应速率。
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
√ 固体表面积的影响
取两支大小相同的试管,分别加入1g块状碳酸钙和1g粉末状碳酸钙,同时向两支试 管中滴加10mL 、1mol/L的盐酸,观察现象并进行对比
碳酸钙状态
实验现象
块状
产生气泡较慢
粉末状
产生气泡较快
其它条件不变时,
固体反应物表面积越大,化学反应速率增大
图6-16压强增大,气体浓度增大
其他条件相同,增大压强(减小容器容积),相当于增大反应物浓度,增大反应速率。
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
c(B) =
√ 压强的影响
n(B)
V
规律(在其它条件相同时)
反应物的化学性质越活泼,化学反应速率越快;反之则越慢
升高温度,化学反应速率加快;反之减慢
增大反应物的浓度,化学反应加快;反之减慢
使用催化剂,化学反应速率加快
增大反应物固体面积,化学反应加快;反之减慢
有气体参加的反应,增大压强,化学反应速率增大 ;反之减慢
影响化学反应 速率的因素
内 因 性 质
外 因 温 度
反应物的浓度
催化剂
反应物表面积
压强
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
变量控制探究影响化学反应速率因素的一般原则是“定多变一”,
即要保持其他变量不变,改变其中一个变量的值进行实验,测定数
据,通过系列实验,找出变量对反应速率的影响。其探究流程为
环节三:提出假设,实验验证
◆ 探究:影响化学反应速率的因素
自变量(如浓 度、温度等)
因变量(如反 应速率)
确定研不确定
究对象
(化学反应)
确定因变量 (反应速率) 的观测指标
改变单 一变量
◆方法导引
结论
下列调控反应速率的措施或实验中,分别利用或体现了哪 (1)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。 些影响反应速率的因素
固体反应物表面积
(2)把食物存放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。
温度
(3)做化学实验时,为加速反应的进行,通常将块状或颗粒 混匀,或者将固体试剂溶于水配成溶液后再进行实验。 状的固体药品研细并
固体反应物表面积
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。 反应物的浓度
环节三:提出假设,实验验证
探究:影响化学反应速率的因素
o(B)=Ac(B
表示化学反应进行的快慢
浓度、温度、压强、催化 剂、状态、表面积等
◆ 归纳整理
化学反 应速率
表达式
含义
影响因素
环节四:归纳整理,巩固提升
◆ 巩固提升
1.将4mol A气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:
2A(g)+B(g)=2C(g)。若经2s后测得C 的物质的量浓度为1.2mol-L-1,下列说法正确
的 是( C
A. 用物质A 表示的反应速率为1.2mol-L-1.s-1
B. 用物质B表示的反应速率为0.6mol·L-1.s-1
C.2s 时物质A的转化率为30%
D.2s时物质B的物质的量浓度为0.6mol-L-1
环节四:归纳整理,巩固提升
◆ 巩固提升
2、在恒温下,使反应C(s)+H O(g)====CO(g)+H (g)
在一容积可变的密闭容器中进行,改变下列条件,其反应速率如何变化
①若加压将容器的体积缩小一半 增大。
②若保持体积不变,充入N 使体系压强增大不 变。
③若保持压强不变,充入N 使容器体积变大减 小。
环节四:归纳整理,巩固提升
◆ 巩固提升
3、在2A+B=3C+4D 反应中,表示该反应速率最快的是( B ) A.v(A)=0.5mol·L-1.s-1
B.v(B)=0.3mol.L-1.s-1
C.v(C)=0.8mol-L-1.s-1
D.v(D)=1mol-L- .s-1
环节四:归纳整理,巩固提升
◆ 巩固提升
4、某小组设计如图实验,欲使甲中试管先出现浑浊,下列操作一定达不到目
的的是D )
A.向甲烧杯中加入适量CaO
B.向甲中试管内滴加适量浓硫酸
C.向乙烧杯中加入适量冰块
D. 增大甲装置所在环境的压强
5 mL 0.1 mol/L
Na S O 溶液
和5 mL0.5 mol/L
H SO 溶液
水(室温) .
乙
环节四:归纳整理,巩固提升
5 mL 0.1 mol/L Na S O 溶液
和5 mL0.5 mol/L
H SO 溶液
甲
可逆反应 教师点拨25min
1.概念:在相同条件下,既能向 正反应方向进行
同时又能向_ 的反应。
逆反应方向进行
2.特征:
双向 )—反应物延向反应生成物
两同 —相同条件下,正、逆反应同一条件下 同时进行
共存 一反应物、生成物同时存在
3.表示:化学方程式中用 表示。 一
可逆反应
4.很多化学反应都有一定的可逆性,不同反应的可逆性不同,有些化学反应在同
一条件下可逆程度很小,如2Na+2H O=2NaOH+H ^ ,视 为“不可逆”反应。
[自学检测对于可逆反应2SO +O 2SO , 长时间后,180原子()
A. 只存在于O 中
B. 只存在于O 和SO 中
在 混 充入一定量的18O , 足 够
D
[思考]对于可逆反应而言,反应物会转变成生成物, 而生成物又会分解成反应物,那岂不是无穷无尽也
正逆反应同时进行
反应物、生成物同时存在
C. 只存在于O 和SO 中
D. 存在于O 、SO 和SO 中
时间 (min) 0 10 20 30 40 50
60
c(SO ) 1.00 0.70 0.50 0.38 0.30 0.30
0.30
c(O ) 0.50 0.35 0.25 0.19 0.15 0.15
0.15
c(SO ) 0 0.30 0.50 0.62 0.70 0.70
0.70
(1)当反应刚开始时,反应物和生成物的浓度哪个大
(2)当反应刚开始时,正反应与逆反应哪个反应速率大
(3)随着反应的进行,反应物和生成物浓度如何变化
(4)随着反应的进行,v (正)与v (逆)怎样变化
v (正)↓ v (逆)个
化学平衡状态的建立
在某密闭容器中发生反应:2SO +O 化剂2SO
时间 (min) 0 10 20 30 40 50
60
c(SO ) 1.00 0.70 0.50 0.38 0.30 0.30
0.30
c(O ) 0.50 0.35 0.25 0.19 0.15 0.15
0.15
c(SO ) 0 0.30 0.50 0.62 0.70 0.70
0.70
c/mol-L-1
1.0
t/min
化学平衡状态的建立 催化剂
在某密闭容器中发生反应:2SO +O <△2SO
对于此浓度-时间图像,为何40 min后3种物 质的浓度保持不变 是反应停止了吗
浓度-时间图像
化学平衡状态的建立 -y: (mol/L·min)-
[思考] 从浓度对反应速率的 影响入手,分析正、逆反应 速率随时间是如何变化的 用速率时间象来表示此变 化过程弟 V表观
浓度- 时间图像 40 t/min
①开始阶段: 开始时c(SO )、c(O ) 大 ,c(SO )=0 只有正反应进行,v(逆)=0
②反应的发生阶段: 瞬间后c(N ) 、c(H ) 变小,c(NH )≠0 正逆反应都进行,v(逆)≠0,v (正)>v (逆)
一段时间后c(SO )、c(O )逐渐变小,c(SO )逐渐增大, 三种物质的浓度达到一个特定值 v (正)=v (逆)≠0
化学平衡状态
1.定义:
在一定条件下,可逆反应中,当正、逆两个方向的反应速率相等时,反应物的浓度 和生成物的浓度都不在改变。达到了一种表面静止的状态,我们称之为“化学平衡 状态”,即达到了化学反应的限度,化学反应的限度决定了反应物在该条件下转化 为生成物的最大转化率。
定 各组分的浓度保持不变
变 条件改变,原平衡被破坏,在新的条件下建立新的平衡
温度,浓度改变都能使平衡移动 、加催化剂不能
可逆反应
v (正)=v (逆)
动态平衡
化学平衡状态
2.特征:
判断可逆反应是否达到 平衡的直接标志。
熔勤平能
V正=V逆
逆 等 动
V正
V逆
反应速率
0 t
时间t
≠0
[例] 对于可逆反应N (g)+3H (g)=2NH (g),判 断 :
①一段时间v正(N ):v正(NH )=1:2 ,证明达平衡( )
②一段时间v正(N ):v逆(H )=1:3 ,证明达平衡 ()
③一段时间v正(H ):v逆(NH )=2:3, 证明达平衡( ) 3:2
(1)正、逆反应速率相等
①同种物质: V 正 =V 逆≠0
②不同种物质: V正(A) V逆(B)
步骤①判断有无正逆
②判断是否成比例
A 化学计量数
二
B化学计量数
化学平衡状态的判定
直接标志
[例] 对于可逆反应N (g)+3H (g)=2NH (g), 判 断 :
①单位时间内断裂1mol N=N的同时断裂3mol H-H,证明达平衡。()
②单位时间内断裂1molXN 的同时断裂2mol N-H,证明达平衡。()
化学平衡状态的判定
拓展:根据化学键的断键与成键
反应物断键、生成物成键:正向 生成物断键、反应物成键:逆向
步骤①判断有无正逆
②判断是否成比例
X
6mol
化学平衡状态的判定
直接标志
(2)各组分的浓度保持一定
①各组分的浓度不随时间的改变而改变;
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
X P为定值,任意时刻都保持不变
[例]在恒温恒容的密闭容器中发生反应:
2NO(g)+O (g)=2NO (g),当容器中压强不变时,说明反应已达到平衡状态()
入 P为变量
达到平衡状态。()
P为定值,任意时刻都保持不变
[例]在恒温恒容的容器中发生反应
A(s)+3B(g)=2C(g)+D(g)当容器的压强不发生改变时,化学反应达到平衡状态。()
间接标志—— “变量不变”
①体系中的总压强不变 有压强,关注气体系数 (适用于反应前后气体化学计量数和不等的反应)。
[例]在密闭容器中发生反应:X(g)+Y(g)=2Z(g)。恒温恒容时,容器内压强不变,表明该反应
化学平衡状态的判定
X
化学平衡状态的判定
间接标志—— “变量不变”
②体系中颜色不再改变
(适用于反应混合物中存在有颜色变化的物质)。
[例]对于反应:
2HI(g)=H (g)+1 (g),当反应体系颜色不再变化,说明反应已达到平衡状态()
化学平衡状态的判定
间接标志——“变量不变”
③平均相对分子质量不变
(适用于全是气体参加的反应前后化学计量数和不等的反应)。
[ 例 ]在恒容密闭容器中发生反应:
CO(g)+H O(g)=CO (g)+H (g),当容器中混合气体的平均相对分子质量恒定不变时,反 应达到平衡状态。()
X
[例]密闭容器中,发生反应:N (g)+3H (g)=2NH (g), 当容器中混合气体的平均相对分子 质量恒定不变时,反应达到平衡状态。()
化学平衡状态的判定
间接标志——“变量不变”
③平均相对分子质量不变
(适用于全是气体参加的反应前后化学计量数和不等的反应)。
[ 例 ]一定温度下,在恒容容器中投入又定量纯净的氨基甲酸铵,发生下列反应:
NH COONH (s)=2NH (g)+CO (g)气体的平均摩尔质量不变时,达到化学平衡状态()
X
平均摩尔质量=混合物中各组成部分的摩尔质量×该组成部分的物质的量分数( 若 是氢
体组成可以是体积分数)
[ 例 ]一定温度下,在恒容容器中发生下列反应:
NH COONH (s)=2NH (g)+CO (g),当氨气的体积分数保持不变时,则达到化学平衡状态 ()
X
[例]恒温恒容密闭容器中,发生反应:PCl (g)+Cl (g)=PCl (g)当混合气体的密度不再改变时, 可以表示反应达到平衡状态。()
X
[例]相同温度下,恒容密闭容器均进行反应:X(g)+Y(s)=Z(g)气体密度不再改变,说明达 到平衡状态。()
间 接 标 志——“变量不变”
④对绝热密闭容器,温度保持不变。
⑤对恒压容器全是气体参加,反应前后非等体积气体的反应,密度保持不变。
总之,选定反应中“变量”,即随反应进行而变化的量,当变量 不再变化时,反应已达平衡状态。
化学平衡状态的判定
有固体,密度紫脏行
[实战演练2min]可逆反应2NO (g)=2NO(g)+O (g) 在 体积固定的密闭容器中进行, 达到平衡状态的标志是 (填序号)。
①单位时间内生成n mol O 的同时生成2n mol NO
②单位时间两重成②0IO 的同时生成2n mol NO
③用NO 、NO、O 表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的压强不再改变的状态
混合气体的平均相对分子质量不再改变的状态
⑧v(NO )=2v(O ) 的状态
⑨v正(NO )=2v 逆(O )的状态
⑩h(O )不 再改变的状态
判一判● (正确的打“ √”,错误的打“×”)
(2)可逆反应达到平衡时,v 项 漂 组分浓度相等。
(3)可逆反应达到平时,反应停企各组分浓度不变。
(4)通过改变反应条件,可以使2 mol SO (g)和过量的O (g)反应得到2 mol SO 。
( )
平衡时,各组分浓度不再改变,并非相等
(1)2H +o 点燃2H 0与2H O电2H ↑+O 1互为可逆反应。()
( ) ( )
X
X
实战演练
可逆反应,2molSO 不能完全转化
动态平衡(依然进行)
1.在一密闭容器中,N +3H =2NH 反应达到平衡后,下
列说法中正确的是(c )
A.N 与H 不再化合,NH 不再分解合成氨反应属于 可逆反应
B. 单位时间内,消耗1 mol N 的同时消耗3 mol H
Q 容器内的总压强不随时间而变化
变量不变达平衡
b. N 、H 、NH 的物质的量浓度相等
实战演练
有压强,关注气体系数
中不能说明反应已达到平衡状态的是( D )
A. 容器内温度不变
B. 混合气体的密度不变 有固体,密度紫脏行
C. 混合气体的平均相对分子质量不变
单位时间内生成n mol D,同时消耗2n mol A
2.在一绝热(不与外界发生热交换)的恒容容器中,
发生放热反应2A(g)+B(s)=C(g)+D(g), 下列描述
实战演练
实战演练
3.CO和H 在一定条件下可以合成乙醇2CO(g)+
4H (g)=CH CH OH(g)+H O(g). 下列叙述中能说明
上述反应在一定条件下已达到平衡状态的是(B )
A.CO 全部转化为乙醇
反应体系中乙醇的物质的量浓度不再变化
C. 正反应和逆反应的化学反应速率均为零
D.CO 和H 以1:2的物质的量之比反应生成乙醇
学习目标
1.了解控制反应条件在生产、生活和科学 研究中的作用。
化学反应条件的控制 教 师 点 拨 2 5min
化工生产中化学反应条件的控制
1 . 目的:抑制有害的化学反应_ 和_促进有利的化学反应 2.方法: 改变化学反应的速度
改变条件
改变可逆反应进行的程度(限度)
3.实例:合成氨生产条件的选择
400~500℃: 温度较低时氨的产率较高,但温度低时 反应速率小,达到平衡需要的时间很长生产成本高。
10 MPa~30 MPa:压强越大,氨的产率越高,但对 动力和生产设备的要求越高。
实战演练
判一判o (正确的打“ √ ”,错误的打“×”)
(1)压强越大,合成氨的生产效率越高,所以应尽可能选
择高压条件。 强越大,对材料强度和设备制造的要 (× )
(2)化石燃料在燃烧过程中能产生污染环境的CO 、SO 等
大
压
有害气体。
(3)在工业生产实际中,反应速率越快越好。
用适当的反应条件获取适宜的反应速率
(√ ) (×)
下列措施可以提高燃料燃烧效率的是 C
①提高燃料的着火点②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化
⑤将煤气化处理 ⑥通入足量的空气
A.①③④⑤ B.②③⑤⑥
③④⑤⑥ D.①②③④
解析 燃料的着火点不可改变且与燃烧效率无关。
实战演练
实战演练
1.在一定条件下,对于密闭容器中进行的反应2SO (g) +O (g)=2SO (g), 下列说法中,能充分说明该反应 已经达到化学平衡状态的是( C )
A. 反应混合物中SO 、O 、SO 的物质的量之比为 2:1:2
B. 消耗SO 的速率与生成SO 的速率相等
反应混合物中SO 、O 、SO 的百分组成不再改
变
D. 生成O 的速率与生成SO 的速率相等
不成比例
实战演练
2.恒温恒容条件下.发生化学反应H (g)+I (g)=2HI(g),
下列选项中不能作为达到平衡状态的标志的是( B ) A. 混合气体颜色不再变化
单 位时间内形成n mol H—H的同时断裂2n mol H—I
C. 若该反应在隔热密闭体积恒定的容器中进行反应,体
系的温度不再变化
D.2v(H ) 正=v(HI)逆
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
