自然资源的开发利用 (教学课件)——高中化学人教版(2019)必修第二册(共29张PPT)
文档属性
| 名称 | 自然资源的开发利用 (教学课件)——高中化学人教版(2019)必修第二册(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 13:10:01 | ||
图片预览






文档简介
(共29张PPT)
第八章化学与可持续发展
第一节自然资源的开发利用
P98 资料卡片
自然资源是人类社会发展不可或缺的自然物质基础,包括土地 与土壤资源、矿产资源、生物资源、水资源、能源资源、环境 资源等。
透长石
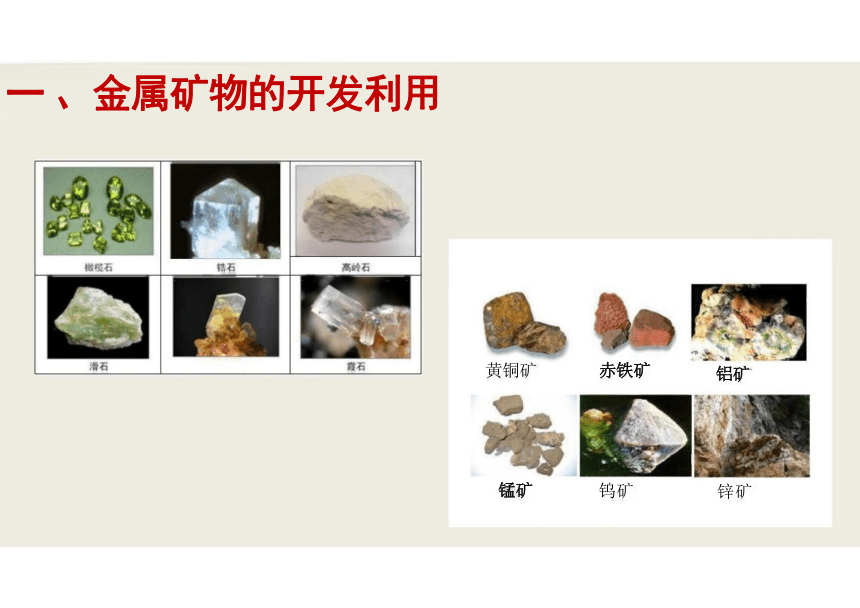
一 、金属矿物的开发利用
赤铁矿
钨矿
黄铜矿
锰矿
铝矿
锌矿
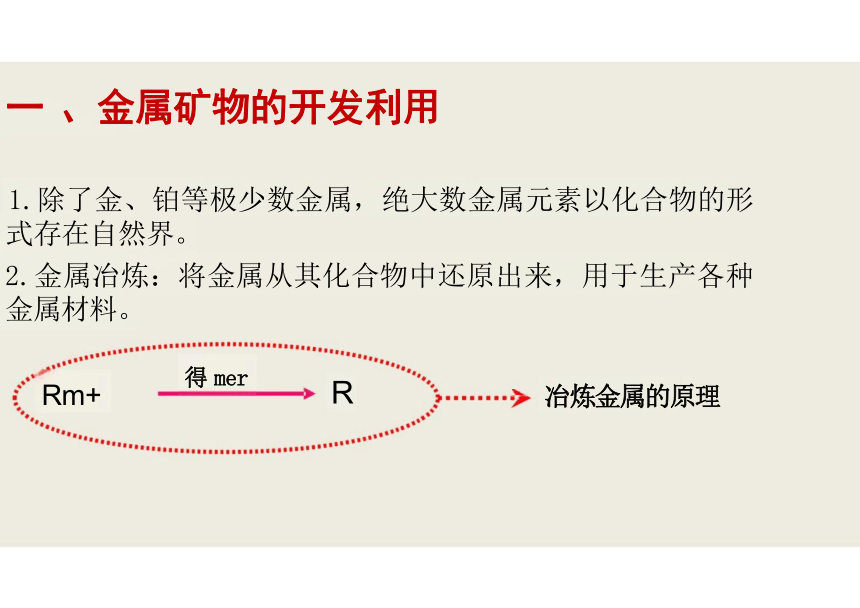
一 、金属矿物的开发利用
1.除了金、铂等极少数金属,绝大数金属元素以化合物的形 式存在自然界。
2.金属冶炼:将金属从其化合物中还原出来,用于生产各种 金属材料。
冶炼金属的原理
得 mer
Rm+
R
金属活动顺序表
单质还原性依次减弱
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg AgPtAu
总 结:从左往右,越来越容易冶炼金属,即越来越容易得到金属单质。
K+ Ca +Na+Mg +Al +Zn +Fe +Sn +Pb +(H+)Cu +Hg +Ag+Pt +
离子氧化性依次增强
热分解法:——适用于不活泼的金属冶炼
2HgO全2Hg+O 个 2Ag O全4Ag+O 个
在电流作用下,强迫金属阳离子得到电子而变成金属单质。
如:
电解
2NaCl (熔融)= 2Na+Cl 个
电解
MgCl (熔融)= Mg+Cl ↑
电解
2Al O (熔融)冰 石4Al+3O 个
助熔剂
晶
二
电 解 法 ——适用于钾、镁、钠、铝等非常活泼金属的冶炼
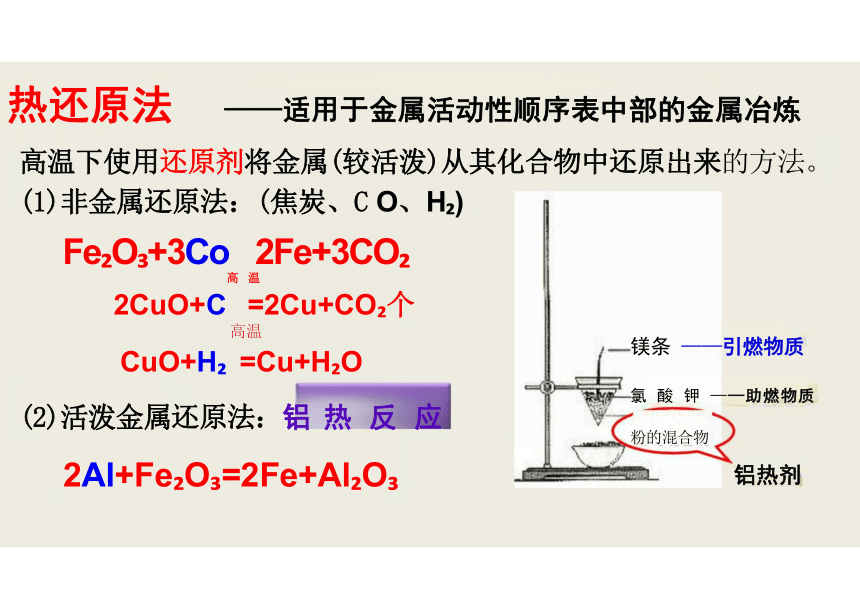
热还原法 ——适用于金属活动性顺序表中部的金属冶炼
高温下使用还原剂将金属(较活泼)从其化合物中还原出来的方法。
(1)非金属还原法:(焦炭、C O、H )
Fe O +3Co 2Fe+3CO
高 温
2CuO+C =2Cu+CO 个
高温
CuO+H =Cu+H O
(2)活泼金属还原法:铝 热 反 应
2Al+Fe O =2Fe+Al O
镁条 ——引燃物质
氯 酸 钾 ——助燃物质
氧化铁和铝
粉的混合物
铝热剂
坩埚 熔渣
铝热反应的原理可以应用在生产上,如
钢水
用于焊接钢轨等。在冶金工业上也常用
砂型 钢轨
这一反应原理,使铝与金属氧化物反应,
冶炼钒、铬、锰等
其它铝热反应:
铝热反应的应用
总结 不同金属冶炼方法的选择
金属活动性:
强 K Ca Na Mg AlZn Fe Sn Pb(H)Cu H g Ag弱 电解法 热还原法 热分解法
[练习]
在冶金工业上,均不能用化学还原剂制得的一组金属是
A、Na Mg Al B 、Na K Zn Fe
C、Zn Fe Cu Ag D、Mg Al Zn Fe
下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是
A、加 热Al O B、加热CaCO
C、电解熔融NaCl D、氯化钠与铝粉高温共热
生物资源可供人类利用的鱼虾贝藻为每年6亿吨,现在捕捞量为每年9000万吨
能 源 波浪能、潮汐能等
化学资源 镁、钾、铀、锶等矿物
锰结核……
71% 20
陆地
水 资 源 :1.3×1018吨
海洋资源
二 、海水资源的开发利用
1、海水水资源的利用
海水的淡化 蒸馏法、反渗透法、电渗析法等 直接利用海水进行循环冷却
蒸馏—— 利用液态混合物(互溶)中各组分沸点的不同,加热使其某
一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开
温度计
冷凝管
蒸馏烧瓶
牛角管
锥形瓶
NaCI、
MgCl 、CaCl 、Na SO
加入试剂 化学方程式
25
海水制盐 p7 粗盐
溶解
悬浊液(泥沙、NaCl、MgCl 、CaCl 、硫酸盐)
过滤
先BaCl , 后 Na CO 过滤后加适量稀HCI
杂质
Na SO
MgCl
CaCl
不溶性杂质
(泥沙)
Cl 和H O(g)
蒸馏塔 冷凝器
氧化和吸收环节主要反应的离子方程式
SO 和 H O
吸收塔
酸和Cl
氧化室
空气
吹出塔
海水提溴 p101
富集 (浓缩)
海水
Br
溶液
海水
( 含 有NaCl 和
MgSO 等 )
Mg(OH) 沉 淀
(2)加入试剂①后,能够分离得到Mg(OH) 沉淀的方法是过滤 电解
(3)试剂②可以选用_ 盐 酸 MgCl (熔融)二 Mg+Cl 个
(4)无 水MgCl,在熔融状态下,通电后会产生Mg 和Cl,, 该反应的化学方程式为
(1)为了使MgSO 转化为Mg(OH) , 试剂①可以选用 Ca(OH) ; 要 使MgSO 完全转化为沉淀, 加入试剂①的量应过 量
海水提镁 p106
6.镁及其合金是一种用途很广的金属材料。大量的镁是从海水中提取的,其中的主要步骤如下:
熔融
电解
无水 MgCl
MgCl 溶液
试剂①
试剂②
Mg
海带提碘 p106
5.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
海带 ①灼烧 海带灰 ②浸泡 海带灰悬浊液 ③ 含I 溶液
④H O 、稀硫酸
⑥ ⑤提取碘
单质I I 的CCl 溶液 含I 溶液
(1)实验步骤①会用到下列仪器中的_acd (填字母)。
a. 酒精灯 b.漏斗 c. 坩埚 d. 泥三角
(2)步骤③的操作名称是过滤 -0
(3)步骤④中反应的离子方程式为______ 取少量水溶液于试管中,滴加几滴
(4)请设计 一 种检验水溶液中是否含有碘单质白 淀 粉 溶 液 , 如 果 变 蓝 , 则 说 明 有I
(5)海带灰中含有的硫酸盐、碳酸盐等,在实验步骤 ⑤ (填序号)中实现与碘分离。
三 、煤、石油和天然气的综合利用
煤、石油和天然气仍是人类使用的主要能源,同时它们也是
重要的化工原料。 2019年全球一次能源消费份额(百分比)
不可再生能源
一次能源
污染大,利用率低
石油33%
煤炭 27%
天然气24%
直接做燃料
变成化工原料
合成材料
煤 、 石 油 、 天 然 气
①煤的干馏 煤的综合利用 ②煤的气化
③煤的液化
C 元素—大量
H 、N 、S 、O等元素—少量
1.煤
煤的组成
有机物
无机物
·将煤转化为可燃性气体的过程
C+H CO+H2
水煤气
温
·煤干馏的产物有哪些
煤的气化 化学变化
·将煤隔绝空气加强热使其分解的过程,也叫煤的焦化
煤气、煤焦油、焦炭
化学变化
煤的干馏
直接(煤+H → 液体燃烧)
间接(先转化为CO和H , 后转为CH OH)
煤的液化
化学变化
2.天然气:
清洁的化石能源
合成氨跟生产甲醇
分馏:利用原油中各组分沸点的不同进行分离的过程。(物理变化)
裂化:使烃类分子分裂为几个较小分子的反应过程。(化学变化)
C H 4 C H +C H 6 C H 8加 、 压C H o+C H
裂 解: 在高温下分子链断裂成极小分子的过程。( 化学变化)
C H 0 加热、加压 CH +C H C Hok剂C H +C H
化
加
剂
热
催
多种碳氢化合物组成的混合物,成分复杂,
需要先在炼油厂进行精炼。
3.石油:
催化剂
石油的分馏
汽 油 发 动 机 的 燃 料
飞机燃料
煤 油 炉 的 燃 料
柴 油 发 动 机
的 燃 料
蒸 馏
各 种 化 工 原 料
Cs-Cn
汽 油
Ci-C
煤 油
C15
柴 油
柴
油
压
料 油
上 升 的 石 油 燕 气
加 热 炉
汽 油
煤 油
柴 油
润滑油
Ca以下
石 油 气
重 油 C2o 以 上
沥 青 减
船或火力发电
的 燃 料
催 化 裂 化
常 压 蒸 馏
凝结的汽油
液 化 石 油 气
机 油
铺 路
P105 练习与应用
1.下列过程属于物理变化的是( )。
A. 煤的干馏 B. 石油分馏 C. 石油裂化 D. 乙烯聚合
2.完成下列反应的化学方程式,并指明其中的氧化剂和还原剂。
SnO +C——Sn+CO
WO +H ——W+H O
PbS+O ——PbO+SO
UF +Mg——U+MgF
3.蓝铜矿的主要成分为2CuCO ·Cu(OH) , 将它与焦炭一起加热时,可以生成Cu 、CO 和H O。请 写
出该反应的化学方程式,并注明反应类型。
4.某种磁铁矿样品含Fe O 76.0%,SiO 11.0%, 其他不含铁的杂质13.0%,请计算这种矿样中铁的
质量分数。
第八章化学与可持续发展
第一节自然资源的开发利用
P98 资料卡片
自然资源是人类社会发展不可或缺的自然物质基础,包括土地 与土壤资源、矿产资源、生物资源、水资源、能源资源、环境 资源等。
透长石
一 、金属矿物的开发利用
赤铁矿
钨矿
黄铜矿
锰矿
铝矿
锌矿
一 、金属矿物的开发利用
1.除了金、铂等极少数金属,绝大数金属元素以化合物的形 式存在自然界。
2.金属冶炼:将金属从其化合物中还原出来,用于生产各种 金属材料。
冶炼金属的原理
得 mer
Rm+
R
金属活动顺序表
单质还原性依次减弱
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg AgPtAu
总 结:从左往右,越来越容易冶炼金属,即越来越容易得到金属单质。
K+ Ca +Na+Mg +Al +Zn +Fe +Sn +Pb +(H+)Cu +Hg +Ag+Pt +
离子氧化性依次增强
热分解法:——适用于不活泼的金属冶炼
2HgO全2Hg+O 个 2Ag O全4Ag+O 个
在电流作用下,强迫金属阳离子得到电子而变成金属单质。
如:
电解
2NaCl (熔融)= 2Na+Cl 个
电解
MgCl (熔融)= Mg+Cl ↑
电解
2Al O (熔融)冰 石4Al+3O 个
助熔剂
晶
二
电 解 法 ——适用于钾、镁、钠、铝等非常活泼金属的冶炼
热还原法 ——适用于金属活动性顺序表中部的金属冶炼
高温下使用还原剂将金属(较活泼)从其化合物中还原出来的方法。
(1)非金属还原法:(焦炭、C O、H )
Fe O +3Co 2Fe+3CO
高 温
2CuO+C =2Cu+CO 个
高温
CuO+H =Cu+H O
(2)活泼金属还原法:铝 热 反 应
2Al+Fe O =2Fe+Al O
镁条 ——引燃物质
氯 酸 钾 ——助燃物质
氧化铁和铝
粉的混合物
铝热剂
坩埚 熔渣
铝热反应的原理可以应用在生产上,如
钢水
用于焊接钢轨等。在冶金工业上也常用
砂型 钢轨
这一反应原理,使铝与金属氧化物反应,
冶炼钒、铬、锰等
其它铝热反应:
铝热反应的应用
总结 不同金属冶炼方法的选择
金属活动性:
强 K Ca Na Mg AlZn Fe Sn Pb(H)Cu H g Ag弱 电解法 热还原法 热分解法
[练习]
在冶金工业上,均不能用化学还原剂制得的一组金属是
A、Na Mg Al B 、Na K Zn Fe
C、Zn Fe Cu Ag D、Mg Al Zn Fe
下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是
A、加 热Al O B、加热CaCO
C、电解熔融NaCl D、氯化钠与铝粉高温共热
生物资源可供人类利用的鱼虾贝藻为每年6亿吨,现在捕捞量为每年9000万吨
能 源 波浪能、潮汐能等
化学资源 镁、钾、铀、锶等矿物
锰结核……
71% 20
陆地
水 资 源 :1.3×1018吨
海洋资源
二 、海水资源的开发利用
1、海水水资源的利用
海水的淡化 蒸馏法、反渗透法、电渗析法等 直接利用海水进行循环冷却
蒸馏—— 利用液态混合物(互溶)中各组分沸点的不同,加热使其某
一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开
温度计
冷凝管
蒸馏烧瓶
牛角管
锥形瓶
NaCI、
MgCl 、CaCl 、Na SO
加入试剂 化学方程式
25
海水制盐 p7 粗盐
溶解
悬浊液(泥沙、NaCl、MgCl 、CaCl 、硫酸盐)
过滤
先BaCl , 后 Na CO 过滤后加适量稀HCI
杂质
Na SO
MgCl
CaCl
不溶性杂质
(泥沙)
Cl 和H O(g)
蒸馏塔 冷凝器
氧化和吸收环节主要反应的离子方程式
SO 和 H O
吸收塔
酸和Cl
氧化室
空气
吹出塔
海水提溴 p101
富集 (浓缩)
海水
Br
溶液
海水
( 含 有NaCl 和
MgSO 等 )
Mg(OH) 沉 淀
(2)加入试剂①后,能够分离得到Mg(OH) 沉淀的方法是过滤 电解
(3)试剂②可以选用_ 盐 酸 MgCl (熔融)二 Mg+Cl 个
(4)无 水MgCl,在熔融状态下,通电后会产生Mg 和Cl,, 该反应的化学方程式为
(1)为了使MgSO 转化为Mg(OH) , 试剂①可以选用 Ca(OH) ; 要 使MgSO 完全转化为沉淀, 加入试剂①的量应过 量
海水提镁 p106
6.镁及其合金是一种用途很广的金属材料。大量的镁是从海水中提取的,其中的主要步骤如下:
熔融
电解
无水 MgCl
MgCl 溶液
试剂①
试剂②
Mg
海带提碘 p106
5.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
海带 ①灼烧 海带灰 ②浸泡 海带灰悬浊液 ③ 含I 溶液
④H O 、稀硫酸
⑥ ⑤提取碘
单质I I 的CCl 溶液 含I 溶液
(1)实验步骤①会用到下列仪器中的_acd (填字母)。
a. 酒精灯 b.漏斗 c. 坩埚 d. 泥三角
(2)步骤③的操作名称是过滤 -0
(3)步骤④中反应的离子方程式为______ 取少量水溶液于试管中,滴加几滴
(4)请设计 一 种检验水溶液中是否含有碘单质白 淀 粉 溶 液 , 如 果 变 蓝 , 则 说 明 有I
(5)海带灰中含有的硫酸盐、碳酸盐等,在实验步骤 ⑤ (填序号)中实现与碘分离。
三 、煤、石油和天然气的综合利用
煤、石油和天然气仍是人类使用的主要能源,同时它们也是
重要的化工原料。 2019年全球一次能源消费份额(百分比)
不可再生能源
一次能源
污染大,利用率低
石油33%
煤炭 27%
天然气24%
直接做燃料
变成化工原料
合成材料
煤 、 石 油 、 天 然 气
①煤的干馏 煤的综合利用 ②煤的气化
③煤的液化
C 元素—大量
H 、N 、S 、O等元素—少量
1.煤
煤的组成
有机物
无机物
·将煤转化为可燃性气体的过程
C+H CO+H2
水煤气
温
·煤干馏的产物有哪些
煤的气化 化学变化
·将煤隔绝空气加强热使其分解的过程,也叫煤的焦化
煤气、煤焦油、焦炭
化学变化
煤的干馏
直接(煤+H → 液体燃烧)
间接(先转化为CO和H , 后转为CH OH)
煤的液化
化学变化
2.天然气:
清洁的化石能源
合成氨跟生产甲醇
分馏:利用原油中各组分沸点的不同进行分离的过程。(物理变化)
裂化:使烃类分子分裂为几个较小分子的反应过程。(化学变化)
C H 4 C H +C H 6 C H 8加 、 压C H o+C H
裂 解: 在高温下分子链断裂成极小分子的过程。( 化学变化)
C H 0 加热、加压 CH +C H C Hok剂C H +C H
化
加
剂
热
催
多种碳氢化合物组成的混合物,成分复杂,
需要先在炼油厂进行精炼。
3.石油:
催化剂
石油的分馏
汽 油 发 动 机 的 燃 料
飞机燃料
煤 油 炉 的 燃 料
柴 油 发 动 机
的 燃 料
蒸 馏
各 种 化 工 原 料
Cs-Cn
汽 油
Ci-C
煤 油
C15
柴 油
柴
油
压
料 油
上 升 的 石 油 燕 气
加 热 炉
汽 油
煤 油
柴 油
润滑油
Ca以下
石 油 气
重 油 C2o 以 上
沥 青 减
船或火力发电
的 燃 料
催 化 裂 化
常 压 蒸 馏
凝结的汽油
液 化 石 油 气
机 油
铺 路
P105 练习与应用
1.下列过程属于物理变化的是( )。
A. 煤的干馏 B. 石油分馏 C. 石油裂化 D. 乙烯聚合
2.完成下列反应的化学方程式,并指明其中的氧化剂和还原剂。
SnO +C——Sn+CO
WO +H ——W+H O
PbS+O ——PbO+SO
UF +Mg——U+MgF
3.蓝铜矿的主要成分为2CuCO ·Cu(OH) , 将它与焦炭一起加热时,可以生成Cu 、CO 和H O。请 写
出该反应的化学方程式,并注明反应类型。
4.某种磁铁矿样品含Fe O 76.0%,SiO 11.0%, 其他不含铁的杂质13.0%,请计算这种矿样中铁的
质量分数。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
