5.1.3粗盐的提纯 (教学课件)- 高中化学人教版(2019)必修第二册(共22张PPT)
文档属性
| 名称 | 5.1.3粗盐的提纯 (教学课件)- 高中化学人教版(2019)必修第二册(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 13:12:04 | ||
图片预览







文档简介
(共22张PPT)
1.书写二氧化硫与氧化钙、氢氧化钙反应的方程式
2.书写二氧化硫与氧气、高锰酸根、氯气、溴单质、铁离子、 过氧化氢反应的方程式
第五章化工生产中的重要非金属元素
第一节硫及其化合物
第3课时粗盐的提纯
1.能辨别有色溶液褪色的原理。 2.知道三氧化硫性质。
3.通过粗盐的提纯熟知除杂的原则。
二氧化硫的漂白性
原理:二氧化硫与某些有色物质化合生成不稳定的无色物质 实 质:化合漂白
特点:暂时性,加热可恢复原来的颜色。
漂 白 范 围:漂 白某些有色物质(如品红溶液、纸浆、毛、丝、棉、麻、草帽) 不能使酸碱指示剂褪色
用pH 试纸检测SO 水溶液酸碱性时,试纸变红而并不褪色
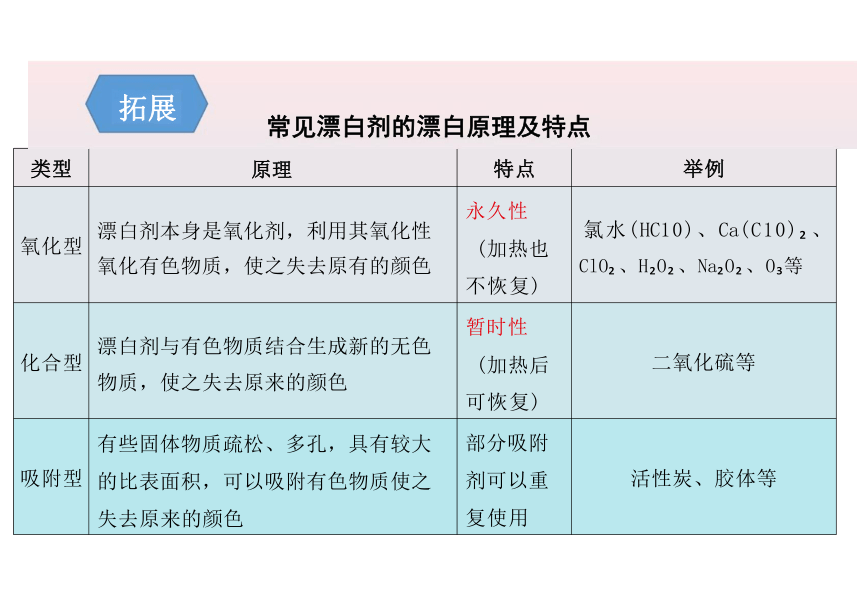
类型 原理 特点
举例
氧化型 漂白剂本身是氧化剂,利用其氧化性 氧化有色物质,使之失去原有的颜色 永久性 (加热也 不恢复)
氯水(HC10)、Ca(C10) 、 ClO 、H O 、Na O 、O 等
化合型 漂白剂与有色物质结合生成新的无色 物质,使之失去原来的颜色 暂时性 (加热后 可恢复)
二氧化硫等
吸附型 有些固体物质疏松、多孔,具有较大 的比表面积,可以吸附有色物质使之 失去原来的颜色 部分吸附 剂可以重 复使用
活性炭、胶体等
常见漂白剂的漂白原理及特点
拓展
课堂练习
1、若将等物质的量的SO 和Cl 这两种气体混合后,同 时作用于潮湿的红色布条,可观察到红布条( D )
A、慢慢褪色
B、立即褪色
C、先褪色后恢复原来颜色 D、不褪色
SO +Cl +2H O=2HCl+H SO
2.下列变化可以说明SO 具有漂白性的是( C )
A.SO 通入溴水中,溴水褪色
B.SO 通入酸性高锰酸钾溶液中,溶液的紫红色褪去
C.SO 通入品红溶液中,溶液的红色褪去
D.SO 通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
[思考】
二氧化硫能使品红、紫红色的酸KMnO 溶液、滴有酚酞的 氢氧化钠溶液褪色,请问三者褪色的原因有何不同
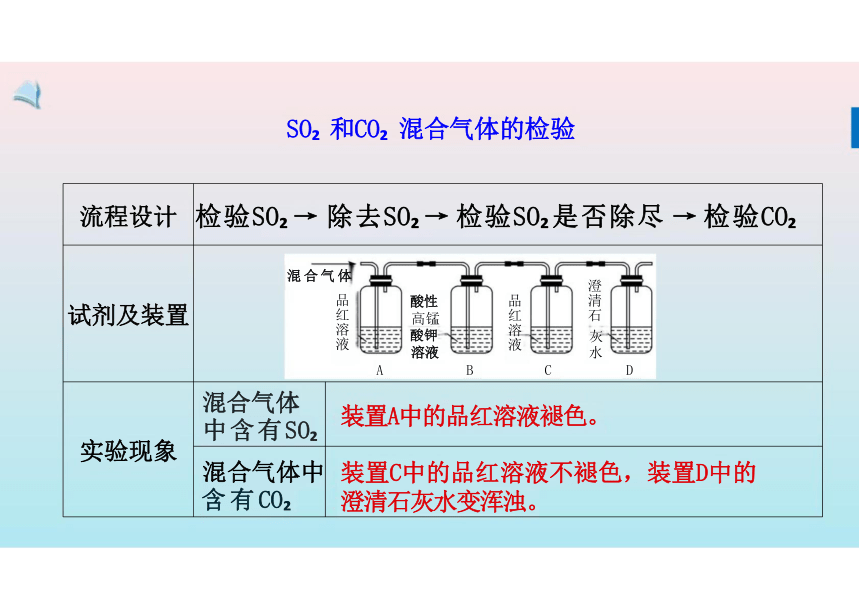
流程设计 检验SO → 除去SO → 检验SO 是否除尽 → 检验CO 试剂及装置 混合气体 酸性 高锰 酸钾 灰 溶液 水 A B C D 实验现象 混合气体 中含有SO
装置A中的品红溶液褪色。
混合气体中 含有CO
装置C中的品红溶液不褪色,装置D中的
澄清石灰水变浑浊。
SO 和CO 混合气体的检验
品红溶液
品红溶液
澄清石
SO +H O= H SO SO + CaO=CaSO
SO +Ca( OH) =CaSO +H O
SO + BaCl +H O =BaSO ↓+2 HCI
(2)可以漂白纸浆、毛、丝、草编制品等。
(3)杀菌消毒。
(4)食品添加剂
催化剂
(1)制造硫酸 2SO +O = 入 2SO
SO : 熔点(16.8℃)和沸点(44.8℃),常温下为无色液体,标况下为无色固体。
3.二氧化硫的用途
食品中的二氧化硫
食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用。 例如,在葡萄酒酿制过程中,葡萄汁中某些细菌的繁殖会影响发酵, 添加适量的二氧化硫可以起到杀菌的作用。二氧化硫又是一种抗氧 化剂,能防止葡萄酒中的一些成分被氧化,起到保质作用,并有助 于保持葡萄酒的天然果香味。尽管二氧化硫在蜜饯、干果、食糖、
果酒等食品的加工中起着重要作用,但如果使用不当就有可能造成 食品中二氧化硫的残留量超标,从而对人体健康造成不利影响。
源白防腐后
鲜藤菇漂白情况普遍
变质美凛白后卖相大增
变质银耳
漂白后
请回答下列问题: A B C
(1)装置A中的化学方程式为 Na SO +H SO (浓)==Na SO +SO ^+H O。
(2)实验过程中,装置B中产生的现象为 溶液由紫红色变为无色,这说明 SO 具 有 还原性 。
(3)装置C的目的是探究SO 与品红溶液作用的可逆性,请写出实验操作及现 象:品红溶液褪色后,关闭分液漏斗旋塞,点燃酒精灯加热溶液 __。
(4)尾气可采用_ NaOH 溶液吸收。
3.某化学兴趣小组为探究SO 的性质,
按如图所示装置进行实验。
→尾气处理
品红溶液
水
KMnO
酸性溶液
亚硫 酸钠
浓硫酸
课堂小结
氯化钠在自然界申的分布广泛
盐湖 盐井 盐矿
海水
课堂小结
●难溶性杂质:含泥沙等
●可溶性杂质:MgCl 、CaCl 、Na SO 等
精盐
粗盐
课堂小结
除去物质中混有的杂质(除杂)
●原则:不增、不减、操作简便。
不增 不减 操作简便
●方法:
向粗盐中加入化学试剂,利用化学方法将这些可溶性杂质转化为 气体、沉淀或水进而除去
分离杂质与被 提纯的物质的 实验操作要简 单。
不能增加新的
杂质。
不减少被提纯
的物质。
杂质 加入的试剂
离子方程式
硫酸盐 BaCl
Ba ++SO2-=BaSO J
CaCl Na CO
Ca ++CO3-=CaCO I
MgCl NaOH
Mg ++2OH-=Mg(OH)
课 与讨论 粗盐的提纯
(1)经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性硫酸盐及 MgCl 、CaCl 等杂质。如果按照下表所示顺序除去它们,应加入什么试 剂 写出相关反应的离子方程式。
剩余NaOH—
CO。
过滤后 气体
Mg(OH) 沉淀 加盐酸
剩余 →NaC1
除去这些离子
Mg N过量H
Ca +—
so- 过量
Na CO
>CaCO 沉淀、BaCO 沉淀
加入除杂试剂的顺序可以是:
1.BaCl →NaOH→Na CO →HCl
2.BaCl →Na CO →NaOH →HCI
3.NaOH→BaCl →Na CO →HCl
过量
剩余 Na CO
BaCl
BaSO 沉淀
(2)加入你选择的试剂除去杂质后,有没有引入其他离子 用什么方法
Na CO 必须加在BaCl 之后
盐酸必须在过滤操作以后再加
课堂练习
依据粗盐提纯的原理,除去氯化钾溶液中少量的氯化镁、硫酸镁等杂质,可选用氢 氧化钡溶液、稀盐酸和碳酸钾溶液三种试剂,按如图步骤操作:
(1)B的化学式是K CO , c 的化学式是_HCI。
(2)加入过量A的目的是除尽镁离子和硫酸根离子。
(3)加入过量B的目的是 除尽过量的钡离子。
(4)加热煮沸的目的是使氯化氢挥发逸出。
(5)操作I 的名称是过滤。
溶解
沉淀
过滤
蒸发
结晶
原则:不增、不减、操作简便
方法:向粗盐中加入化学试剂,利 用化学方法将这些可溶性杂质转化 为气体、沉淀或水进而除去
除杂试剂选择以及添加的顺序
粗盐中的
不溶性杂
质的除去
方法
除去物
质中混
有的杂
质
第一节
硫及其化合物
第3课时
课堂小结
在三支试管中分别加入少量稀
硫酸、Na SO 溶液和Na CO 溶液, 然后各滴入几滴BaCl 溶液,观察现 象。再分别加入少量稀盐酸,振荡, 观察现象。从这个实验中你能够得 出什么结论 写出相关反应的离子
方程式。
实验5-4
04
实验 操作 先滴入几滴 BaC l 溶液 再加入少量 盐酸 稀硫酸 先滴入几滴 BaC l 溶液 再加入少量 盐酸 Na SO 溶液 先滴入几滴 BaC l 溶液 再加入少量 盐酸 Na CO 溶液
实验 现象 先生成白色沉淀, 加入盐酸后 沉淀不溶解 先生成白色沉淀 加入盐酸后 _沉淀不溶解 先生成白色沉淀_, 加入盐酸后 沉淀溶解
实验 结论 与Ba +反应生成不溶于盐酸的BaSO 4 离子方程式:SO,2+Ba +===BaSO CO 2-与Ba +反应生 成白色沉淀BaCO , 可溶于盐酸
04
方法操作
取少量待测液于试管中,加入少量稀盐酸酸化,在加入氯化钡
溶液若有白色沉淀生成,则含有SO
【注意】先加稀盐酸的目的是排除CO -、SO 、Ag 干扰,再加 BaCl 溶液
【思考 】可用稀硫酸或稀硝酸酸化吗
不可以,无法确认是后续引入或转化的SO 2-, 还是原溶液含有的。
04
价态
只有氧化性 +6 H SO SO
Na SO
既有氧化性 H SO SO
Na SO
又有还原性
H
S
只有还原性 -2 H S
Na S
04
不同价态含硫物质的转化
酸 单质或氧化物 盐物质类别
1.书写二氧化硫与氧化钙、氢氧化钙反应的方程式
2.书写二氧化硫与氧气、高锰酸根、氯气、溴单质、铁离子、 过氧化氢反应的方程式
第五章化工生产中的重要非金属元素
第一节硫及其化合物
第3课时粗盐的提纯
1.能辨别有色溶液褪色的原理。 2.知道三氧化硫性质。
3.通过粗盐的提纯熟知除杂的原则。
二氧化硫的漂白性
原理:二氧化硫与某些有色物质化合生成不稳定的无色物质 实 质:化合漂白
特点:暂时性,加热可恢复原来的颜色。
漂 白 范 围:漂 白某些有色物质(如品红溶液、纸浆、毛、丝、棉、麻、草帽) 不能使酸碱指示剂褪色
用pH 试纸检测SO 水溶液酸碱性时,试纸变红而并不褪色
类型 原理 特点
举例
氧化型 漂白剂本身是氧化剂,利用其氧化性 氧化有色物质,使之失去原有的颜色 永久性 (加热也 不恢复)
氯水(HC10)、Ca(C10) 、 ClO 、H O 、Na O 、O 等
化合型 漂白剂与有色物质结合生成新的无色 物质,使之失去原来的颜色 暂时性 (加热后 可恢复)
二氧化硫等
吸附型 有些固体物质疏松、多孔,具有较大 的比表面积,可以吸附有色物质使之 失去原来的颜色 部分吸附 剂可以重 复使用
活性炭、胶体等
常见漂白剂的漂白原理及特点
拓展
课堂练习
1、若将等物质的量的SO 和Cl 这两种气体混合后,同 时作用于潮湿的红色布条,可观察到红布条( D )
A、慢慢褪色
B、立即褪色
C、先褪色后恢复原来颜色 D、不褪色
SO +Cl +2H O=2HCl+H SO
2.下列变化可以说明SO 具有漂白性的是( C )
A.SO 通入溴水中,溴水褪色
B.SO 通入酸性高锰酸钾溶液中,溶液的紫红色褪去
C.SO 通入品红溶液中,溶液的红色褪去
D.SO 通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
[思考】
二氧化硫能使品红、紫红色的酸KMnO 溶液、滴有酚酞的 氢氧化钠溶液褪色,请问三者褪色的原因有何不同
流程设计 检验SO → 除去SO → 检验SO 是否除尽 → 检验CO 试剂及装置 混合气体 酸性 高锰 酸钾 灰 溶液 水 A B C D 实验现象 混合气体 中含有SO
装置A中的品红溶液褪色。
混合气体中 含有CO
装置C中的品红溶液不褪色,装置D中的
澄清石灰水变浑浊。
SO 和CO 混合气体的检验
品红溶液
品红溶液
澄清石
SO +H O= H SO SO + CaO=CaSO
SO +Ca( OH) =CaSO +H O
SO + BaCl +H O =BaSO ↓+2 HCI
(2)可以漂白纸浆、毛、丝、草编制品等。
(3)杀菌消毒。
(4)食品添加剂
催化剂
(1)制造硫酸 2SO +O = 入 2SO
SO : 熔点(16.8℃)和沸点(44.8℃),常温下为无色液体,标况下为无色固体。
3.二氧化硫的用途
食品中的二氧化硫
食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用。 例如,在葡萄酒酿制过程中,葡萄汁中某些细菌的繁殖会影响发酵, 添加适量的二氧化硫可以起到杀菌的作用。二氧化硫又是一种抗氧 化剂,能防止葡萄酒中的一些成分被氧化,起到保质作用,并有助 于保持葡萄酒的天然果香味。尽管二氧化硫在蜜饯、干果、食糖、
果酒等食品的加工中起着重要作用,但如果使用不当就有可能造成 食品中二氧化硫的残留量超标,从而对人体健康造成不利影响。
源白防腐后
鲜藤菇漂白情况普遍
变质美凛白后卖相大增
变质银耳
漂白后
请回答下列问题: A B C
(1)装置A中的化学方程式为 Na SO +H SO (浓)==Na SO +SO ^+H O。
(2)实验过程中,装置B中产生的现象为 溶液由紫红色变为无色,这说明 SO 具 有 还原性 。
(3)装置C的目的是探究SO 与品红溶液作用的可逆性,请写出实验操作及现 象:品红溶液褪色后,关闭分液漏斗旋塞,点燃酒精灯加热溶液 __。
(4)尾气可采用_ NaOH 溶液吸收。
3.某化学兴趣小组为探究SO 的性质,
按如图所示装置进行实验。
→尾气处理
品红溶液
水
KMnO
酸性溶液
亚硫 酸钠
浓硫酸
课堂小结
氯化钠在自然界申的分布广泛
盐湖 盐井 盐矿
海水
课堂小结
●难溶性杂质:含泥沙等
●可溶性杂质:MgCl 、CaCl 、Na SO 等
精盐
粗盐
课堂小结
除去物质中混有的杂质(除杂)
●原则:不增、不减、操作简便。
不增 不减 操作简便
●方法:
向粗盐中加入化学试剂,利用化学方法将这些可溶性杂质转化为 气体、沉淀或水进而除去
分离杂质与被 提纯的物质的 实验操作要简 单。
不能增加新的
杂质。
不减少被提纯
的物质。
杂质 加入的试剂
离子方程式
硫酸盐 BaCl
Ba ++SO2-=BaSO J
CaCl Na CO
Ca ++CO3-=CaCO I
MgCl NaOH
Mg ++2OH-=Mg(OH)
课 与讨论 粗盐的提纯
(1)经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性硫酸盐及 MgCl 、CaCl 等杂质。如果按照下表所示顺序除去它们,应加入什么试 剂 写出相关反应的离子方程式。
剩余NaOH—
CO。
过滤后 气体
Mg(OH) 沉淀 加盐酸
剩余 →NaC1
除去这些离子
Mg N过量H
Ca +—
so- 过量
Na CO
>CaCO 沉淀、BaCO 沉淀
加入除杂试剂的顺序可以是:
1.BaCl →NaOH→Na CO →HCl
2.BaCl →Na CO →NaOH →HCI
3.NaOH→BaCl →Na CO →HCl
过量
剩余 Na CO
BaCl
BaSO 沉淀
(2)加入你选择的试剂除去杂质后,有没有引入其他离子 用什么方法
Na CO 必须加在BaCl 之后
盐酸必须在过滤操作以后再加
课堂练习
依据粗盐提纯的原理,除去氯化钾溶液中少量的氯化镁、硫酸镁等杂质,可选用氢 氧化钡溶液、稀盐酸和碳酸钾溶液三种试剂,按如图步骤操作:
(1)B的化学式是K CO , c 的化学式是_HCI。
(2)加入过量A的目的是除尽镁离子和硫酸根离子。
(3)加入过量B的目的是 除尽过量的钡离子。
(4)加热煮沸的目的是使氯化氢挥发逸出。
(5)操作I 的名称是过滤。
溶解
沉淀
过滤
蒸发
结晶
原则:不增、不减、操作简便
方法:向粗盐中加入化学试剂,利 用化学方法将这些可溶性杂质转化 为气体、沉淀或水进而除去
除杂试剂选择以及添加的顺序
粗盐中的
不溶性杂
质的除去
方法
除去物
质中混
有的杂
质
第一节
硫及其化合物
第3课时
课堂小结
在三支试管中分别加入少量稀
硫酸、Na SO 溶液和Na CO 溶液, 然后各滴入几滴BaCl 溶液,观察现 象。再分别加入少量稀盐酸,振荡, 观察现象。从这个实验中你能够得 出什么结论 写出相关反应的离子
方程式。
实验5-4
04
实验 操作 先滴入几滴 BaC l 溶液 再加入少量 盐酸 稀硫酸 先滴入几滴 BaC l 溶液 再加入少量 盐酸 Na SO 溶液 先滴入几滴 BaC l 溶液 再加入少量 盐酸 Na CO 溶液
实验 现象 先生成白色沉淀, 加入盐酸后 沉淀不溶解 先生成白色沉淀 加入盐酸后 _沉淀不溶解 先生成白色沉淀_, 加入盐酸后 沉淀溶解
实验 结论 与Ba +反应生成不溶于盐酸的BaSO 4 离子方程式:SO,2+Ba +===BaSO CO 2-与Ba +反应生 成白色沉淀BaCO , 可溶于盐酸
04
方法操作
取少量待测液于试管中,加入少量稀盐酸酸化,在加入氯化钡
溶液若有白色沉淀生成,则含有SO
【注意】先加稀盐酸的目的是排除CO -、SO 、Ag 干扰,再加 BaCl 溶液
【思考 】可用稀硫酸或稀硝酸酸化吗
不可以,无法确认是后续引入或转化的SO 2-, 还是原溶液含有的。
04
价态
只有氧化性 +6 H SO SO
Na SO
既有氧化性 H SO SO
Na SO
又有还原性
H
S
只有还原性 -2 H S
Na S
04
不同价态含硫物质的转化
酸 单质或氧化物 盐物质类别
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
