5.2.2氨和铵盐 (课件) -高中化学人教版(2019)必修第二册(共24张PPT)
文档属性
| 名称 | 5.2.2氨和铵盐 (课件) -高中化学人教版(2019)必修第二册(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 00:00:00 | ||
图片预览





文档简介
(共24张PPT)
第五章化工生产中的重要非金属元素
第二节氮及其化合物
第2课时氨和铵盐
1.能从物质类别、氮元素价态的角度,认识氨、铵盐的性质与转化。
2.设计实验,如氨的性质实验、制备实验,铵盐的性质实验及铵离子 的检验等,实现氨的转化与生成。
核心素养发展目标
液氨
氨容易液化,汽化时
要吸收大量的热,使周围 温度急剧降低。因此,液 氨可用作制冷剂
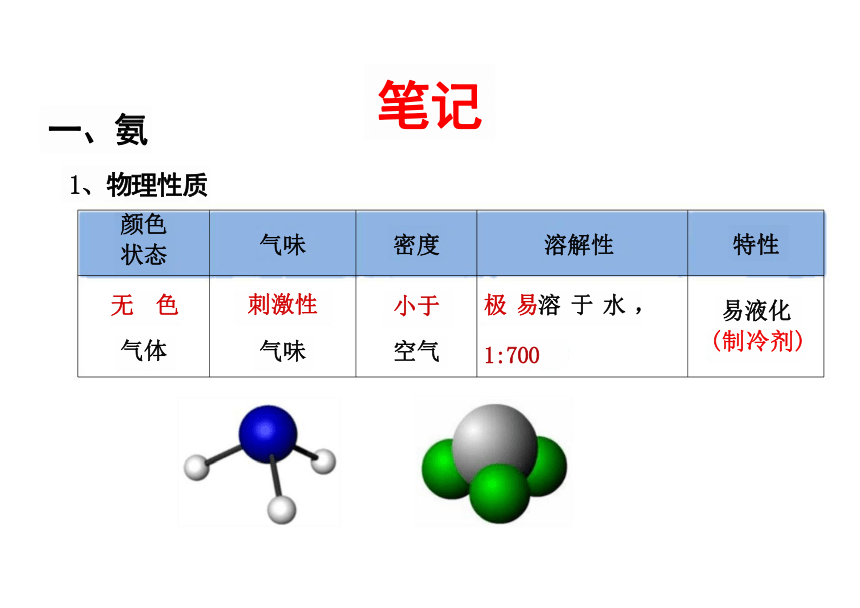
颜色 状态 气味 密度 溶解性
特性
无 色 刺激性 小于 极 易溶 于 水 ,
易液化
气体 气味 空气 1:700
(制冷剂)
一、氨
1、物理性质
笔记
引发操作:
将胶头滴管中的 水挤入烧瓶。
现象:
烧杯中的水进 入烧瓶中,形 成红色的喷泉
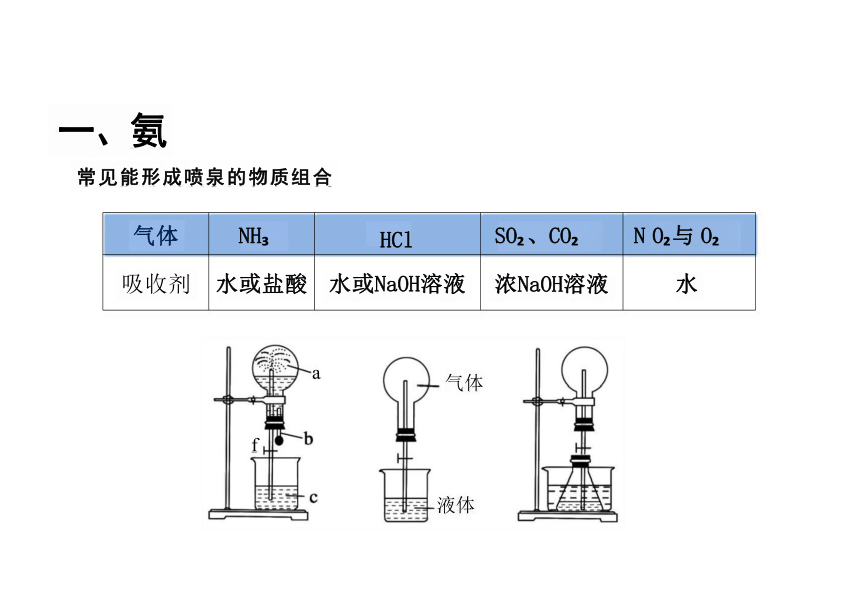
氨气的喷泉实验
一、氨
气体 NH HCl SO 、CO
N O 与 O
吸收剂 水或盐酸 水或NaOH溶液 浓NaOH溶液
水
一、氨
常见能形成喷泉的物质组合
f
液体
气体
a
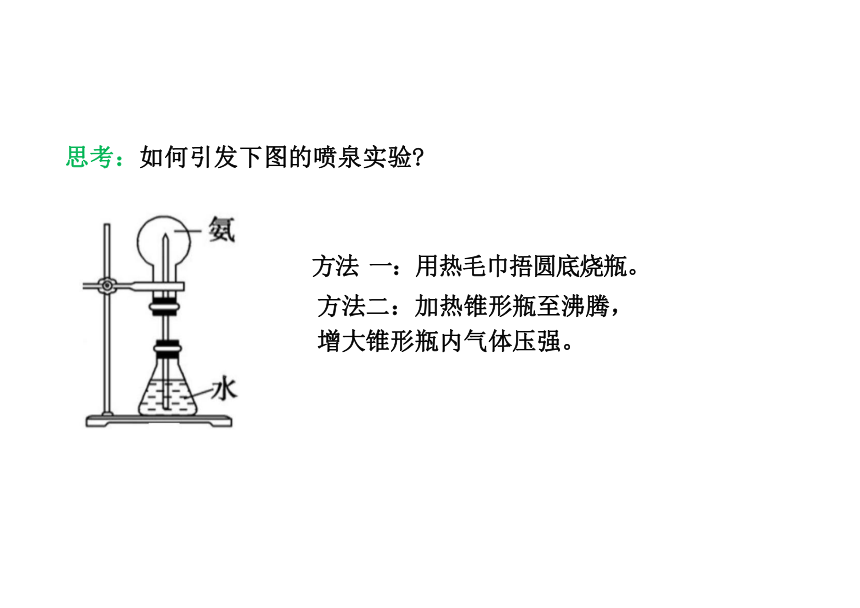
方法 一:用热毛巾捂圆底烧瓶。
方法二:加热锥形瓶至沸腾, 增大锥形瓶内气体压强。
思考:如何引发下图的喷泉实验
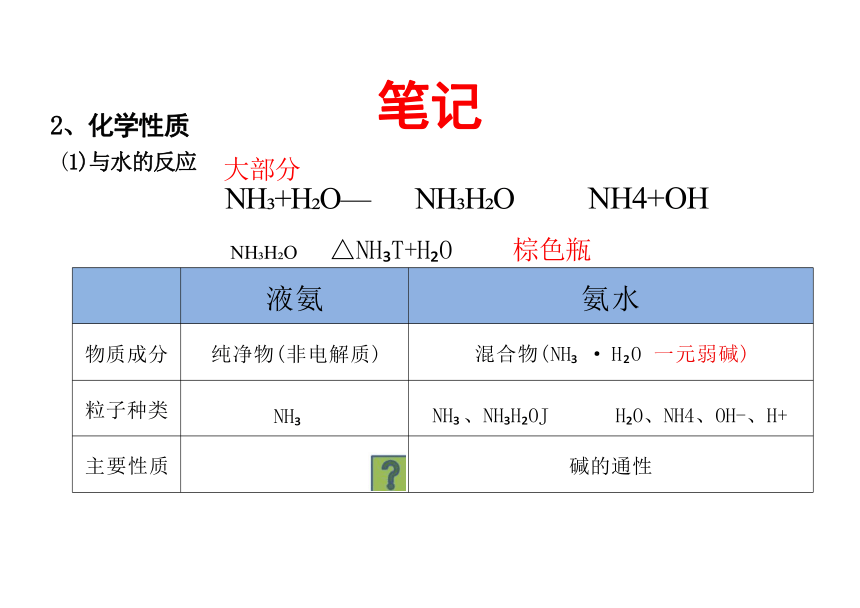
液氨
氨水
物质成分 纯净物(非电解质)
混合物(NH · H O 一元弱碱)
粒子种类 NH
NH 、NH H OJ H O、NH4、OH-、H+
主要性质
碱的通性
笔记
大部分
NH +H O— NH H O
NH H O △NH T+H O 棕色瓶
2、化学性质
(1)与水的反应
NH4+OH
特别提醒
1.NH ·H O化学式不能写成NH OH。
2.氨水中除水分子外,含量最多的是NH ·H O, 但是求氨水的质量分数、 物质的量浓度时,视溶质为NH 。
3.氨水密度小于1g/mL, 且浓度越大,密度越小。
4.氨气是高中阶段唯 一的一种碱性气体
(2)与酸反应
NH +HCl=NH Cl
NH +HNO =NH NO
与挥发性酸反应有白烟
笔记
笔记
2、化学性质
(3)还原性
氨的催化氧化 工业制硝酸的基础
8NH +3Cl =N +6NH C1 检验Cl 泄露 白烟
4NH +6NO==5N +6H O
8NH +6NO ==7N +12H O
治理氮氧化物污染
HNO NO -
NO
NO
NH H O NH
氧化物 酸 碱 盐
N
NH
氢化物单质
物质的 类别
氮元素化合价
+5
+4
+2
0
-3
NH +H O — NH ·H O — NH+OH
能使湿润的红色石蕊试纸变蓝 ,用于 检验氨
NH +HCl===NH Cl
产生 大量白烟 ,也可检验氨
催 化 剂
小结
氨化学性质
4NH +5O === 天===4NO+6H O
NH 表现 还原性
H O
HCl
NH
(工业制HNO 的第一步反应)
催化氧化
硝酸
用稀氨水治疗 蚊虫叮咬
消除二氧化氮 的污染
NH 用途
有机合成工业原料
吸收硫酸生产中
的二氧化硫
NH
致冷剂
铵盐
纯碱
二、铵盐
硫酸铵
AMMONUM SULPHATE
含氮(N)≥21%
净重(NET):(50±0. 5)kg
中国制造
MADE IN CHI
业用碳酸氢铃
执行标准:GB 3559-2001
氮≥17.1%
净含量50Kg
东华鲁恒升化工股份有限公司
硝 酸 铵
颗 粒 状
硝酸铵含量≥99.5%
净含量:(40±0.2)kg
铵盐是农业上常用的氮肥
用碳酸氢锁
执行标准:GB 3559-2001
氮≥17 . 1%
净含量50Kg
东华鲁恒升化工股份有限公司
碳酸氢铵
化 学 式 NH HCO
净重50 kg
含 氮 量 1 6 %
保存注意事项防潮,阴凉处
施用注意事项 避免雨 天高温天 气使用,
不要与碱性物质混用
二、铵盐 1、化学性质 (1)受热分解 NH Cl全NH ^+HCl^
笔记
遇冷形成白色固体
NH HCO 全NH 个+CO 个+H O
注意:铵盐分解不一定都放出氨气
5NH NO C==2HNO +4N +9H O
(2)与碱反应
(2)与碱反应
NH ++OH-===NH ·H O
NH ++OH-===NH 个+H O
NH +检验:
二、铵盐
笔记
(2)与碱反应
NH ++OH-===NH H O
NH ++OHA==NH +H O个
NH +检验:
取待测液少许,与碱液共热,若生成的气体使湿润的红色 石蕊试纸变蓝,则……
或者…浓盐酸…白烟
二 、铵盐
笔记
笔记
三、实验室制法
(2)装置: 固固加热
(3)收集: 向下排空气法
(4)棉花作用:防止空气进入试管
(1)原理:
笔记
三、 实验室制法
(5)验满:同NH +
(6)尾气处理: 水(或硫酸)
倒扣漏斗—防倒吸
(7)干燥:用碱石灰(CaO+NaOH)
不用CaCl (生成CaCl ·8NH )
防倒吸装置
(8)简易制法——浓氨水加热
NH H O( 浓
浓氨水
方法一 方法二
笔记
★工业制法
铵盐的概念及物理性质
铵盐的化学性质 不稳定性、与碱
铵根离子的检验
氨气的实验室制法
氨的物理性质
氨的化学性质
氨的用途
氨与水的反应
喷泉实验探究 氨与酸的反应 氨的催化氧化
类别通性
氧化还原
铵盐
氨
第五章化工生产中的重要非金属元素
第二节氮及其化合物
第2课时氨和铵盐
1.能从物质类别、氮元素价态的角度,认识氨、铵盐的性质与转化。
2.设计实验,如氨的性质实验、制备实验,铵盐的性质实验及铵离子 的检验等,实现氨的转化与生成。
核心素养发展目标
液氨
氨容易液化,汽化时
要吸收大量的热,使周围 温度急剧降低。因此,液 氨可用作制冷剂
颜色 状态 气味 密度 溶解性
特性
无 色 刺激性 小于 极 易溶 于 水 ,
易液化
气体 气味 空气 1:700
(制冷剂)
一、氨
1、物理性质
笔记
引发操作:
将胶头滴管中的 水挤入烧瓶。
现象:
烧杯中的水进 入烧瓶中,形 成红色的喷泉
氨气的喷泉实验
一、氨
气体 NH HCl SO 、CO
N O 与 O
吸收剂 水或盐酸 水或NaOH溶液 浓NaOH溶液
水
一、氨
常见能形成喷泉的物质组合
f
液体
气体
a
方法 一:用热毛巾捂圆底烧瓶。
方法二:加热锥形瓶至沸腾, 增大锥形瓶内气体压强。
思考:如何引发下图的喷泉实验
液氨
氨水
物质成分 纯净物(非电解质)
混合物(NH · H O 一元弱碱)
粒子种类 NH
NH 、NH H OJ H O、NH4、OH-、H+
主要性质
碱的通性
笔记
大部分
NH +H O— NH H O
NH H O △NH T+H O 棕色瓶
2、化学性质
(1)与水的反应
NH4+OH
特别提醒
1.NH ·H O化学式不能写成NH OH。
2.氨水中除水分子外,含量最多的是NH ·H O, 但是求氨水的质量分数、 物质的量浓度时,视溶质为NH 。
3.氨水密度小于1g/mL, 且浓度越大,密度越小。
4.氨气是高中阶段唯 一的一种碱性气体
(2)与酸反应
NH +HCl=NH Cl
NH +HNO =NH NO
与挥发性酸反应有白烟
笔记
笔记
2、化学性质
(3)还原性
氨的催化氧化 工业制硝酸的基础
8NH +3Cl =N +6NH C1 检验Cl 泄露 白烟
4NH +6NO==5N +6H O
8NH +6NO ==7N +12H O
治理氮氧化物污染
HNO NO -
NO
NO
NH H O NH
氧化物 酸 碱 盐
N
NH
氢化物单质
物质的 类别
氮元素化合价
+5
+4
+2
0
-3
NH +H O — NH ·H O — NH+OH
能使湿润的红色石蕊试纸变蓝 ,用于 检验氨
NH +HCl===NH Cl
产生 大量白烟 ,也可检验氨
催 化 剂
小结
氨化学性质
4NH +5O === 天===4NO+6H O
NH 表现 还原性
H O
HCl
NH
(工业制HNO 的第一步反应)
催化氧化
硝酸
用稀氨水治疗 蚊虫叮咬
消除二氧化氮 的污染
NH 用途
有机合成工业原料
吸收硫酸生产中
的二氧化硫
NH
致冷剂
铵盐
纯碱
二、铵盐
硫酸铵
AMMONUM SULPHATE
含氮(N)≥21%
净重(NET):(50±0. 5)kg
中国制造
MADE IN CHI
业用碳酸氢铃
执行标准:GB 3559-2001
氮≥17.1%
净含量50Kg
东华鲁恒升化工股份有限公司
硝 酸 铵
颗 粒 状
硝酸铵含量≥99.5%
净含量:(40±0.2)kg
铵盐是农业上常用的氮肥
用碳酸氢锁
执行标准:GB 3559-2001
氮≥17 . 1%
净含量50Kg
东华鲁恒升化工股份有限公司
碳酸氢铵
化 学 式 NH HCO
净重50 kg
含 氮 量 1 6 %
保存注意事项防潮,阴凉处
施用注意事项 避免雨 天高温天 气使用,
不要与碱性物质混用
二、铵盐 1、化学性质 (1)受热分解 NH Cl全NH ^+HCl^
笔记
遇冷形成白色固体
NH HCO 全NH 个+CO 个+H O
注意:铵盐分解不一定都放出氨气
5NH NO C==2HNO +4N +9H O
(2)与碱反应
(2)与碱反应
NH ++OH-===NH ·H O
NH ++OH-===NH 个+H O
NH +检验:
二、铵盐
笔记
(2)与碱反应
NH ++OH-===NH H O
NH ++OHA==NH +H O个
NH +检验:
取待测液少许,与碱液共热,若生成的气体使湿润的红色 石蕊试纸变蓝,则……
或者…浓盐酸…白烟
二 、铵盐
笔记
笔记
三、实验室制法
(2)装置: 固固加热
(3)收集: 向下排空气法
(4)棉花作用:防止空气进入试管
(1)原理:
笔记
三、 实验室制法
(5)验满:同NH +
(6)尾气处理: 水(或硫酸)
倒扣漏斗—防倒吸
(7)干燥:用碱石灰(CaO+NaOH)
不用CaCl (生成CaCl ·8NH )
防倒吸装置
(8)简易制法——浓氨水加热
NH H O( 浓
浓氨水
方法一 方法二
笔记
★工业制法
铵盐的概念及物理性质
铵盐的化学性质 不稳定性、与碱
铵根离子的检验
氨气的实验室制法
氨的物理性质
氨的化学性质
氨的用途
氨与水的反应
喷泉实验探究 氨与酸的反应 氨的催化氧化
类别通性
氧化还原
铵盐
氨
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
