2.3分子结构与物质的性质(教学课件)——高二化学人教版(2019)选择性必修2(共49张PPT)
文档属性
| 名称 | 2.3分子结构与物质的性质(教学课件)——高二化学人教版(2019)选择性必修2(共49张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 782.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 13:26:03 | ||
图片预览





文档简介
(共49张PPT)
人教版高中化学选择性必修2
第三节分子结构与物质的性质
第一课时共价键的极性
极性共价键 由不同原子形成的共价键,电子对会发生偏移
非极性共价键由相同原子形成的共价键,电子对不发生偏移
以共价键结合的分子是否也有极性分 子、非极性分子之分呢 分子的极性又是 根据什么来判定呢
δ 十 δ
H—Cl
氯化氢分子中的极性共价键
1.共价键的极性
共 价 鍵
要对分子极性进行判断,也可用极性向量。极性向量的矢量和指向的一端,
说明该处负电荷更为集中,为极性分子。若矢量和为零,为非极性分子。
电荷分布不均匀、不对称的分子
极性分子
或:正电荷中心与负电荷中心不重合,即键的极性向量和不为0
电荷分布均匀、对称的分子
非极性分子
或:正电荷中心与负电荷中心重合,即键的极性向量和为0
2.分子的极性
3.分子的极性判断方法
(1)单原子分子(稀有气体)—— 非极性分子
化合物——极性分子
单质——非极性分子
(2)多原子分子
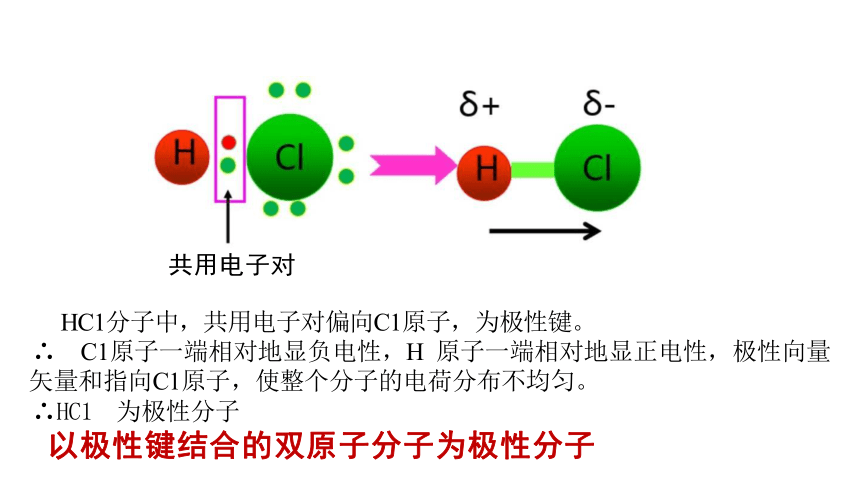
共用电子对
HC1分子中,共用电子对偏向C1原子,为极性键。
∴ C1原子一端相对地显负电性,H 原子一端相对地显正电性,极性向量 矢量和指向C1原子,使整个分子的电荷分布不均匀。
∴HC1 为极性分子
以极性键结合的双原子分子为极性分子
C
CI CI
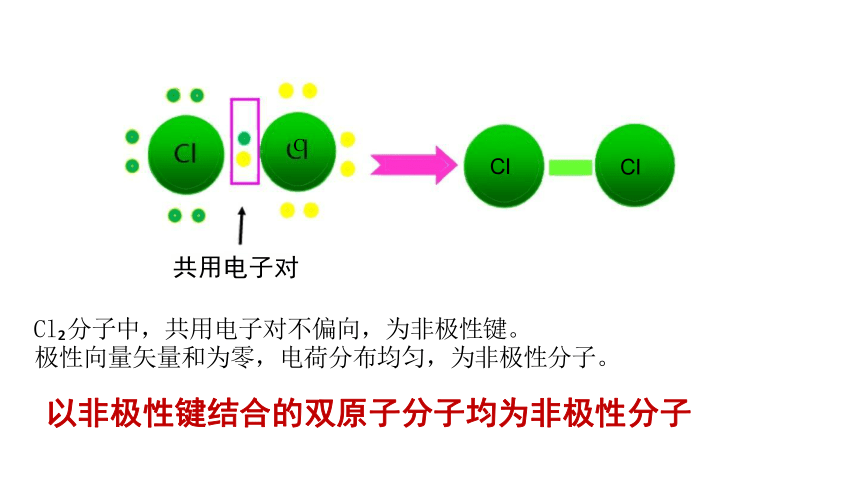
共用电子对
Cl 分子中,共用电子对不偏向,为非极性键。
极性向量矢量和为零,电荷分布均匀,为非极性分子。
以非极性键结合的双原子分子均为非极性分子
(3)多原子分子(AB,型)取决于分子的空间构型—— AB,分子极性的判断方法
①物理模型法(从力的角度分析)
在AB,分子中,A-B键看作相互作用力,根据中心原子A所受合 力是否为零来判断,F合=0,为非极性分子(极性抵消),F合≠0, 为极性分子(极性不抵消)。
0
F合=0
180°
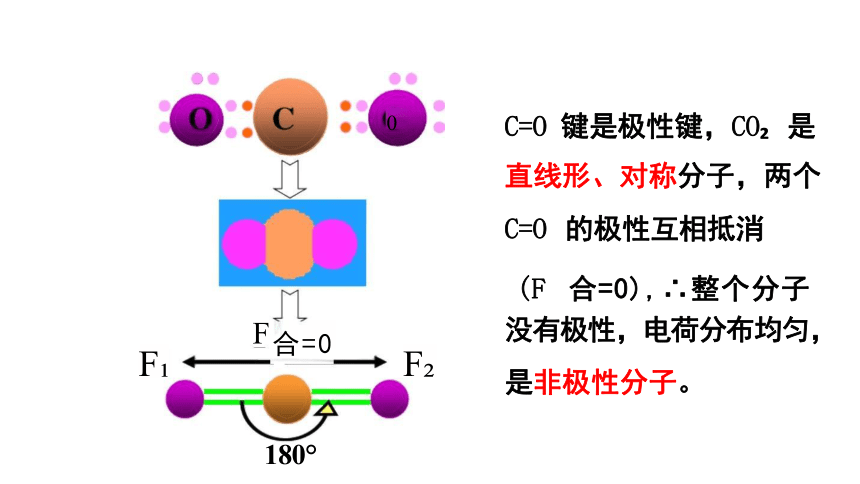
C=O 键是极性键,CO 是
直线形、对称分子,两个 C=O 的极性互相抵消
(F 合=0),∴整个分子
没有极性,电荷分布均匀,
是非极性分子。
F
F
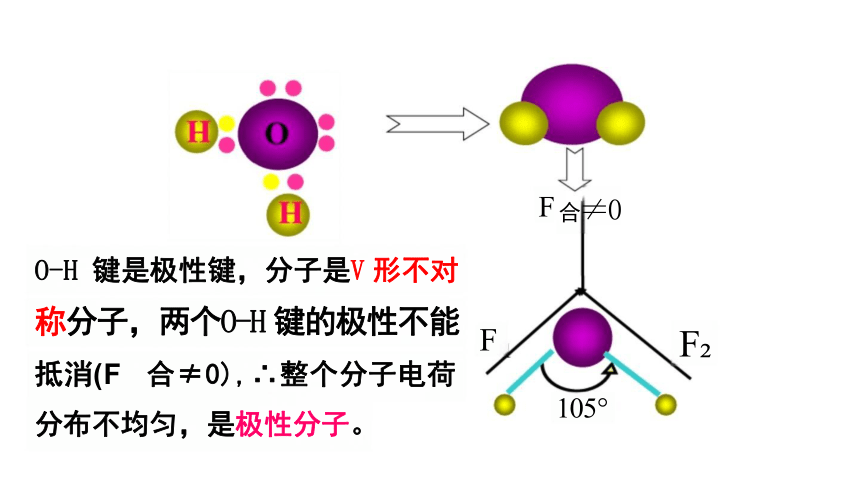
O-H 键是极性键,分子是V 形不对
称分子,两个O-H 键的极性不能 抵消(F 合≠0),∴整个分子电荷 分布不均匀,是极性分子。
F 合≠0
F
105°
F
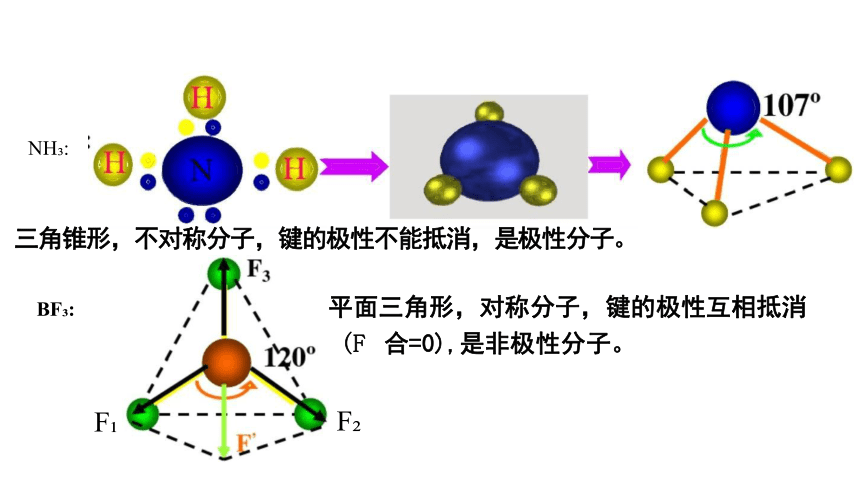
NH :
三角锥形,不对称分子,键的极性不能抵消,是极性分子。
BF : 平面三角形,对称分子,键的极性互相抵消
(F 合=0),是非极性分子。
F F
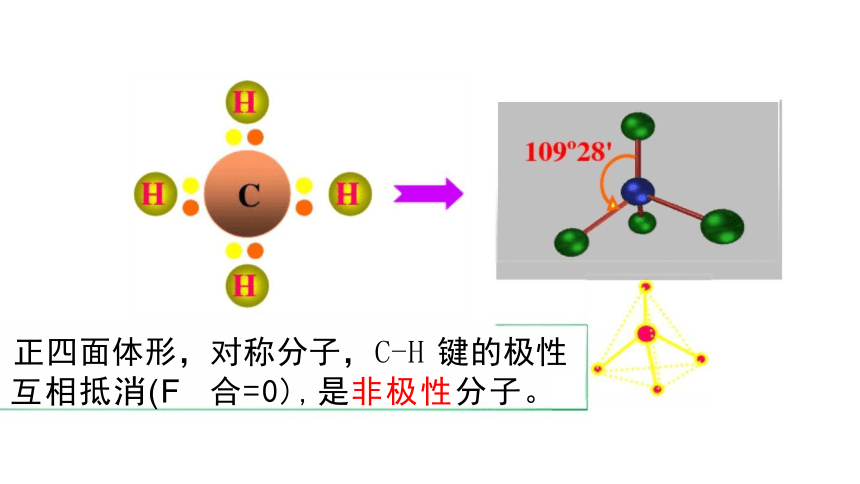
正四面体形,对称分子,C-H 键的极性 互相抵消(F 合=0),是非极性分子。
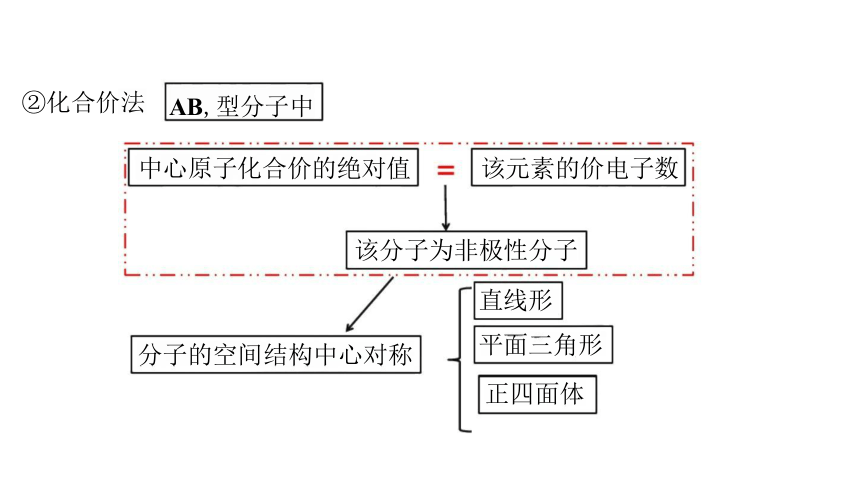
②化合价法 AB,型分子中
中心原子化合价的绝对值 该元素的价电子数
该分子为非极性分子
直线形
平面三角形
正四面体
分子的空间结构中心对称
②化合价法 AB,型分子中
中心原子化合价的绝对值 ≠ 该元素的价电子数
该分子为极性分子
V形
三角锥形
四面体
分子的空间结构不中心对称
分子 BF CO PCl SO H O NH
SO
化合价绝 对值 3 4 5 6 2 3
4
价电子数 3 4 5 6 6 5
6
分子极性 非极性 非极性 非极性 非极性 极性 极性
极性
②化合价法
分子类型 键的极性 分 子 空 间 结 构 分子极性
代表物
双原子 分子 A 非极性键 直线形(对称) 非极性
H 、O 、Cl 、N 等
AB 极性键 直线形(不对称) 极性
HF、HCl、CO、NO等
三原子 分子 A B(或AB ) 极性键 直线形(对称) 非极性
CO 、CS 等
极性键 V形(不对称) 极性
H O、SO 等
四原子 分子 AB 极性键 平面三角形(对称) 非极性
BF 、BC l 等
极性键 三角锥形(不对称) 极性
N H 等
五原子 分子 AB 极性键 正四面体形(对称) 非极性
CH 、CCl
AB,C4-(n<4) 极性键 四面体形(不对称) 极性
C HCl 、CH Cl 等
③根据所含共价键的类型及分子的空间结构判断
(1)分析H O 分子中共价键的种类有哪些
提示:H O 分子中H—O 键为极性共价键,O—O 键为非极性共价键。
(2)H O 分子中正电中心和负电中心是否重合 H O 属于极性分子还是非 极性分子
提示:不重合。H O 属于极性分子。
H O 分子的空间结构可在二面角中表示,如图所示:
、替代氯气的净水剂.....
臭氧分子的空间结构与水分子的相似,臭氧分子中的共 价键是极性键,臭氧分子有极性,但很微弱。仅是水分 子的极性的28%。其中心氧原子是呈正电性的,而端位 的两个氧原子是呈电负性的。
资料卡片 臭氧是极性分子
是一种重要物质。大气高空的臭氧层;保护了地球生物的生存;空 气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂
双原子分子:HCl、NO、CO
V型分子:H O、H S、SO
三角锥形分子:NH 、PH
非正四面体:CHCl
特别地:H O 、O
单质分子:Cl 、N 、P 、O
直线形分子:CO 、CS 、C H
正三角形:SO 、BF
平面形:苯、乙烯
正四面体:CH 、CCl 、SiF
空间不对称
极性键
空间对称
非极性键
共价键
非极性分子
极性分子
羧酸
pKa
丙酸(C H COOH)
4.88
乙酸(CH COOH)
4.76
甲酸(HCOOH)
3.75
氯乙酸(CH CICOOH)
2.86
二氯乙酸(CHCl COOH)
1.29
三氯乙酸(CCl COOH)
0.65
三氟乙酸(CF COOH)
0.23
键的极性对物质的化学性
质有重要影响。例如,羧酸 是一大类含羧基的有机酸。 羧酸的酸性可用pKa的大小来 衡量,pK 越小,酸性越强。
pKa=-lgKa
三氟乙酸的酸性
强于三氯乙酸,这 是由于氟的电负性 大于氯的电负性, C—F键的极性大 于C—Cl键,导致 羧基中的O—H键 的极性更大,更 易 电离出氢离子。
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
F的电负性
F-C的极性
F -C的极性
Cl的电负性
C1-C的极性
Cl -C 的极性
据此,酸性关
系:CCl COOH
>CHCl COOH >CH CICOOH
三氟乙酸的酸性大于三氯乙酸
烃基(符号R-) 是推电子基团
烃基越长推电子效应越大
使羧基中的羟基的极性越小
羧酸的酸性越弱
烃基(符号R—)是推
电子基团,烃基越长, 推电子效应越大,使 羧基中的羟基的极性 越小,羧酸的酸性越 弱。所以酸性:甲酸 >乙酸>丙酸。
随着烃基加长,酸性的差异越来越小
甲酸的酸性大于乙酸
判断物质酸性强弱的方法
根据元素周期律判断
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如 HF②同一周期元素的非金属氢化物的酸性从左向右逐渐增强,如H S③同一主族元素最高价氧化物对应水化物的酸性从上到下逐渐减弱,如 HC1O >HBrO >HIO ;HNO >H PO ;H CO >H SiO 。
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如 H PO对物质溶解性 的 影 响
相似相溶 非极性溶质一般能溶于 非极性溶剂
分子极性相似 极性溶质一般能溶于 极 性 溶 剂
如蔗糖和氨易溶于水,难 溶于四氯化碳。碘易 溶于四氯化碳,难溶于水。
比较NH 和CH 在水中溶解度。怎样用相似相溶规律理解它们溶解度的不同
NH 为极性分子,CH 为非极性分子,而水为极性分子,根据相似相 溶规律,NH 易溶于水,而CH 不易溶于水。
1.判断正误(正确的打“ √ ”,错误的打“×”)
(1)极性分子中不可能含有非极性键。(×)
(2)离子化合物中不可能含有非极性键。(×)
(3)非极性分子中不可能含有极性键。(×)
(4)极性分子中 一 定含有极性键。( √ )
(5)H O、CO 、CH 都是非极性分子。(×)
2.下列物质:①BeCl ②Ar ③白 磷 ④BF ⑤NH ⑥H O , 其中含极
性键的非极性分子是(C)
A.①④⑥ B.②③⑥ C.①④ D.①③④⑤
3.下列各组物质的分子中,都属于含极性键的非极性分子的是(B)
A.CO 、H S B.C H 、CH C.Cl 、C H D.NH 、HCl
4.回答下列问题。
①H ②O ③HCl ④P ⑤C 0 ⑥CO
⑦CH ==CH ⑧HCN ⑨H O ⑩NH BF
CH SO CH Cl Ar 6H O
(1)只含非极性键的是①②④⑤ (填序号,下同);只含极性键的是③⑥
⑧⑨⑩① ④,既含极性键又含非极性键的是 ⑦ 6 。
(2)属于非极性分子的是①②④⑤⑥⑦ 5,属于极性分子的是
③⑧⑨⑩④⑥
人教版高中化学选择性必修2
第三节分子结构与物质的性质
第二课时分子间作用力与分子的手性
授课人:长沙县实验中学 王 姣
那为什么冰山融化过程仍要吸收能量呢
这说明水分子之间存在着相互作用力。
冰山融化现象是物理变化还是化学变化
冰山融化过程中有没有破坏其中的化学键
1.概念:把分子聚集在一起的作用力,叫分子间的作用力。常见的有范德
华力和氢键两类。
2.本质:一种分子之间的静电作用。 3.存在:广泛存在于各种分子之间。
(1) 非金属单质:有的非金属单质,原子之间靠共
价键连接,并形成分子,分子之间有分子间作用力,
如C 0 、P 、H 、O 。有的非金属单质,内部只有共
价键,不存在分子,例如金刚石 (C)、Si。
(2) 共价化合物:由两个或两个以上的不同元素的原子构成,原子之间有
共价键相互连接;如果原子按一定的结合方式形成分子,则分子之间有分子 间作用力;例如CO ,NO,NO ,N O ,SO ; 而有些共价化合物不形成分子,例 如SiO , 只有Si-O键,没有分子间作用力,再如SiC, 只有Si-C键,没有分
子间作用力。
二氧化建的结构( ● 代表硅原子; ● 代表氧原子)
(3) 离子化合物:由阳离子与阴 离子构成,离子之间有离子键,没 有分子这一概念,因此不存在分子 间作用力。
(4) 金属单质:由金属阳离子与 自由电子构成,由金属键进行联系, 无分子的概念,因此也不存在分子 间作用力。
存在分子间作用力的物质微粒
1.大多数共价化合物,例如:CO H SO 、HF, H O,AlCl 、 各种有 机化合物等等;
2.大多数非金属单质,例如: H P 、Sg 、C60、
3.各种稀有气体(例如Ar 、Kr),
、等等
1 .离子化合物,例如: NH Cl、
Al O 、KF, 等等;
2.金属单质,例如:Cu 、Fe 、Na, 等等;
3.某些共价化合物,如石英SiO , 金刚砂 SiC某些非金属单质,如金
刚 石C 、晶体硅Si, 等 等
4.类型:
(一)范德华力: 一种普遍存在于固体、液体和气体中分子间的作用力。
(1)存在:非金属单质(除C 、Si) 分子、稀有气体分子、共价化合物(除SiO ) 分子之 间;石墨片层之间。
( 2 ) 特 点:a.强度很弱,约比化学键能小1~2个数量级。
b.分子间的间距适当时才存在;
c.没有方向性和饱和性。 (与共价键区别)
d.随温度升高而减弱,主要影响物理性质--熔沸点。
(3)影响因素:
对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增大。相对 分子质量相同或相近时,分子的极性越大,范德华力越大。范德华力越大,熔、沸越高。
:键能大小影响分子的热稳定性,范德华力的大小影响物质的熔、沸点。
范德华力是怎样影响分子的物理性质(如熔沸点)的
1.固体→液体→气体的过程,熵值增大,分子间的距离不断被拉开, 这个过程是分子吸收外界能量,克服范德华力。
2.某分子的范德华力如果越大,克服它就需要吸收外界更多的能量, 因此只有外界温度较高时,分子才能顺利克服范德华力,实现固体 液体→气体的三态变化。
3.范德华力越大,则分子的熔沸点越高(与化学性质无关)。
判断分子的熔沸点高低的方法
1.相对分子质量(越大) → 范德华力(越大) → 熔沸点(越高)
2.如果两物质的相对分子质量相近,则看分子的极性。
分子的极性(越大) → 范德华力(越大) → 熔沸点(越高)
例:将下列物质按熔沸点由高到低的顺序排列:
D O > H O I > Br CO >N, CH < SiH
101.4℃ 100℃ 184.35℃ 58.76℃ -190℃ -195.8℃ -161.5℃ -111.9℃
3.同分异构体中, 一般来说,支链数越多,范德华力越小,熔、沸点越低,如沸点: 正戊烷>异戊烷>新戊烷。
4.类型:
(二)氢键:由已经与电负性很大的原子(如N、F、O) 形成共价键的氢原子
与另一分子中电负性很大的原子之间的作用力。
形成原理:当H原子与N 、O 、F 这三种原子中的一种原子形成共价键时, 由于N 、O 、F 的电负性很大,将共用电子对强烈地吸引过来,而使H原子 带有较高的正电性(8+)。此时,H 原子与另一分子中的N、0、F(δ ) 便存在氢键。
形成条件:分子中含有N-H 键、O-H 键、F-H 键中的一种。
氢键一般存在于含N-H 、H-O 、H-F 的物质中,或有机化合物中的醇类和羧 酸类等物质中。
4.类型:
表示:氢键通常用A—H...B 表示,“ ”表示共价键,“..”表示形成的氢
键 (A 、B 为N 、O 、F) 如
键长:指AB 之间的距离。
键能:A—H… B 分解为A—H 和B所需要的能量。
特征:氢键不属于化学键,是一种特殊的分子间作用力。氢键键能较小,
约为共价键的十分之几,但比范德华力强;具有一定的饱和性和方向性。
①饱和性:由于H原子半径比A,B 的原子半径小得多,当H与一个B原子形
成氢键A—H…B 后 ,H 周围的空间被占据, A,B 的电子云排斥作用将阻碍 另一个B原子与H靠近成键,即H只能与一个B形成氢键,氢键具有饱和性。
H的体积小,1个H只能形成1个氢键。
②方向性:A-H 与B形成分子间氢键时,3个原子总是尽可能沿直线分布, 使A,B 尽量远离,这样电子云排斥作用最小,体系能量最低,氢键最强, 最稳定,所以氢键具有方向。
与A和B的电负性有关, 电负性越大,则氢键越强 如F原子电负性最大,
因而F-H…F是最强的氢键。
氢键强弱变化顺序为: F-H…F >O-H…0>O-H…N>N-H…N
C 原子吸引电子能力较弱, 一般不形成氢键。
氢键的强弱:A—H----B 强弱
分类:
①分子间氢键
氢键普遍存在于已经与N 、O 、F形成共价键的氢原子与另外的N 、O、
F原子之间。
如:HF、H O、NH 相互之间;C H OH、CH COOH、H O相互之间。
②分子内氢键
某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO 、—
COOH、—OH 和 —NO 时,可形成分子内的氢键,组成“螯合环”的特殊 结构。
分子间存在氢键时,物质在熔化或汽化时,除需破 坏范德华力外,还需破坏分子间的氢键,消耗更多 的能量,所以存在分子间氢键的物质一般具有较高
Te 的熔、沸点。
s VA~VIIA 族元素的氢化物中,NH 、H O 和HF
的熔、沸点比同主族相邻元素氢化物的熔、沸点高, 这种反常现象是由于它们各自的分子间形成了氢键。
I
hH
H
bH
由
氢键对物质性质的影响
(1)对物质熔、沸点的影响
H O
H $
Hc
PH
SiH
100
75
50
25
0
-25
-50
-75
-100
-125
-150
HF
NH
CH
H Se
AsH
HBE
GeH
2 3 4 5
氢键对物质性质的影响
(1)对物质熔、沸点的影响
①存在分子间氢键的物质一般具有较高的熔、沸点。
②存在分子内氢键使物质熔、沸点降低。 邻羟基苯甲醛的沸点低于对羟基苯甲醛
(2)对水分子性质的影响
水结冰时,体积膨胀,密度降 低 ,氢键的存在迫使在四面体中心的水分子与 四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分 子的空间利用率不高,留有相当大的空隙,其密度比液态水小。
氢键对物质性质的影响
羊毛织品水洗后为什么会变形
大家知道,羊毛织品水洗后会变形,这是什么原 因呢 羊毛纤维是蛋白质构成的,蛋白质上的氨基 和羰基可能会形成氢键。羊毛在浸水和干燥的过程 中,会在这些氢键处纳入水和去除水,而且其变化 往往是不可逆的,从而改变了原先蛋白质的构造,
即原先的氢键部位可能发生移动,由此引起羊毛织 品变形。
△ 图2-4-7 DNA双螺旋结构中的氢键
氢键对物质性质的影响 DNA 双螺旋结构中的氢键
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱 基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制 机理的化学基础。
概念 范德华力 氢键
共价键
定义 物质分子之 间普遍存在 的一种作用 力 已经与电负性很大的原子形成 共价键的氢原子与另一个电负 性很大的原子之间的静电作用
原子间通过共用电 子对所形成的相互 作用
作用微粒 分子 H与N、0、F
原子
特征 无方向性和 饱和性 有方向性和饱和性
有方向性和饱和性
强度 共价键>氢键>范德华力
范德华力、氢键、化学键的比较
1.手性异构体:具有完全相同的组成_ 和原子排列_的一对分子,如同左手 和右手一样互为镜像,却在三维空间里不能_叠合,互称手性异构体(或对 映异构体)。
2.手性分子:有手性异构体的分子。
3.分子的手性判断
(1)判断方法:有机物分子中是否存在手性碳原子。
(2)手性碳原子:连接四个互不相同的原子或基团的
碳原子称为手性碳原子。用*C来标记。具有手性的
有机物,是因为其含有手性碳原子。
4.分子的手性意义
手性分子在生命科学和药物生产方面有广泛的应用。对于手性药物,一 个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。
1.氢键的形成都会使物质的熔、沸点升高。(人)
2.氢键是一种特殊的化学键,它广泛存在于自然界中的物质中。(×) 3.HF的沸点较高,是因为H—F键的键能很大。(×)
4.CH 难溶于水,NH 易溶于水。(√ )
5.HOCH CH OH比CH OH在水中的溶解度小。(×)
6.分子 中含有两个手性碳原子。(×)
7.下列关于氢键的说法正确的是(A)
A.由于氢键的作用,使NH 、H O、HF 的沸点高于同主族其他元素气态氢化物的沸点
B.氢键只能存在于分子间,不能存在于分子内
C.根据氢键键能的大小可知,沸点高低顺序为HF>H O >NH
D.相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多
8.下列物质不存在手性异构体的是(D)
A.BrCH CHOHCH OH
C.CH CHOHCOOH
人教版高中化学选择性必修2
第三节分子结构与物质的性质
第一课时共价键的极性
极性共价键 由不同原子形成的共价键,电子对会发生偏移
非极性共价键由相同原子形成的共价键,电子对不发生偏移
以共价键结合的分子是否也有极性分 子、非极性分子之分呢 分子的极性又是 根据什么来判定呢
δ 十 δ
H—Cl
氯化氢分子中的极性共价键
1.共价键的极性
共 价 鍵
要对分子极性进行判断,也可用极性向量。极性向量的矢量和指向的一端,
说明该处负电荷更为集中,为极性分子。若矢量和为零,为非极性分子。
电荷分布不均匀、不对称的分子
极性分子
或:正电荷中心与负电荷中心不重合,即键的极性向量和不为0
电荷分布均匀、对称的分子
非极性分子
或:正电荷中心与负电荷中心重合,即键的极性向量和为0
2.分子的极性
3.分子的极性判断方法
(1)单原子分子(稀有气体)—— 非极性分子
化合物——极性分子
单质——非极性分子
(2)多原子分子
共用电子对
HC1分子中,共用电子对偏向C1原子,为极性键。
∴ C1原子一端相对地显负电性,H 原子一端相对地显正电性,极性向量 矢量和指向C1原子,使整个分子的电荷分布不均匀。
∴HC1 为极性分子
以极性键结合的双原子分子为极性分子
C
CI CI
共用电子对
Cl 分子中,共用电子对不偏向,为非极性键。
极性向量矢量和为零,电荷分布均匀,为非极性分子。
以非极性键结合的双原子分子均为非极性分子
(3)多原子分子(AB,型)取决于分子的空间构型—— AB,分子极性的判断方法
①物理模型法(从力的角度分析)
在AB,分子中,A-B键看作相互作用力,根据中心原子A所受合 力是否为零来判断,F合=0,为非极性分子(极性抵消),F合≠0, 为极性分子(极性不抵消)。
0
F合=0
180°
C=O 键是极性键,CO 是
直线形、对称分子,两个 C=O 的极性互相抵消
(F 合=0),∴整个分子
没有极性,电荷分布均匀,
是非极性分子。
F
F
O-H 键是极性键,分子是V 形不对
称分子,两个O-H 键的极性不能 抵消(F 合≠0),∴整个分子电荷 分布不均匀,是极性分子。
F 合≠0
F
105°
F
NH :
三角锥形,不对称分子,键的极性不能抵消,是极性分子。
BF : 平面三角形,对称分子,键的极性互相抵消
(F 合=0),是非极性分子。
F F
正四面体形,对称分子,C-H 键的极性 互相抵消(F 合=0),是非极性分子。
②化合价法 AB,型分子中
中心原子化合价的绝对值 该元素的价电子数
该分子为非极性分子
直线形
平面三角形
正四面体
分子的空间结构中心对称
②化合价法 AB,型分子中
中心原子化合价的绝对值 ≠ 该元素的价电子数
该分子为极性分子
V形
三角锥形
四面体
分子的空间结构不中心对称
分子 BF CO PCl SO H O NH
SO
化合价绝 对值 3 4 5 6 2 3
4
价电子数 3 4 5 6 6 5
6
分子极性 非极性 非极性 非极性 非极性 极性 极性
极性
②化合价法
分子类型 键的极性 分 子 空 间 结 构 分子极性
代表物
双原子 分子 A 非极性键 直线形(对称) 非极性
H 、O 、Cl 、N 等
AB 极性键 直线形(不对称) 极性
HF、HCl、CO、NO等
三原子 分子 A B(或AB ) 极性键 直线形(对称) 非极性
CO 、CS 等
极性键 V形(不对称) 极性
H O、SO 等
四原子 分子 AB 极性键 平面三角形(对称) 非极性
BF 、BC l 等
极性键 三角锥形(不对称) 极性
N H 等
五原子 分子 AB 极性键 正四面体形(对称) 非极性
CH 、CCl
AB,C4-(n<4) 极性键 四面体形(不对称) 极性
C HCl 、CH Cl 等
③根据所含共价键的类型及分子的空间结构判断
(1)分析H O 分子中共价键的种类有哪些
提示:H O 分子中H—O 键为极性共价键,O—O 键为非极性共价键。
(2)H O 分子中正电中心和负电中心是否重合 H O 属于极性分子还是非 极性分子
提示:不重合。H O 属于极性分子。
H O 分子的空间结构可在二面角中表示,如图所示:
、替代氯气的净水剂.....
臭氧分子的空间结构与水分子的相似,臭氧分子中的共 价键是极性键,臭氧分子有极性,但很微弱。仅是水分 子的极性的28%。其中心氧原子是呈正电性的,而端位 的两个氧原子是呈电负性的。
资料卡片 臭氧是极性分子
是一种重要物质。大气高空的臭氧层;保护了地球生物的生存;空 气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂
双原子分子:HCl、NO、CO
V型分子:H O、H S、SO
三角锥形分子:NH 、PH
非正四面体:CHCl
特别地:H O 、O
单质分子:Cl 、N 、P 、O
直线形分子:CO 、CS 、C H
正三角形:SO 、BF
平面形:苯、乙烯
正四面体:CH 、CCl 、SiF
空间不对称
极性键
空间对称
非极性键
共价键
非极性分子
极性分子
羧酸
pKa
丙酸(C H COOH)
4.88
乙酸(CH COOH)
4.76
甲酸(HCOOH)
3.75
氯乙酸(CH CICOOH)
2.86
二氯乙酸(CHCl COOH)
1.29
三氯乙酸(CCl COOH)
0.65
三氟乙酸(CF COOH)
0.23
键的极性对物质的化学性
质有重要影响。例如,羧酸 是一大类含羧基的有机酸。 羧酸的酸性可用pKa的大小来 衡量,pK 越小,酸性越强。
pKa=-lgKa
三氟乙酸的酸性
强于三氯乙酸,这 是由于氟的电负性 大于氯的电负性, C—F键的极性大 于C—Cl键,导致 羧基中的O—H键 的极性更大,更 易 电离出氢离子。
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
F的电负性
F-C的极性
F -C的极性
Cl的电负性
C1-C的极性
Cl -C 的极性
据此,酸性关
系:CCl COOH
>CHCl COOH >CH CICOOH
三氟乙酸的酸性大于三氯乙酸
烃基(符号R-) 是推电子基团
烃基越长推电子效应越大
使羧基中的羟基的极性越小
羧酸的酸性越弱
烃基(符号R—)是推
电子基团,烃基越长, 推电子效应越大,使 羧基中的羟基的极性 越小,羧酸的酸性越 弱。所以酸性:甲酸 >乙酸>丙酸。
随着烃基加长,酸性的差异越来越小
甲酸的酸性大于乙酸
判断物质酸性强弱的方法
根据元素周期律判断
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如 HF
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如 H PO
相似相溶 非极性溶质一般能溶于 非极性溶剂
分子极性相似 极性溶质一般能溶于 极 性 溶 剂
如蔗糖和氨易溶于水,难 溶于四氯化碳。碘易 溶于四氯化碳,难溶于水。
比较NH 和CH 在水中溶解度。怎样用相似相溶规律理解它们溶解度的不同
NH 为极性分子,CH 为非极性分子,而水为极性分子,根据相似相 溶规律,NH 易溶于水,而CH 不易溶于水。
1.判断正误(正确的打“ √ ”,错误的打“×”)
(1)极性分子中不可能含有非极性键。(×)
(2)离子化合物中不可能含有非极性键。(×)
(3)非极性分子中不可能含有极性键。(×)
(4)极性分子中 一 定含有极性键。( √ )
(5)H O、CO 、CH 都是非极性分子。(×)
2.下列物质:①BeCl ②Ar ③白 磷 ④BF ⑤NH ⑥H O , 其中含极
性键的非极性分子是(C)
A.①④⑥ B.②③⑥ C.①④ D.①③④⑤
3.下列各组物质的分子中,都属于含极性键的非极性分子的是(B)
A.CO 、H S B.C H 、CH C.Cl 、C H D.NH 、HCl
4.回答下列问题。
①H ②O ③HCl ④P ⑤C 0 ⑥CO
⑦CH ==CH ⑧HCN ⑨H O ⑩NH BF
CH SO CH Cl Ar 6H O
(1)只含非极性键的是①②④⑤ (填序号,下同);只含极性键的是③⑥
⑧⑨⑩① ④,既含极性键又含非极性键的是 ⑦ 6 。
(2)属于非极性分子的是①②④⑤⑥⑦ 5,属于极性分子的是
③⑧⑨⑩④⑥
人教版高中化学选择性必修2
第三节分子结构与物质的性质
第二课时分子间作用力与分子的手性
授课人:长沙县实验中学 王 姣
那为什么冰山融化过程仍要吸收能量呢
这说明水分子之间存在着相互作用力。
冰山融化现象是物理变化还是化学变化
冰山融化过程中有没有破坏其中的化学键
1.概念:把分子聚集在一起的作用力,叫分子间的作用力。常见的有范德
华力和氢键两类。
2.本质:一种分子之间的静电作用。 3.存在:广泛存在于各种分子之间。
(1) 非金属单质:有的非金属单质,原子之间靠共
价键连接,并形成分子,分子之间有分子间作用力,
如C 0 、P 、H 、O 。有的非金属单质,内部只有共
价键,不存在分子,例如金刚石 (C)、Si。
(2) 共价化合物:由两个或两个以上的不同元素的原子构成,原子之间有
共价键相互连接;如果原子按一定的结合方式形成分子,则分子之间有分子 间作用力;例如CO ,NO,NO ,N O ,SO ; 而有些共价化合物不形成分子,例 如SiO , 只有Si-O键,没有分子间作用力,再如SiC, 只有Si-C键,没有分
子间作用力。
二氧化建的结构( ● 代表硅原子; ● 代表氧原子)
(3) 离子化合物:由阳离子与阴 离子构成,离子之间有离子键,没 有分子这一概念,因此不存在分子 间作用力。
(4) 金属单质:由金属阳离子与 自由电子构成,由金属键进行联系, 无分子的概念,因此也不存在分子 间作用力。
存在分子间作用力的物质微粒
1.大多数共价化合物,例如:CO H SO 、HF, H O,AlCl 、 各种有 机化合物等等;
2.大多数非金属单质,例如: H P 、Sg 、C60、
3.各种稀有气体(例如Ar 、Kr),
、等等
1 .离子化合物,例如: NH Cl、
Al O 、KF, 等等;
2.金属单质,例如:Cu 、Fe 、Na, 等等;
3.某些共价化合物,如石英SiO , 金刚砂 SiC某些非金属单质,如金
刚 石C 、晶体硅Si, 等 等
4.类型:
(一)范德华力: 一种普遍存在于固体、液体和气体中分子间的作用力。
(1)存在:非金属单质(除C 、Si) 分子、稀有气体分子、共价化合物(除SiO ) 分子之 间;石墨片层之间。
( 2 ) 特 点:a.强度很弱,约比化学键能小1~2个数量级。
b.分子间的间距适当时才存在;
c.没有方向性和饱和性。 (与共价键区别)
d.随温度升高而减弱,主要影响物理性质--熔沸点。
(3)影响因素:
对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增大。相对 分子质量相同或相近时,分子的极性越大,范德华力越大。范德华力越大,熔、沸越高。
:键能大小影响分子的热稳定性,范德华力的大小影响物质的熔、沸点。
范德华力是怎样影响分子的物理性质(如熔沸点)的
1.固体→液体→气体的过程,熵值增大,分子间的距离不断被拉开, 这个过程是分子吸收外界能量,克服范德华力。
2.某分子的范德华力如果越大,克服它就需要吸收外界更多的能量, 因此只有外界温度较高时,分子才能顺利克服范德华力,实现固体 液体→气体的三态变化。
3.范德华力越大,则分子的熔沸点越高(与化学性质无关)。
判断分子的熔沸点高低的方法
1.相对分子质量(越大) → 范德华力(越大) → 熔沸点(越高)
2.如果两物质的相对分子质量相近,则看分子的极性。
分子的极性(越大) → 范德华力(越大) → 熔沸点(越高)
例:将下列物质按熔沸点由高到低的顺序排列:
D O > H O I > Br CO >N, CH < SiH
101.4℃ 100℃ 184.35℃ 58.76℃ -190℃ -195.8℃ -161.5℃ -111.9℃
3.同分异构体中, 一般来说,支链数越多,范德华力越小,熔、沸点越低,如沸点: 正戊烷>异戊烷>新戊烷。
4.类型:
(二)氢键:由已经与电负性很大的原子(如N、F、O) 形成共价键的氢原子
与另一分子中电负性很大的原子之间的作用力。
形成原理:当H原子与N 、O 、F 这三种原子中的一种原子形成共价键时, 由于N 、O 、F 的电负性很大,将共用电子对强烈地吸引过来,而使H原子 带有较高的正电性(8+)。此时,H 原子与另一分子中的N、0、F(δ ) 便存在氢键。
形成条件:分子中含有N-H 键、O-H 键、F-H 键中的一种。
氢键一般存在于含N-H 、H-O 、H-F 的物质中,或有机化合物中的醇类和羧 酸类等物质中。
4.类型:
表示:氢键通常用A—H...B 表示,“ ”表示共价键,“..”表示形成的氢
键 (A 、B 为N 、O 、F) 如
键长:指AB 之间的距离。
键能:A—H… B 分解为A—H 和B所需要的能量。
特征:氢键不属于化学键,是一种特殊的分子间作用力。氢键键能较小,
约为共价键的十分之几,但比范德华力强;具有一定的饱和性和方向性。
①饱和性:由于H原子半径比A,B 的原子半径小得多,当H与一个B原子形
成氢键A—H…B 后 ,H 周围的空间被占据, A,B 的电子云排斥作用将阻碍 另一个B原子与H靠近成键,即H只能与一个B形成氢键,氢键具有饱和性。
H的体积小,1个H只能形成1个氢键。
②方向性:A-H 与B形成分子间氢键时,3个原子总是尽可能沿直线分布, 使A,B 尽量远离,这样电子云排斥作用最小,体系能量最低,氢键最强, 最稳定,所以氢键具有方向。
与A和B的电负性有关, 电负性越大,则氢键越强 如F原子电负性最大,
因而F-H…F是最强的氢键。
氢键强弱变化顺序为: F-H…F >O-H…0>O-H…N>N-H…N
C 原子吸引电子能力较弱, 一般不形成氢键。
氢键的强弱:A—H----B 强弱
分类:
①分子间氢键
氢键普遍存在于已经与N 、O 、F形成共价键的氢原子与另外的N 、O、
F原子之间。
如:HF、H O、NH 相互之间;C H OH、CH COOH、H O相互之间。
②分子内氢键
某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO 、—
COOH、—OH 和 —NO 时,可形成分子内的氢键,组成“螯合环”的特殊 结构。
分子间存在氢键时,物质在熔化或汽化时,除需破 坏范德华力外,还需破坏分子间的氢键,消耗更多 的能量,所以存在分子间氢键的物质一般具有较高
Te 的熔、沸点。
s VA~VIIA 族元素的氢化物中,NH 、H O 和HF
的熔、沸点比同主族相邻元素氢化物的熔、沸点高, 这种反常现象是由于它们各自的分子间形成了氢键。
I
hH
H
bH
由
氢键对物质性质的影响
(1)对物质熔、沸点的影响
H O
H $
Hc
PH
SiH
100
75
50
25
0
-25
-50
-75
-100
-125
-150
HF
NH
CH
H Se
AsH
HBE
GeH
2 3 4 5
氢键对物质性质的影响
(1)对物质熔、沸点的影响
①存在分子间氢键的物质一般具有较高的熔、沸点。
②存在分子内氢键使物质熔、沸点降低。 邻羟基苯甲醛的沸点低于对羟基苯甲醛
(2)对水分子性质的影响
水结冰时,体积膨胀,密度降 低 ,氢键的存在迫使在四面体中心的水分子与 四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分 子的空间利用率不高,留有相当大的空隙,其密度比液态水小。
氢键对物质性质的影响
羊毛织品水洗后为什么会变形
大家知道,羊毛织品水洗后会变形,这是什么原 因呢 羊毛纤维是蛋白质构成的,蛋白质上的氨基 和羰基可能会形成氢键。羊毛在浸水和干燥的过程 中,会在这些氢键处纳入水和去除水,而且其变化 往往是不可逆的,从而改变了原先蛋白质的构造,
即原先的氢键部位可能发生移动,由此引起羊毛织 品变形。
△ 图2-4-7 DNA双螺旋结构中的氢键
氢键对物质性质的影响 DNA 双螺旋结构中的氢键
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱 基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制 机理的化学基础。
概念 范德华力 氢键
共价键
定义 物质分子之 间普遍存在 的一种作用 力 已经与电负性很大的原子形成 共价键的氢原子与另一个电负 性很大的原子之间的静电作用
原子间通过共用电 子对所形成的相互 作用
作用微粒 分子 H与N、0、F
原子
特征 无方向性和 饱和性 有方向性和饱和性
有方向性和饱和性
强度 共价键>氢键>范德华力
范德华力、氢键、化学键的比较
1.手性异构体:具有完全相同的组成_ 和原子排列_的一对分子,如同左手 和右手一样互为镜像,却在三维空间里不能_叠合,互称手性异构体(或对 映异构体)。
2.手性分子:有手性异构体的分子。
3.分子的手性判断
(1)判断方法:有机物分子中是否存在手性碳原子。
(2)手性碳原子:连接四个互不相同的原子或基团的
碳原子称为手性碳原子。用*C来标记。具有手性的
有机物,是因为其含有手性碳原子。
4.分子的手性意义
手性分子在生命科学和药物生产方面有广泛的应用。对于手性药物,一 个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。
1.氢键的形成都会使物质的熔、沸点升高。(人)
2.氢键是一种特殊的化学键,它广泛存在于自然界中的物质中。(×) 3.HF的沸点较高,是因为H—F键的键能很大。(×)
4.CH 难溶于水,NH 易溶于水。(√ )
5.HOCH CH OH比CH OH在水中的溶解度小。(×)
6.分子 中含有两个手性碳原子。(×)
7.下列关于氢键的说法正确的是(A)
A.由于氢键的作用,使NH 、H O、HF 的沸点高于同主族其他元素气态氢化物的沸点
B.氢键只能存在于分子间,不能存在于分子内
C.根据氢键键能的大小可知,沸点高低顺序为HF>H O >NH
D.相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多
8.下列物质不存在手性异构体的是(D)
A.BrCH CHOHCH OH
C.CH CHOHCOOH
