反应热++焓变说课 高二上学期化学人教版(2019)选择性必修1(共25张PPT)
文档属性
| 名称 | 反应热++焓变说课 高二上学期化学人教版(2019)选择性必修1(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 17:54:37 | ||
图片预览






文档简介
(共25张PPT)
1 2 3 4 5
教学过程 板书设计
课标及教 材分析
教学目标 及重难点
学情分析
目录
课标及教材分析
PARTONE
课标分析
4 . 化学反应原理
人类在探索物质变化的历史过程中,积累了许多有关物质变化的知识,加深和发展了对 化学变化的本质认识,人们根据化学反应的规律控制和利用化学反应,不断丰富社会物质 财富,提高人类的生活质量,推动社会的发展。
在本课程模块中,我们将从化学反应与能量、化学反应速率和化学平衡以及溶液中的离 子平衡等方面,探索化学反应的规律及其应用。
通过本课程模块的学习,学生应主要在以下几个方面得到发展:
1.认识化学变化所遵循的基本原理,初步形成关于物质变化的正确观念;
2.了解化学反应中能量转化所遵循的规律,知道化学反应原理在生产、生活和科学研究 中的应用;
3.赞赏运用化学反应原理合成新物质对科学技术和人类社会文明所起的重要作用,能对 生产、生活和自然界中的有关化学变化现象进行合理的解释;
4.增强探索化学反应原理的兴趣,树立学习和研究化学的志向。
课标分析
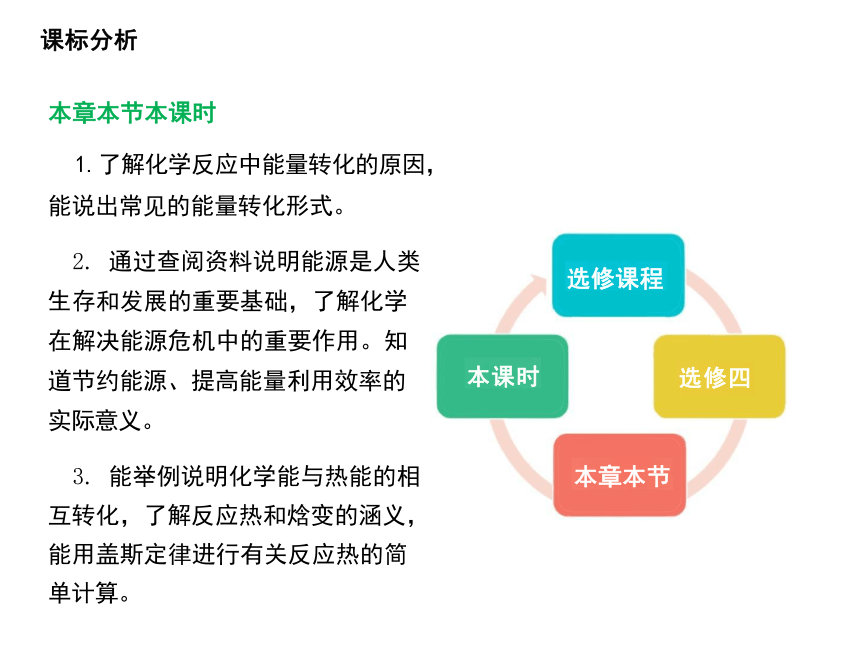
本章本节本课时
1.了解化学反应中能量转化的原因, 能说出常见的能量转化形式。
2. 通过查阅资料说明能源是人类 生存和发展的重要基础,了解化学 在解决能源危机中的重要作用。知 道节约能源、提高能量利用效率的 实际意义。
3. 能举例说明化学能与热能的相 互转化,了解反应热和焓变的涵义, 能用盖斯定律进行有关反应热的简 单计算。
选修课程
本课时 选修四
本章本节
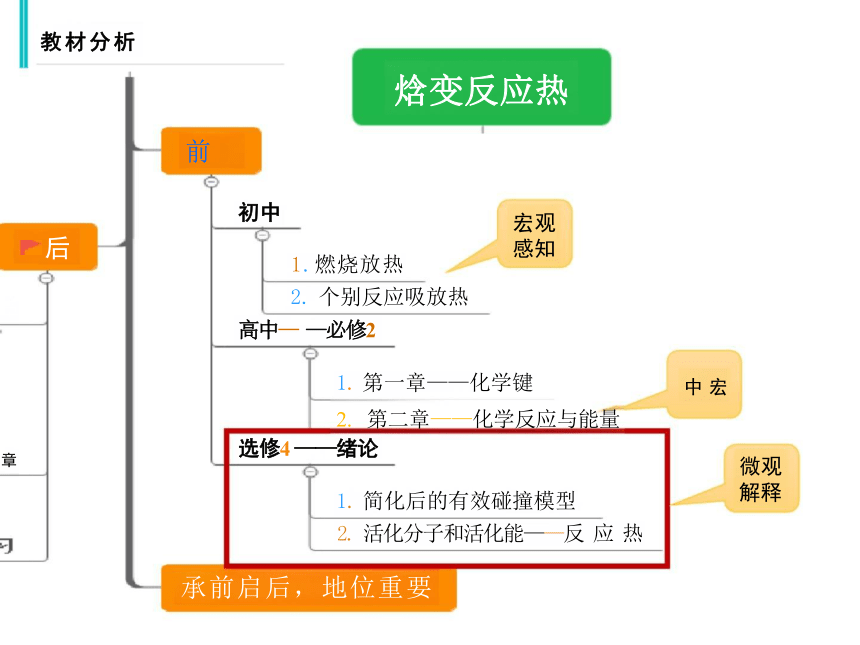
1. 第一章——化学键
2. 第二章——化学反应与能量
选修4 ——绪论
1. 简化后的有效碰撞模型
2. 活化分子和活化能——反 应 热
承前启后,地位重要
初中
1.燃烧放热
2. 个别反应吸放热
高中— —必修2
教材分析
前
中 宏
微观 解释
焓变反应热
后
章
宏观 感知
章
教材分析
焓变反应热
承前启后,地位重要
后
本章
1. 热化学方程式的书写
2. 燃烧热的计算
3. 化学反应热的计算——盖斯定律
第二章
1. 第四节化学反应方向的判断
高阶化学知识的学习
PARTTW0
学情分析
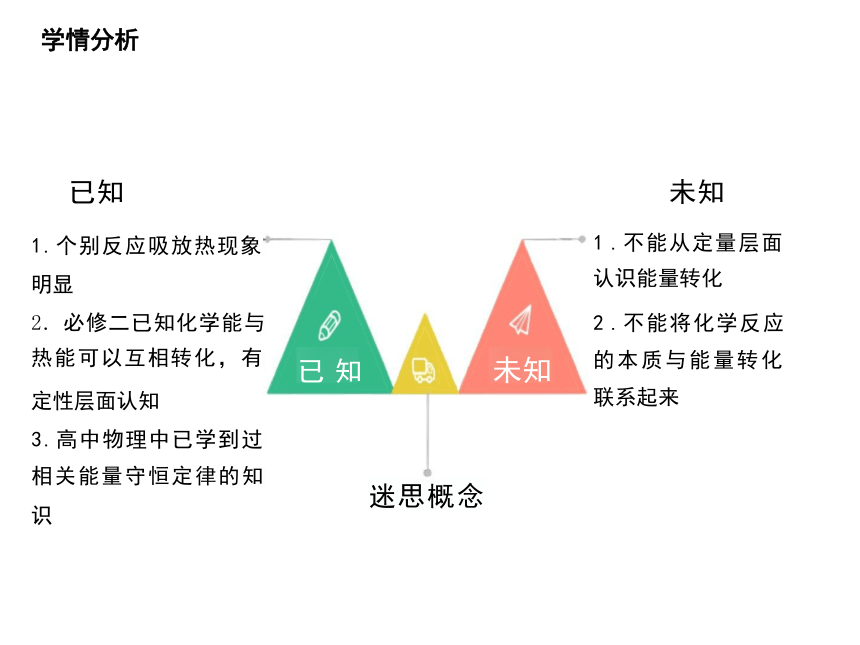
学情分析
已知 未知
1.个别反应吸放热现象
明显
2. 必修二已知化学能与 热能可以互相转化,有
定性层面认知
3.高中物理中已学到过 相关能量守恒定律的知
识
已 知 未知
迷思概念
1 .不能从定量层面
认识能量转化
2 .不能将化学反应 的本质与能量转化 联系起来
1 焓变和反应热 的含义理解不 到 位 ,焓变和 反应热是热量 变化使得体系 能量变化,但 不能认为焓变 和反应热即为 能量变化。 2 认为化学反应 的焓变就是该 化学反应的反 应热。 反应在恒压条 件下进行时, 反应热等于焓 变
错误理解: 放热反应使 体系温度升 高,吸热反 应降低体系 温度。
吸放热与体 系温度有关, 但不是唯一 决定因素。
4
错误理解:反 应热就是反应 放出或吸收的 热量。
在恒压以及不 作非膨胀功的 情况下,若使 生成物的温度 回到反应物的 起始温度.这 时体系所放出 或吸收的热量 称为反应热
参考文献
[1]陈莉.高中《化学反应原理》迷思概念诊断研究[D].湖南师范大学,2016.
[2]新理念化学教学诊断学[M].北京大学出版社,王后雄,王世存,2014
迷思概念
人
PARTTHREE
三维目标及重难点
情感态度与价值观
(1) 通过复习回顾必修二所学化学键中化学反应的本质,从而从化学键 的角度分析反应热,知道温故知新的重要意义。
(2) 从不同角度分析教材,初中以前对化学反应中能量变化的认知属于 宏观感知,必修二属于能量中宏观,选修四则是微观解释,从而树立知识进阶 系统化观念。
过程与方法
(1)通过对化学反应本质的回顾,从化 学键的角度去分析反应热的计算,学习 科学运用已知(先行组织者)研究未知 的方法。
(2)通过画能量变化图,学习用第四重 表征即图表的形式来演绎化学概念模型。
知识与技能
(1)知道反应中能量转化的原因及几种能量
热
(4) 理解焓变和反应热的含义
(3)能够从定量角度用准确的数值表示反应
转化类型
(2)能够举例说
三维目标及重难点
与热能的相互转化
重点
难点
教学过程
PARTTHRE
本课时教材结构重组
原教材顺序
能量变化图分析
反应热定义及
吸放热判断
反应示例分析
焓变概念
X (1)认知层次不符合学生心理认知的先后顺序
(2)概念同化模式,不符合新课标要求
反应示例分析
引
环节一: 温故知新
反应热定义
探
环节二: 一探究竟
环节四: 析 四重表征
环节三:
新知初上
焓变定义及 吸放热判断
本课时教材结构重组
重组顺序
能量变化图分析
Q1 : 表观感觉,反应是吸热还是放热
Q2 : 若 1mol 氢气和1mol 氯气反应,会放 出多少热 小组讨论怎样做才能最准确得 到放出热量的量
温故知新,从先行组织者出发,符合学生认知顺序,
创设情境,引起认知冲突,引发思考,从而进一步 从定量角度探究热量该如何计算。
方法一:实验室测量
方法二:理论计算 一
H (g)+Cl (g)=2HCl
创设情境,建构问题支架,建构主义理论思想
(回顾氢气与氯气反应的实验, 再次分析实验现象,发现问题)
Omol
如何突破
更准确
(g)
环节—:温故知新
1mol 0mol
1mol
0mol
初 完
通过分析氢气与氯气反应体系环境条件,得出
计算反应热的前提条件:针对某一体系,恒压 条件下,生成物温度回到反应物反应前温度后 本过程放出或者吸收的热量即为反应热。
环节—:温故知新
分析相关变量,培养严谨科学态度 补充 体系与环境
从物理中能量守恒角度去分析,可以把此反应体系看 成一个整体,计算前明确范围,针对这一反应体系。
本体系反应时,敞口,即压强恒定
生成物的温度回到和反应物反应前相同温 度 ,中间过程放出和吸收的热量即为我们 所要计算的结果。
被研究的物质系统统称为
习题,体系以外的其他部 分称为环境。
Q3
体系环境 前提分析
1
2
3
教法:引导
学法:小组讨论
搭建新旧知识的桥梁,有效过渡,从微观层面分析反应热
实现从实验现象的宏观到微观的过渡,突出重点,有效理 解与记忆,从而实现三维目标的统一。
Q4 : 新物质是怎么生成的 (化学反应的本质是 )
H (g)+Cl (g)=2HCl (g) 旧键的断裂和新键的生成
假想的中 间物质 去分析,如果
少巢:,版83KJ/mo
是不是就能够
搭建新旧知识之间的桥梁——化学反应本质
431 kJ/mol H@H@ 能量
环节 :—探究竟
kJ/mol 能量
kJ/mol 能量
H
中
@
键
形
成
键 断裂 键 断裂
HH
@ a
H
中
CI
键
431 kJ/mol 能量
(436
243
形成
环节二:一探究竟
及时检测与评价
总结:
反应热定义:当一个化学反应在恒压以及不作非膨胀功的情况 下发生后,若使生成物的温度回到反应物的起始温度.这时体 系所放出或吸收的热量称为反应热
Q5: 用什么来表示反应热呢
及时检测,利用口头提问的方式对反应热的
定义进行及时巩固,从而突出重点,突破难 点,即对反应热含义的理解。
焓 (H) 是与内能有关的物理量,焓变(△H) 是一个描述系统状
态的状态函数,在恒压条件下,△H 数值上等于恒压反应热。
其中,放热,△H<0, 吸热△H>0
焓变的引出自然顺畅,符合学生认知,将反
应热与焓变分开来,以免学生产生迷思概念 为后面的概念辨析做准备。
Q5: 用什么来表示反应热呢 教法:讲授
H (g)+Cl (g)=2HCl (g),△H =-183 KJ/mol
反应热新表示
焓变△H
环节三:新知初上
小步子原则,以提问判断的方式, 一步步将
概念分解开来,把迷思概念消灭在萌芽中。
Q8: 放热反应使体系温度升高,吸热反应降低体系温度
Q9: 需要加热的反应是吸热反应,放热反应不需要加热
Q6: 焓变就是体系的能量变化
Q7: 反应的焓变就是反应热
及时检测与评价——迷思概念辨析
环节三:新知初上
放热反应 吸热反应
化学反应过程中能量变化示意图
作业:预习热化学方程式书写
符号:方程式书写
曲线:
实现三维目标
四重表征在化学学习中地位重
要,培养学生深刻记忆并且学 会运用。
h能量。ww.teachers 能量
反应物的 反应物 反应物的
总能量 总能量
放 出
热 量
AH 为“ ”
Q10: 回到起点,用四重表征——宏观、微观、符号、曲线
图,表征氯气与氢气的反应。
宏观:实验现象,直接感知
微观:化学键角度分析能量变化示意图
4/l<0
生成物的 生成物的
电能量 生成物 电能量
反应过程
反应物
反应过程
环节四:四重表征
AH为“+”
吸 收 热 量
生成物
教学环节 情境线 问题线 学生活动 知识线
温故知新 氢气与氯气反应 Q1Q2Q3 小组讨论
反应热定义前提
一探究竟 桥梁 Q4 画微观能量分析图、计算
微观分析能量变 化,反应热定义
新知初上 概念辨析 Q5 Q6 Q7Q8 Q9 思考辨析
焓变及反应热概念学习
四重表征 完善巩固与思辨 Q10 四重表征认知巩固
四重表征具体运用
教学过程五线表
焓变反应热
一、反应热 < 化学反应本质: 旧键断裂 , 新键生成 差值
H (g)+Cl (g)=2HCl (g),△H =-183 KJ/mol
二、焓变 恒压 反应热 反应热=生成物 - 反应物 放热:△H<0 吸热:△H>0 初 1 mo l 完 0 m o l 能量 反应物的 总能量 吸收 热量 A H为“+ 或 △ H>0 生成物的 电能量 反应物 反应过程 吸热反应
板书设计
1mol
0mol
0mol
2mol
生成物
THANKS FOR YOUR
WATCHING
恳请交流指教
1 2 3 4 5
教学过程 板书设计
课标及教 材分析
教学目标 及重难点
学情分析
目录
课标及教材分析
PARTONE
课标分析
4 . 化学反应原理
人类在探索物质变化的历史过程中,积累了许多有关物质变化的知识,加深和发展了对 化学变化的本质认识,人们根据化学反应的规律控制和利用化学反应,不断丰富社会物质 财富,提高人类的生活质量,推动社会的发展。
在本课程模块中,我们将从化学反应与能量、化学反应速率和化学平衡以及溶液中的离 子平衡等方面,探索化学反应的规律及其应用。
通过本课程模块的学习,学生应主要在以下几个方面得到发展:
1.认识化学变化所遵循的基本原理,初步形成关于物质变化的正确观念;
2.了解化学反应中能量转化所遵循的规律,知道化学反应原理在生产、生活和科学研究 中的应用;
3.赞赏运用化学反应原理合成新物质对科学技术和人类社会文明所起的重要作用,能对 生产、生活和自然界中的有关化学变化现象进行合理的解释;
4.增强探索化学反应原理的兴趣,树立学习和研究化学的志向。
课标分析
本章本节本课时
1.了解化学反应中能量转化的原因, 能说出常见的能量转化形式。
2. 通过查阅资料说明能源是人类 生存和发展的重要基础,了解化学 在解决能源危机中的重要作用。知 道节约能源、提高能量利用效率的 实际意义。
3. 能举例说明化学能与热能的相 互转化,了解反应热和焓变的涵义, 能用盖斯定律进行有关反应热的简 单计算。
选修课程
本课时 选修四
本章本节
1. 第一章——化学键
2. 第二章——化学反应与能量
选修4 ——绪论
1. 简化后的有效碰撞模型
2. 活化分子和活化能——反 应 热
承前启后,地位重要
初中
1.燃烧放热
2. 个别反应吸放热
高中— —必修2
教材分析
前
中 宏
微观 解释
焓变反应热
后
章
宏观 感知
章
教材分析
焓变反应热
承前启后,地位重要
后
本章
1. 热化学方程式的书写
2. 燃烧热的计算
3. 化学反应热的计算——盖斯定律
第二章
1. 第四节化学反应方向的判断
高阶化学知识的学习
PARTTW0
学情分析
学情分析
已知 未知
1.个别反应吸放热现象
明显
2. 必修二已知化学能与 热能可以互相转化,有
定性层面认知
3.高中物理中已学到过 相关能量守恒定律的知
识
已 知 未知
迷思概念
1 .不能从定量层面
认识能量转化
2 .不能将化学反应 的本质与能量转化 联系起来
1 焓变和反应热 的含义理解不 到 位 ,焓变和 反应热是热量 变化使得体系 能量变化,但 不能认为焓变 和反应热即为 能量变化。 2 认为化学反应 的焓变就是该 化学反应的反 应热。 反应在恒压条 件下进行时, 反应热等于焓 变
错误理解: 放热反应使 体系温度升 高,吸热反 应降低体系 温度。
吸放热与体 系温度有关, 但不是唯一 决定因素。
4
错误理解:反 应热就是反应 放出或吸收的 热量。
在恒压以及不 作非膨胀功的 情况下,若使 生成物的温度 回到反应物的 起始温度.这 时体系所放出 或吸收的热量 称为反应热
参考文献
[1]陈莉.高中《化学反应原理》迷思概念诊断研究[D].湖南师范大学,2016.
[2]新理念化学教学诊断学[M].北京大学出版社,王后雄,王世存,2014
迷思概念
人
PARTTHREE
三维目标及重难点
情感态度与价值观
(1) 通过复习回顾必修二所学化学键中化学反应的本质,从而从化学键 的角度分析反应热,知道温故知新的重要意义。
(2) 从不同角度分析教材,初中以前对化学反应中能量变化的认知属于 宏观感知,必修二属于能量中宏观,选修四则是微观解释,从而树立知识进阶 系统化观念。
过程与方法
(1)通过对化学反应本质的回顾,从化 学键的角度去分析反应热的计算,学习 科学运用已知(先行组织者)研究未知 的方法。
(2)通过画能量变化图,学习用第四重 表征即图表的形式来演绎化学概念模型。
知识与技能
(1)知道反应中能量转化的原因及几种能量
热
(4) 理解焓变和反应热的含义
(3)能够从定量角度用准确的数值表示反应
转化类型
(2)能够举例说
三维目标及重难点
与热能的相互转化
重点
难点
教学过程
PARTTHRE
本课时教材结构重组
原教材顺序
能量变化图分析
反应热定义及
吸放热判断
反应示例分析
焓变概念
X (1)认知层次不符合学生心理认知的先后顺序
(2)概念同化模式,不符合新课标要求
反应示例分析
引
环节一: 温故知新
反应热定义
探
环节二: 一探究竟
环节四: 析 四重表征
环节三:
新知初上
焓变定义及 吸放热判断
本课时教材结构重组
重组顺序
能量变化图分析
Q1 : 表观感觉,反应是吸热还是放热
Q2 : 若 1mol 氢气和1mol 氯气反应,会放 出多少热 小组讨论怎样做才能最准确得 到放出热量的量
温故知新,从先行组织者出发,符合学生认知顺序,
创设情境,引起认知冲突,引发思考,从而进一步 从定量角度探究热量该如何计算。
方法一:实验室测量
方法二:理论计算 一
H (g)+Cl (g)=2HCl
创设情境,建构问题支架,建构主义理论思想
(回顾氢气与氯气反应的实验, 再次分析实验现象,发现问题)
Omol
如何突破
更准确
(g)
环节—:温故知新
1mol 0mol
1mol
0mol
初 完
通过分析氢气与氯气反应体系环境条件,得出
计算反应热的前提条件:针对某一体系,恒压 条件下,生成物温度回到反应物反应前温度后 本过程放出或者吸收的热量即为反应热。
环节—:温故知新
分析相关变量,培养严谨科学态度 补充 体系与环境
从物理中能量守恒角度去分析,可以把此反应体系看 成一个整体,计算前明确范围,针对这一反应体系。
本体系反应时,敞口,即压强恒定
生成物的温度回到和反应物反应前相同温 度 ,中间过程放出和吸收的热量即为我们 所要计算的结果。
被研究的物质系统统称为
习题,体系以外的其他部 分称为环境。
Q3
体系环境 前提分析
1
2
3
教法:引导
学法:小组讨论
搭建新旧知识的桥梁,有效过渡,从微观层面分析反应热
实现从实验现象的宏观到微观的过渡,突出重点,有效理 解与记忆,从而实现三维目标的统一。
Q4 : 新物质是怎么生成的 (化学反应的本质是 )
H (g)+Cl (g)=2HCl (g) 旧键的断裂和新键的生成
假想的中 间物质 去分析,如果
少巢:,版83KJ/mo
是不是就能够
搭建新旧知识之间的桥梁——化学反应本质
431 kJ/mol H@H@ 能量
环节 :—探究竟
kJ/mol 能量
kJ/mol 能量
H
中
@
键
形
成
键 断裂 键 断裂
HH
@ a
H
中
CI
键
431 kJ/mol 能量
(436
243
形成
环节二:一探究竟
及时检测与评价
总结:
反应热定义:当一个化学反应在恒压以及不作非膨胀功的情况 下发生后,若使生成物的温度回到反应物的起始温度.这时体 系所放出或吸收的热量称为反应热
Q5: 用什么来表示反应热呢
及时检测,利用口头提问的方式对反应热的
定义进行及时巩固,从而突出重点,突破难 点,即对反应热含义的理解。
焓 (H) 是与内能有关的物理量,焓变(△H) 是一个描述系统状
态的状态函数,在恒压条件下,△H 数值上等于恒压反应热。
其中,放热,△H<0, 吸热△H>0
焓变的引出自然顺畅,符合学生认知,将反
应热与焓变分开来,以免学生产生迷思概念 为后面的概念辨析做准备。
Q5: 用什么来表示反应热呢 教法:讲授
H (g)+Cl (g)=2HCl (g),△H =-183 KJ/mol
反应热新表示
焓变△H
环节三:新知初上
小步子原则,以提问判断的方式, 一步步将
概念分解开来,把迷思概念消灭在萌芽中。
Q8: 放热反应使体系温度升高,吸热反应降低体系温度
Q9: 需要加热的反应是吸热反应,放热反应不需要加热
Q6: 焓变就是体系的能量变化
Q7: 反应的焓变就是反应热
及时检测与评价——迷思概念辨析
环节三:新知初上
放热反应 吸热反应
化学反应过程中能量变化示意图
作业:预习热化学方程式书写
符号:方程式书写
曲线:
实现三维目标
四重表征在化学学习中地位重
要,培养学生深刻记忆并且学 会运用。
h能量。ww.teachers 能量
反应物的 反应物 反应物的
总能量 总能量
放 出
热 量
AH 为“ ”
Q10: 回到起点,用四重表征——宏观、微观、符号、曲线
图,表征氯气与氢气的反应。
宏观:实验现象,直接感知
微观:化学键角度分析能量变化示意图
4/l<0
生成物的 生成物的
电能量 生成物 电能量
反应过程
反应物
反应过程
环节四:四重表征
AH为“+”
吸 收 热 量
生成物
教学环节 情境线 问题线 学生活动 知识线
温故知新 氢气与氯气反应 Q1Q2Q3 小组讨论
反应热定义前提
一探究竟 桥梁 Q4 画微观能量分析图、计算
微观分析能量变 化,反应热定义
新知初上 概念辨析 Q5 Q6 Q7Q8 Q9 思考辨析
焓变及反应热概念学习
四重表征 完善巩固与思辨 Q10 四重表征认知巩固
四重表征具体运用
教学过程五线表
焓变反应热
一、反应热 < 化学反应本质: 旧键断裂 , 新键生成 差值
H (g)+Cl (g)=2HCl (g),△H =-183 KJ/mol
二、焓变 恒压 反应热 反应热=生成物 - 反应物 放热:△H<0 吸热:△H>0 初 1 mo l 完 0 m o l 能量 反应物的 总能量 吸收 热量 A H为“+ 或 △ H>0 生成物的 电能量 反应物 反应过程 吸热反应
板书设计
1mol
0mol
0mol
2mol
生成物
THANKS FOR YOUR
WATCHING
恳请交流指教
