6-2-1化学反应的速率(教学课件)-高中化学人教版(2019)必修 第二册(共24张PPT)
文档属性
| 名称 | 6-2-1化学反应的速率(教学课件)-高中化学人教版(2019)必修 第二册(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 17:55:51 | ||
图片预览





文档简介
(共24张PPT)
必修第二册
第六章化学反应与能量
第二节化学反应的速率与限度
第 1 课时化学反应速率
≤t 【课堂引入】
水果腐败变质需数天
(1)Zn+H SO ==ZnSO +H 个
观察产生气泡的快慢
(2)Ba(OH) +H SO ==BaSO ↓+2H O
观察出现沉淀的快慢
(3)Fe ++3SCN-==Fe(SCN)
观察颜色变化的快慢
≤ 【课堂引入】
【思考1】可以通过哪些宏观现象来判断下列化学反应进行的快慢
快和慢是相对而言的,是一种定性的比较。
【课堂引入】
什么是定性 什么是定量
例 如 :我们学过物理都知道:
(1)光的传播速度是很快的;
那么化学上又是如何定量地判断一个化学反应的快慢的呢
(2)光在空气中的传播速度3×108m/s。
定性描述
定量描述
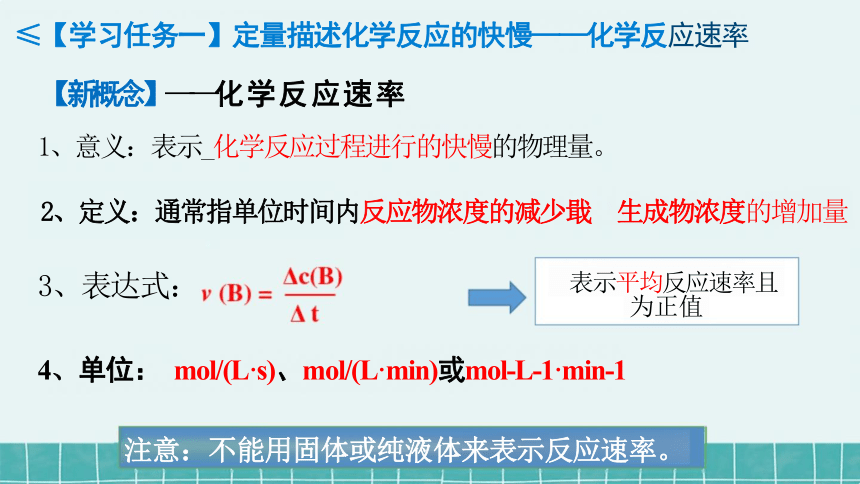
≤【学习任务一】定量描述化学反应的快慢——化学反应速率
【新概念】——化学反应速率
1、意义:表示_化学反应过程进行的快慢的物理量。
2、定义:通常指单位时间内反应物浓度的减少戢 生成物浓度的增加量
3、表达式: 表示平均反应速率且
4、单位: mol/(L·s)、mol/(L·min)或mol-L-1·min-1
注意:不能用固体或纯液体来表示反应速率。
为正值
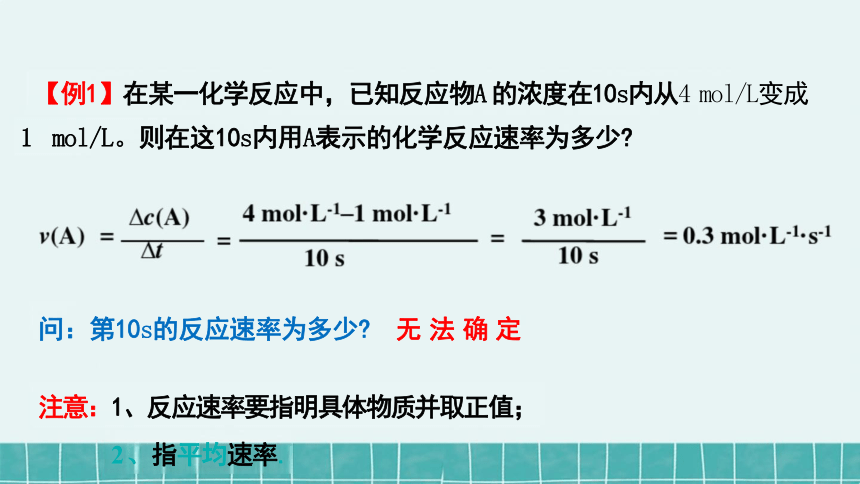
【例1】在某一化学反应中,已知反应物A 的浓度在10s内从4 mol/L变成
1 mol/L。则在这10s内用A表示的化学反应速率为多少
问:第10s的反应速率为多少 无 法 确 定
注意:1、反应速率要指明具体物质并取正值;
2 、指平均速率.
【巩固练习】
1.在某一化学反应中,生成物B的浓度在5s内从0.5m ol/L变成 2.0mol/L, 在这5s内B的化学反应速率为0.3 mol/(L·s) 。
2.一个5L容器中,盛入8.0mol某气体反应物,5min后,测得这 种气体反应物还剩余6.8mol, 这种反应物的化学反应速率为
0.048mol/(L·min) 。
N H
NH
t=0 s 2 mol/L 6 mol/L
0 mol/L
t=2 s
1 mol/L
△c(B)
v(B)
互动探究
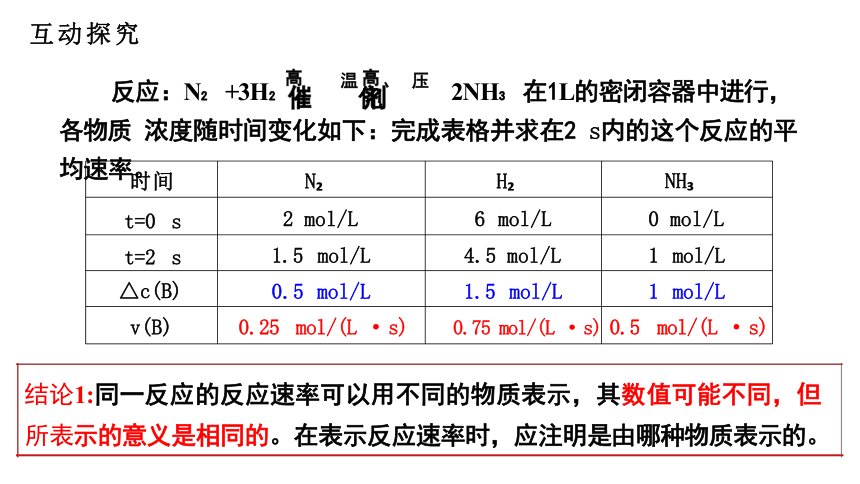
反应:N +3H 温化、 压 2NH 在1L的密闭容器中进行,各物质 浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均速率。
思考1:这个反应用哪种物质表示时其速率最快
思考2:化学反应速率之比与方程式中它们的计量数之比有什么关系
时间 N H
NH
t=0 s 2 mol/L 6 mol/L
0 mol/L
t=2 s 1.5 mol/L 4.5 mol/L
1 mol/L
△c(B) 0.5 mol/L 1.5 mol/L
1 mol/L
v(B) 0.25 mol/(L · s) 0.75 mol/(L · s)
0.5 mol/(L · s)
互动探究
反应:N +3H 温化、 压 2NH 在1L的密闭容器中进行,各物质 浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均速率。
结论1:同一反应的反应速率可以用不同的物质表示,其数值可能不同,但 所表示的意义是相同的。在表示反应速率时,应注明是由哪种物质表示的。
时间 N H
NH
t=0 s 2 mol/L 6 mol/L
0 mol/L
t=2 s 1.5 mol/L 4.5 mol/L
1 mol/L
△c(B) 0.5 mol/L 1.5 mol/L
1 mol/L
v(B) 0.25 mol/(L · s) 0.75 mol/(L · s)
0.5 mol/(L · s)
互动探究
·· 3 n2 温化、 压 2NH 在 1L 的密闭容器中进行,各物质
浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均速率。
3
H
应
应
区
反
思考1:这个反应用哪种物质表示时其速率最快
思考2:化学反应速率之比与方程式中它们的计量数之比有什么关系
时间 N H
NH
t=0 s 2 mol/L 6 mol/L
0 mol/L
t=2 s 1.5 mol/L 4.5 mol/L
1 mol/L
△c(B) 0.5 mol/L 1.5 mol/L
1 mol/L
v(B) 0.25 mol/(L · s) 0.75 mol/(L · s)
0.5 mol/(L · s)
结论2:同一反应中,各物质的反应速率之比等于其化学方程式中的化学计 量数之比。即对于反应:aA+bB=cC+dD VA:Vp:Vc:Vp=a:b:c:d
浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均速率。
2NH 在1L的密闭容器中进行,各物质
反应:N +3H
高温、高压 催化剂
互动探究
【例2】反 应A(g)+3B(g)=2C(g)+2D(g) 在四种不同情况下的反应速率为:
①v(A)=0.45mol-L- min- ②v(B)=0.6mol-L-1.s-1
③v(C)=0.4mol-L-1.s-1 ④v(D)=0.45mol-L-1.s-1
则该反应速率的快慢顺序为( A )
A.④>③=②>① B.②>④>③>①
C.①>②=③>④ D.④>③>②>①
比较同一个化学反应的反应速率的相对大小时,应先转化为 同一物质、同一单位,
然后再比较其数值大小,数值越大表明反应越快。
深化理解
1、化学反应速率指平均速率,不是瞬时速 率。
2、不用固体或纯液体(浓度视为常数)表示化学反应速率。
3、同一反应用不同的物质来表示速率,需要指明具体物质,如v(NO)。
4、同一化学反应:aA+bB=cC+dD,
有v(A):v(B):v(C):v(D)=a:b:c:d
化学反应速率之比=化学计量数之比
思考讨论
对于下列这些反应,我们希望它反应速率快还是慢呢
反应速率可
人为调控
金属生锈
食物变质
业制氨
炼 铁
交流讨论
相同条件下,等质量(金属颗粒大小相当)的金属Na、Mg、AI与
足量同浓度的盐酸反应,反应速率最快的是
反应物本身性质
( 内 因 )主要因素
外界条件
(外因)
不同化学反应
的速率
同一化学反应 的速率
化学与生活
下列反应的速率受到哪些因素的影响
1、加酶洗衣粉的去污能力比普通洗衣粉的要强得多。 催化剂
2、常温下,新鲜牛奶约4h变质,但在冰箱内,鲜奶48h后才变质。温度
3、木炭在氧气中比在空气中燃烧剧烈。 浓度
4、烧火做饭,为什么要将柴劈小 反应物的接触面积
生产生活问题 转化为 化学问题
提出假设
影响化学反应速率的因素可能有:
催化剂、温度、浓度、 反应物的接触面积等
【学习任务二】探究影响化学反应速率的因素
某实验兴趣小组想通过下列现有的用品进行实验,探究有哪些反应条件 会影响化学反应速率
【用品】10%H O 溶液、FeCl 溶液(1mol/L)、MnO 粉末、冷水、热水、试管、 试管夹、烧杯、量筒、胶头滴管
影响因素
实验方案
1. 影响化学反应速率的因素可能有哪些 设计实验方案完成上述表格。
2.实验过程中需要注意什么问题 控制变量
催化剂
实验现象
无
MnO
FeCl
【学习任务二】变量控制法——探究影响化学反应速率的因素
1.催化剂的影响
在三支大小相同的试管中均加入2mL10%H O 溶液,在其中两支 试管分别加入MnO 粉末和2滴1mol/LFeCl 溶液,观察现象并进行对比。
结论1: 其他条件相同时,加入(正)催化剂可以加快化学反应速率
【学习任务二】变量控制法——探究影响化学反应速率的因素
2.反应温度的影响
在两支大小相同的试管中均加入2mL10%H O 溶液,同时滴入2滴 1mol/L FeCl 溶液。待试管中均有适量气泡出现时,将其中一支试管 放入盛有冷水的烧杯中,另一支试管放入盛有热水的烧杯中,观察现 象并进行对比。
不同温度环境
实验现象
冷水
热水
结论2:其它条件相同时,升高温度,化学反应速率增大;反之降低
【学习任务二】变量控制法——探究影响化学反应速率的因素
3.反应物浓度的影响
取两支大小相同的试管,向其中一支试管滴入5mL10%H O 溶液, 另一支试管滴入3mL10%H O 溶液和2mL水,再分别向两只试管中滴 入2滴1mol/L FeCl 溶液,观察现象并进行对比。
不同浓度环境
实验现象
5mL10%H O
3mL10%H O +2mLH O
结论3:其它条件相同时,增大反应物浓度,化学反应速率增大,减小
反应物浓度,化学反应速率减小
结论4:其它条件相同时,有气体参加的反应:
增大压强,相当于增大气态反应物的浓度,化学反应速率增大;
减小压强,相当于减小气态反应物的浓度,化学反应速率减小。
【学习任务二】变量控制法——探究影响化学反应速率的因素
4.压强的影响(气体)
体积一浓度一反应速率
压强
一
【学习任务二】变量控制法——探究影响化学反应速率的因素
思考讨论
已知在密闭容器中发生化学反应:N (g)+O (g)=2NO(g)。分析下列条件的改变 对该反应的化学反应速率的影响。
(1)缩小容器容积使体系压强增大,该反应的反应速率将如何变化 增 大
(2)体积不变,充入氩气,使体系压强增大,该反应的反应速率将如何变化 不 变
(3)压强不变,充入氩气,该反应的反应速率将如何变化 减 小
如果压强的改变不能引起浓度改变,则不会对反应速率产生影响!
1、使用(正)催化剂, 一般能加快反应速率
2、升高温度,化学反应速率增大
3、增大反应物浓度,化学反应速率增大
4、对于有气体参加的反应,增大压强,反 应物浓度增大,反应速率增大
影响化学反应速率的因素
1、内 因 :反应物本身的性质。(主要因素)
2、外因:外界条件, 其他条件不变时
必修第二册
第六章化学反应与能量
第二节化学反应的速率与限度
第 1 课时化学反应速率
≤t 【课堂引入】
水果腐败变质需数天
(1)Zn+H SO ==ZnSO +H 个
观察产生气泡的快慢
(2)Ba(OH) +H SO ==BaSO ↓+2H O
观察出现沉淀的快慢
(3)Fe ++3SCN-==Fe(SCN)
观察颜色变化的快慢
≤ 【课堂引入】
【思考1】可以通过哪些宏观现象来判断下列化学反应进行的快慢
快和慢是相对而言的,是一种定性的比较。
【课堂引入】
什么是定性 什么是定量
例 如 :我们学过物理都知道:
(1)光的传播速度是很快的;
那么化学上又是如何定量地判断一个化学反应的快慢的呢
(2)光在空气中的传播速度3×108m/s。
定性描述
定量描述
≤【学习任务一】定量描述化学反应的快慢——化学反应速率
【新概念】——化学反应速率
1、意义:表示_化学反应过程进行的快慢的物理量。
2、定义:通常指单位时间内反应物浓度的减少戢 生成物浓度的增加量
3、表达式: 表示平均反应速率且
4、单位: mol/(L·s)、mol/(L·min)或mol-L-1·min-1
注意:不能用固体或纯液体来表示反应速率。
为正值
【例1】在某一化学反应中,已知反应物A 的浓度在10s内从4 mol/L变成
1 mol/L。则在这10s内用A表示的化学反应速率为多少
问:第10s的反应速率为多少 无 法 确 定
注意:1、反应速率要指明具体物质并取正值;
2 、指平均速率.
【巩固练习】
1.在某一化学反应中,生成物B的浓度在5s内从0.5m ol/L变成 2.0mol/L, 在这5s内B的化学反应速率为0.3 mol/(L·s) 。
2.一个5L容器中,盛入8.0mol某气体反应物,5min后,测得这 种气体反应物还剩余6.8mol, 这种反应物的化学反应速率为
0.048mol/(L·min) 。
N H
NH
t=0 s 2 mol/L 6 mol/L
0 mol/L
t=2 s
1 mol/L
△c(B)
v(B)
互动探究
反应:N +3H 温化、 压 2NH 在1L的密闭容器中进行,各物质 浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均速率。
思考1:这个反应用哪种物质表示时其速率最快
思考2:化学反应速率之比与方程式中它们的计量数之比有什么关系
时间 N H
NH
t=0 s 2 mol/L 6 mol/L
0 mol/L
t=2 s 1.5 mol/L 4.5 mol/L
1 mol/L
△c(B) 0.5 mol/L 1.5 mol/L
1 mol/L
v(B) 0.25 mol/(L · s) 0.75 mol/(L · s)
0.5 mol/(L · s)
互动探究
反应:N +3H 温化、 压 2NH 在1L的密闭容器中进行,各物质 浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均速率。
结论1:同一反应的反应速率可以用不同的物质表示,其数值可能不同,但 所表示的意义是相同的。在表示反应速率时,应注明是由哪种物质表示的。
时间 N H
NH
t=0 s 2 mol/L 6 mol/L
0 mol/L
t=2 s 1.5 mol/L 4.5 mol/L
1 mol/L
△c(B) 0.5 mol/L 1.5 mol/L
1 mol/L
v(B) 0.25 mol/(L · s) 0.75 mol/(L · s)
0.5 mol/(L · s)
互动探究
·· 3 n2 温化、 压 2NH 在 1L 的密闭容器中进行,各物质
浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均速率。
3
H
应
应
区
反
思考1:这个反应用哪种物质表示时其速率最快
思考2:化学反应速率之比与方程式中它们的计量数之比有什么关系
时间 N H
NH
t=0 s 2 mol/L 6 mol/L
0 mol/L
t=2 s 1.5 mol/L 4.5 mol/L
1 mol/L
△c(B) 0.5 mol/L 1.5 mol/L
1 mol/L
v(B) 0.25 mol/(L · s) 0.75 mol/(L · s)
0.5 mol/(L · s)
结论2:同一反应中,各物质的反应速率之比等于其化学方程式中的化学计 量数之比。即对于反应:aA+bB=cC+dD VA:Vp:Vc:Vp=a:b:c:d
浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均速率。
2NH 在1L的密闭容器中进行,各物质
反应:N +3H
高温、高压 催化剂
互动探究
【例2】反 应A(g)+3B(g)=2C(g)+2D(g) 在四种不同情况下的反应速率为:
①v(A)=0.45mol-L- min- ②v(B)=0.6mol-L-1.s-1
③v(C)=0.4mol-L-1.s-1 ④v(D)=0.45mol-L-1.s-1
则该反应速率的快慢顺序为( A )
A.④>③=②>① B.②>④>③>①
C.①>②=③>④ D.④>③>②>①
比较同一个化学反应的反应速率的相对大小时,应先转化为 同一物质、同一单位,
然后再比较其数值大小,数值越大表明反应越快。
深化理解
1、化学反应速率指平均速率,不是瞬时速 率。
2、不用固体或纯液体(浓度视为常数)表示化学反应速率。
3、同一反应用不同的物质来表示速率,需要指明具体物质,如v(NO)。
4、同一化学反应:aA+bB=cC+dD,
有v(A):v(B):v(C):v(D)=a:b:c:d
化学反应速率之比=化学计量数之比
思考讨论
对于下列这些反应,我们希望它反应速率快还是慢呢
反应速率可
人为调控
金属生锈
食物变质
业制氨
炼 铁
交流讨论
相同条件下,等质量(金属颗粒大小相当)的金属Na、Mg、AI与
足量同浓度的盐酸反应,反应速率最快的是
反应物本身性质
( 内 因 )主要因素
外界条件
(外因)
不同化学反应
的速率
同一化学反应 的速率
化学与生活
下列反应的速率受到哪些因素的影响
1、加酶洗衣粉的去污能力比普通洗衣粉的要强得多。 催化剂
2、常温下,新鲜牛奶约4h变质,但在冰箱内,鲜奶48h后才变质。温度
3、木炭在氧气中比在空气中燃烧剧烈。 浓度
4、烧火做饭,为什么要将柴劈小 反应物的接触面积
生产生活问题 转化为 化学问题
提出假设
影响化学反应速率的因素可能有:
催化剂、温度、浓度、 反应物的接触面积等
【学习任务二】探究影响化学反应速率的因素
某实验兴趣小组想通过下列现有的用品进行实验,探究有哪些反应条件 会影响化学反应速率
【用品】10%H O 溶液、FeCl 溶液(1mol/L)、MnO 粉末、冷水、热水、试管、 试管夹、烧杯、量筒、胶头滴管
影响因素
实验方案
1. 影响化学反应速率的因素可能有哪些 设计实验方案完成上述表格。
2.实验过程中需要注意什么问题 控制变量
催化剂
实验现象
无
MnO
FeCl
【学习任务二】变量控制法——探究影响化学反应速率的因素
1.催化剂的影响
在三支大小相同的试管中均加入2mL10%H O 溶液,在其中两支 试管分别加入MnO 粉末和2滴1mol/LFeCl 溶液,观察现象并进行对比。
结论1: 其他条件相同时,加入(正)催化剂可以加快化学反应速率
【学习任务二】变量控制法——探究影响化学反应速率的因素
2.反应温度的影响
在两支大小相同的试管中均加入2mL10%H O 溶液,同时滴入2滴 1mol/L FeCl 溶液。待试管中均有适量气泡出现时,将其中一支试管 放入盛有冷水的烧杯中,另一支试管放入盛有热水的烧杯中,观察现 象并进行对比。
不同温度环境
实验现象
冷水
热水
结论2:其它条件相同时,升高温度,化学反应速率增大;反之降低
【学习任务二】变量控制法——探究影响化学反应速率的因素
3.反应物浓度的影响
取两支大小相同的试管,向其中一支试管滴入5mL10%H O 溶液, 另一支试管滴入3mL10%H O 溶液和2mL水,再分别向两只试管中滴 入2滴1mol/L FeCl 溶液,观察现象并进行对比。
不同浓度环境
实验现象
5mL10%H O
3mL10%H O +2mLH O
结论3:其它条件相同时,增大反应物浓度,化学反应速率增大,减小
反应物浓度,化学反应速率减小
结论4:其它条件相同时,有气体参加的反应:
增大压强,相当于增大气态反应物的浓度,化学反应速率增大;
减小压强,相当于减小气态反应物的浓度,化学反应速率减小。
【学习任务二】变量控制法——探究影响化学反应速率的因素
4.压强的影响(气体)
体积一浓度一反应速率
压强
一
【学习任务二】变量控制法——探究影响化学反应速率的因素
思考讨论
已知在密闭容器中发生化学反应:N (g)+O (g)=2NO(g)。分析下列条件的改变 对该反应的化学反应速率的影响。
(1)缩小容器容积使体系压强增大,该反应的反应速率将如何变化 增 大
(2)体积不变,充入氩气,使体系压强增大,该反应的反应速率将如何变化 不 变
(3)压强不变,充入氩气,该反应的反应速率将如何变化 减 小
如果压强的改变不能引起浓度改变,则不会对反应速率产生影响!
1、使用(正)催化剂, 一般能加快反应速率
2、升高温度,化学反应速率增大
3、增大反应物浓度,化学反应速率增大
4、对于有气体参加的反应,增大压强,反 应物浓度增大,反应速率增大
影响化学反应速率的因素
1、内 因 :反应物本身的性质。(主要因素)
2、外因:外界条件, 其他条件不变时
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
