分子结构与物质的性质高中化学人教版2019选修第二册公开课(共43张PPT)
文档属性
| 名称 | 分子结构与物质的性质高中化学人教版2019选修第二册公开课(共43张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 00:00:00 | ||
图片预览











文档简介
(共43张PPT)
第二章第三节第2课时
分子间的作用力分子的手性
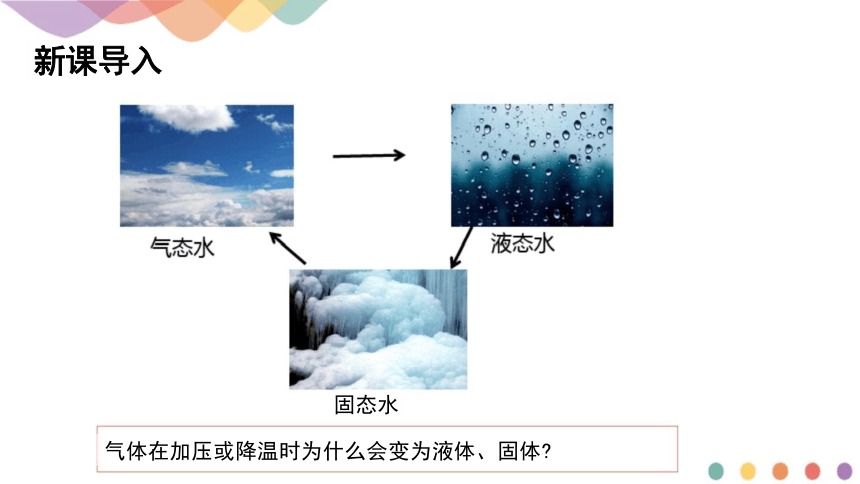
新课导入
固态水
气体在加压或降温时为什么会变为液体、固体
降温加压时气体会液化,降温时液体会凝固,这些事实表明,分子之间存
在着相互作用力
范德华(van der Waals)是最早研究分子间普遍存在作用力的科学家,因 而把这类分子间作用力称为范德华力
范德华力
分子间的作用力
范德华力的特征
①范德华力广泛存在于分子之间,但只有分子间充分接近时才有分子间的相互 作用力
②范德华力很弱 ,比化学键的键能小1~2个数量级
③范德华力没有饱 和性 和方 向性
分子间的作用力
范德华力
一般地,组成和结构相似的分子,相对分子质量越大,范德华力越大。
如范德华力:HCl范德华力
影响范德华力的因素
分子间的作用力
相对分子质量相同或相近时,分子的极性越大 ,范德华力越大。如CO为极性分
子 ,N 为非极性分子,范德华力:CO>N 。
范德华力
影响范德华力的因素
分子间的作用力
组成和结构相似,相对分子质量越大,范德华力越大,物质的熔、沸点越高。
如熔、沸点:F分子间的作用力
范德华力
在同分异构体中, 一般来说,支链数越多,熔、沸点就越低,如沸点:正戊
烷>异戊烷>新戊烷。
分子间的作用力
范德华力
分子间的作用力
范德华力
影响范德华力的因素1.组成和结构相似的分子,相对分子质量越大,范德华力 越大,物质的熔、沸点就越高,如熔、沸点:CFN 。3. 在同分异构体中,一般来说,支链数越多,熔、 沸点就越低,如沸点:正戊烷>异戊烷>新戊烷。
分子间的作用力
范德华力
夏天经常见到许多壁虎在墙壁或天花板上爬却掉不下来,为什么
分子间的作用力
范德华力
夏天经常见到许多壁虎在墙壁或天花板上爬却掉不下来,为什么
壁虎为什么能在天花板土爬行自如 这曾是一个困扰科学家一百多年的谜。 用电子显微镜可观察到,壁虎的四足覆盖着几十万条纤细的由角蛋白构成的 纳米级尺寸的毛。壁虎的足有多大吸力 实验证明,如果在一个分币的面积 土布满100万条壁虎足的细毛,可以吊起20kg重的物体。近年来,有人用计 算机模拟,证明壁虎的足与墙体之间的作用力在本质上是它的细毛与墙体之 间的范德华力。
分子间的作用力
氢键
冰的密度比液体水小
已经与电负性很大的原子形成共价键的氢原子与另一个
电负性很大的原子之间的作用力
当氢原子与电负性大的X 原子以共价键结合时,它们之 间的共用电子对强烈地偏向X, 使H 几乎成为“裸露”的质 子,这样相对显正电性的H 与另一分子中相对显负电性 的X(或Y)中的孤对电子接近并产生相互作用,这种相互 作用称氢键。
分子间的作用力
氢键
氢 键
化学键
水分子
H O
氢键的本质
是静电吸引作用,它比化学键的键能小1~2个数量级。是一种比范德华力 强的分子间作用力。
氢键的特征
·方向性(X-H...Y 尽可能在同一条直线上)
·饱和性(一个X-H 只能和一个Y原子结合)
分子间的作用力
氢键
氢键X—H…Y 键能/(kJ · mol ) 键长/pm
代表性例子
F—H…F 28.1 255
(HF)。
O—H…O 18.8 276
冰
O—H…O 25.9 266
甲醇、乙醇
N—H…F 20.9 268
NH F
N—H…0 20.9 286
CH CONH
N—H…N 5.4 338
NH;
分子间的作用力
氢键
总结氢键的形成与表示
表2-9某些氢键的键能和键长
*氢键键长一般定义为A—H…B的长度,而不是H…B的长度。
氢键的形成条件和表示方法
分子间的作用力
氢键
氢键
氢键的类型
分子间的氢键 分子内的氢键
分子间的作用力
[基础 ·初探]
分子间的作用力
氢键
1.对比对羟基苯甲醛、邻羟基苯甲醛的结构,分析对羟基苯甲醛的熔、沸点高 于邻羟基苯甲酸的熔、沸点的原因。
1.由于邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,
当对羟基苯甲醛熔化时,需要较多的能量克服分子间氢键,所以对羟基苯甲醛 的熔沸点高于邻羟基苯甲醛的熔、沸点。
沸点/℃100 H O
75
50
25
0
-25
-50
-75
PH
-100
siH
-125
CH
4 5 周 期
NH 、H O、HF 的沸点反常的原因: 由于它们各自的分子间形成了氢键。
2.观察下图,分析NH 、H O、HF 的沸点反常的原因。
分子间的作用力
一些氢化物沸点
氢键
H S
As
GaH
Hβ-
-150
HF
常温下液态水中除了含有简单H O外,还含有通
过氢键联系在一起的缔合分子(H O) 、
(H O) …. (H O)。 等。一个水分子的氧原子与另一 个水分子的氢原子沿该氧原子的一个sp3 杂化轨道 的方向形成氢键,因此当所有H O 全部缔合——
分子间的作用力
氢键
解释冰的密度比液态水的密度小的原因。
结冰后,所有的H O 按一定的方向全部形成了氢
键,成为晶体,因此在冰的结构中形成许多空隙, 体积膨胀,密度减小。故冰的体积大于等质量的 水的体积,冰的密度小于水的密度。
接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合形成所谓的
缔合分子。
解释接近水的沸点的水蒸气的相对分子质量测定值比按化学式H O 计算出来的
相对分子质量大一些的原因。
分子间的作用力
氢键
分子间的作用力
氢键
解释氨气分子为什么极易溶于水原因。
NH 与H O 间能形成氢键,且都是极性分子,所以NH 极易溶于水。氨气,低级 醇、醛、酮等分子都与水分子形成氢键,均可溶于水。
邻苯二甲酸的电离平衡常数K (1.1x10-3) 比对苯二甲酸的电离平衡常数K
(2.9x10-4) 大
邻苯二甲酸存在分子内氢键,邻苯二甲酸的电离平衡常数Ka 比对苯二甲酸的电 离平衡常数K 大
分子间的作用力
氢键
>氢键对物质性质的影响(1).对物质熔、沸点的影响
(2).对物质溶解度的影响
(3).对物质密度的影响
(4).氢键对物质电离性质的影响
分子间的作用力
氢键
分子间的作用力
氢键
图2-28 蛋白质分子中的氢键(虚线表示氢键)
图2-29 DNA 双螺旋是通过氢键使它们的碱基(A 和T、C 和C) 相互配对形成的(虚线表示氩键)
分子间的作用力
生物大分子中的氢键
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶
于极性溶剂。例如:蔗糖、氨、水是极性分子,而萘、 碘、四氯化碳是非极性分子。因此蔗糖和氨易溶于水, 难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于 水。
分子间的作用力
相似相溶
图2-30 相似相溶——水和甲醇的相 互溶解(虚线表示氢键)
根据相似相溶规律,NH 是极性分子,易溶于极性溶剂水中;而且NH3 可以和H O 形成分子间氢键,使溶解度更大,所以NH 极易溶于水。而CH 是非极性分子, 难溶于水。
为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水
油漆的主要成分是非极性或极性很小的有机分子,故易溶于非极性或极性很小 的有机溶剂中,如苯、甲苯、乙酸乙酯等,而不溶于水。
比较NH 和CH 在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同
相似相溶
分子间的作用力
在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察
碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一 个试管里继续下面的实验)。在碘水溶液中加入约1 mL四氯化 碳(CCl ), 振荡试管,观察碘被四氯化碳萃取,形成紫红色的 碘的四氯化碳溶液。再向试管里加入1 mL 浓碘化钾(KI) 水溶 液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如 下反应:I +I-=I 。实验表明碘在纯水还是在四氯化碳中溶解性 较好 为什么
分子间的作用力
相似相溶
图2-31 碘在水和四氧化碳中的溶解性
分子间的作用力
相似相溶
碘是非极性分子,所以在极性溶剂水中的溶解度很小,而易溶于非极性溶剂四氯 化碳。我们观察到碘中加水后,碘没有全部溶解,表明碘在水中的溶解度很小。 而在碘水中加人CCl 振荡后,水层颜色明显变浅,而CCl 层呈紫红色,表明碘 在CCl 中溶解度较大,所以使碘从水中萃取到了CC1 中。
碘水中加人浓的KI溶液后,由于发生反应:I +I-=I , 碘生成了无色的I -, 并溶解 到水中,碘的浓度降低,所以溶液紫色变浅。
气体 溶解度/g 气体
溶解度/g
乙炔 0.117 乙烯
0.0149
氨气 52.9 氢气
0.00016
二氧化碳 0.169 甲烷
0.0023
一氧化碳 0.0028 氮气
0.0019
氯气 0.729 氧气
0.0043
乙烷 0.0062 二氧化硫
11.28
分子间的作用力
相似相溶
利用相似相溶原理解释下表数据。
表2-10 气体的溶解度(气体的压强为1.01×10°Pa, 温度为293K, 在100g水中的溶解度)
从“资料卡片”提供的相关数据,我们能发现如下符合“相似相溶”规律的例子:①乙炔、 乙烯、已烷、甲烷、氢气、氮气、氧气都是非极性分子,在水中的溶解度都很小。② SO 和CO 都能和水反应,但SO 是极性分子,CO 是非极性分子,所以SO (11.28 g)比 CO (0.169 g)在水中的溶解度大很多。③氯气也是非极性分子,但氯气能和水反应, 生成物HCI 、HCIO 能溶于水,所以氯气的溶解性比其他非金属单质要好。④NH 分子 能和H O 分子形成分子间氢键,所以NH, 在水中的溶解度很大(52.9 g)。
相似相溶
分子间的作用力
分子间的作用力
相似相溶
乙醇、戊醇都是极性分子,为什么乙醇可以与水任意比例互溶,而戊醇的溶解度小
相似相溶还适用于分子结构的相似性。戊醇
中的烃基较大,其中的—OH 跟水分子的— OH的相似因素小得多了,因而它在水中的 溶解度明显减小。
图2-30 相似相溶——水和甲醇的相 互溶解(虚线表示氢键)
分子间的作用力
相似相溶
影响物质溶解性的因素
> 1.非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
2.外界因素:主要有温度、压强等。 3.氢键:溶剂和溶质之间的氢键作用力越 大,溶解性越好 4.分子结构的相似性:溶质和溶剂的分子结构相似程度越大, 其溶解性越大。如乙醇与水互溶,而戊醇在水中的溶解度明显减小。 5.溶质 是否与水反应:溶质与水发生反应,溶质的溶解度会增大。如SO 与水反应生
成的H SO 可溶于水,故SO 的溶解度增大。
观察下图,图中两只相对的手能否重叠 图中的两个乳酸分子能否重叠
CH CH
C00H C00H
分子手性
C
1 OH
分子间的作用力
H H 一
C
xiW
HO
分子间的作用力
分子的手性
手性异构体具有完全相同的组成和原子排列的 一 对分子,如同左手与右手一样互为镜像,却在三 维空间里不能重叠,互称手性异构体(或对映异构 体)。
>手性分子:具有手性异构体的分子叫做手性分子。
手性原子的判断
具有手性的有机物,是因为其含有手性碳原子造成的。如果一个碳原子所连接 的四个原子或原子团各不相同,那么该碳原子称为手性碳原子。
R 手性碳原子
R C R
R
其 中 ,R 、R 、R 、R 是互不相同的原子或基团。
分子的手性
分子间的作用力
(2)观察有机物分子中是否有手性碳原子,如果有一个手性碳原子,则该有机物分
子就是手性分子,具有手性异构体。含有两个手性碳原子的有机物分子不一定是 手性分子。
手性分子的确定(1)观察实物与其镜像能否重合,如果不能重合,说明是手性分
分子的手性
分子间的作用力
子。如图:
分子间的作用力
分子手性
· 互为手性分子的物质是同一种物质吗 二者具有什么关系
不是同一种物质,二者互为同分异构体。
· 互为手性分子的物质化学性质几乎完全相同,分析其原因。
物质结构决定性质。互为手性分子的物质组成、结 构几乎完全相同,所以其化学性质几乎完全相同。
手性同分异构体(又称对映异构体、光学异构体)的两个分子互为镜像关系,
即分子形式的“左撇子和右撇子”。
构成生命体的有机物绝大多数为手性分子。两个手性分子的性质不同,且手 性有机物中必定含手性碳原子。
分子手性
分子间的作用力
溶解性 相似相溶
分子的手性
课堂小结
范德华力及其对物 质性质的影响
氢键及其对物质性 质的影响
分子间的作用力
范德华力及其对物质性质的影响
氢键及其对物质性质的影响 溶解性 相似相溶
分子间的作用力
分子的手性
本节小结
感 谢 您 的 观 看
第二章第三节第2课时
分子间的作用力分子的手性
新课导入
固态水
气体在加压或降温时为什么会变为液体、固体
降温加压时气体会液化,降温时液体会凝固,这些事实表明,分子之间存
在着相互作用力
范德华(van der Waals)是最早研究分子间普遍存在作用力的科学家,因 而把这类分子间作用力称为范德华力
范德华力
分子间的作用力
范德华力的特征
①范德华力广泛存在于分子之间,但只有分子间充分接近时才有分子间的相互 作用力
②范德华力很弱 ,比化学键的键能小1~2个数量级
③范德华力没有饱 和性 和方 向性
分子间的作用力
范德华力
一般地,组成和结构相似的分子,相对分子质量越大,范德华力越大。
如范德华力:HCl
影响范德华力的因素
分子间的作用力
相对分子质量相同或相近时,分子的极性越大 ,范德华力越大。如CO为极性分
子 ,N 为非极性分子,范德华力:CO>N 。
范德华力
影响范德华力的因素
分子间的作用力
组成和结构相似,相对分子质量越大,范德华力越大,物质的熔、沸点越高。
如熔、沸点:F
范德华力
在同分异构体中, 一般来说,支链数越多,熔、沸点就越低,如沸点:正戊
烷>异戊烷>新戊烷。
分子间的作用力
范德华力
分子间的作用力
范德华力
影响范德华力的因素1.组成和结构相似的分子,相对分子质量越大,范德华力 越大,物质的熔、沸点就越高,如熔、沸点:CF
分子间的作用力
范德华力
夏天经常见到许多壁虎在墙壁或天花板上爬却掉不下来,为什么
分子间的作用力
范德华力
夏天经常见到许多壁虎在墙壁或天花板上爬却掉不下来,为什么
壁虎为什么能在天花板土爬行自如 这曾是一个困扰科学家一百多年的谜。 用电子显微镜可观察到,壁虎的四足覆盖着几十万条纤细的由角蛋白构成的 纳米级尺寸的毛。壁虎的足有多大吸力 实验证明,如果在一个分币的面积 土布满100万条壁虎足的细毛,可以吊起20kg重的物体。近年来,有人用计 算机模拟,证明壁虎的足与墙体之间的作用力在本质上是它的细毛与墙体之 间的范德华力。
分子间的作用力
氢键
冰的密度比液体水小
已经与电负性很大的原子形成共价键的氢原子与另一个
电负性很大的原子之间的作用力
当氢原子与电负性大的X 原子以共价键结合时,它们之 间的共用电子对强烈地偏向X, 使H 几乎成为“裸露”的质 子,这样相对显正电性的H 与另一分子中相对显负电性 的X(或Y)中的孤对电子接近并产生相互作用,这种相互 作用称氢键。
分子间的作用力
氢键
氢 键
化学键
水分子
H O
氢键的本质
是静电吸引作用,它比化学键的键能小1~2个数量级。是一种比范德华力 强的分子间作用力。
氢键的特征
·方向性(X-H...Y 尽可能在同一条直线上)
·饱和性(一个X-H 只能和一个Y原子结合)
分子间的作用力
氢键
氢键X—H…Y 键能/(kJ · mol ) 键长/pm
代表性例子
F—H…F 28.1 255
(HF)。
O—H…O 18.8 276
冰
O—H…O 25.9 266
甲醇、乙醇
N—H…F 20.9 268
NH F
N—H…0 20.9 286
CH CONH
N—H…N 5.4 338
NH;
分子间的作用力
氢键
总结氢键的形成与表示
表2-9某些氢键的键能和键长
*氢键键长一般定义为A—H…B的长度,而不是H…B的长度。
氢键的形成条件和表示方法
分子间的作用力
氢键
氢键
氢键的类型
分子间的氢键 分子内的氢键
分子间的作用力
[基础 ·初探]
分子间的作用力
氢键
1.对比对羟基苯甲醛、邻羟基苯甲醛的结构,分析对羟基苯甲醛的熔、沸点高 于邻羟基苯甲酸的熔、沸点的原因。
1.由于邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,
当对羟基苯甲醛熔化时,需要较多的能量克服分子间氢键,所以对羟基苯甲醛 的熔沸点高于邻羟基苯甲醛的熔、沸点。
沸点/℃100 H O
75
50
25
0
-25
-50
-75
PH
-100
siH
-125
CH
4 5 周 期
NH 、H O、HF 的沸点反常的原因: 由于它们各自的分子间形成了氢键。
2.观察下图,分析NH 、H O、HF 的沸点反常的原因。
分子间的作用力
一些氢化物沸点
氢键
H S
As
GaH
Hβ-
-150
HF
常温下液态水中除了含有简单H O外,还含有通
过氢键联系在一起的缔合分子(H O) 、
(H O) …. (H O)。 等。一个水分子的氧原子与另一 个水分子的氢原子沿该氧原子的一个sp3 杂化轨道 的方向形成氢键,因此当所有H O 全部缔合——
分子间的作用力
氢键
解释冰的密度比液态水的密度小的原因。
结冰后,所有的H O 按一定的方向全部形成了氢
键,成为晶体,因此在冰的结构中形成许多空隙, 体积膨胀,密度减小。故冰的体积大于等质量的 水的体积,冰的密度小于水的密度。
接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合形成所谓的
缔合分子。
解释接近水的沸点的水蒸气的相对分子质量测定值比按化学式H O 计算出来的
相对分子质量大一些的原因。
分子间的作用力
氢键
分子间的作用力
氢键
解释氨气分子为什么极易溶于水原因。
NH 与H O 间能形成氢键,且都是极性分子,所以NH 极易溶于水。氨气,低级 醇、醛、酮等分子都与水分子形成氢键,均可溶于水。
邻苯二甲酸的电离平衡常数K (1.1x10-3) 比对苯二甲酸的电离平衡常数K
(2.9x10-4) 大
邻苯二甲酸存在分子内氢键,邻苯二甲酸的电离平衡常数Ka 比对苯二甲酸的电 离平衡常数K 大
分子间的作用力
氢键
>氢键对物质性质的影响(1).对物质熔、沸点的影响
(2).对物质溶解度的影响
(3).对物质密度的影响
(4).氢键对物质电离性质的影响
分子间的作用力
氢键
分子间的作用力
氢键
图2-28 蛋白质分子中的氢键(虚线表示氢键)
图2-29 DNA 双螺旋是通过氢键使它们的碱基(A 和T、C 和C) 相互配对形成的(虚线表示氩键)
分子间的作用力
生物大分子中的氢键
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶
于极性溶剂。例如:蔗糖、氨、水是极性分子,而萘、 碘、四氯化碳是非极性分子。因此蔗糖和氨易溶于水, 难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于 水。
分子间的作用力
相似相溶
图2-30 相似相溶——水和甲醇的相 互溶解(虚线表示氢键)
根据相似相溶规律,NH 是极性分子,易溶于极性溶剂水中;而且NH3 可以和H O 形成分子间氢键,使溶解度更大,所以NH 极易溶于水。而CH 是非极性分子, 难溶于水。
为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水
油漆的主要成分是非极性或极性很小的有机分子,故易溶于非极性或极性很小 的有机溶剂中,如苯、甲苯、乙酸乙酯等,而不溶于水。
比较NH 和CH 在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同
相似相溶
分子间的作用力
在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察
碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一 个试管里继续下面的实验)。在碘水溶液中加入约1 mL四氯化 碳(CCl ), 振荡试管,观察碘被四氯化碳萃取,形成紫红色的 碘的四氯化碳溶液。再向试管里加入1 mL 浓碘化钾(KI) 水溶 液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如 下反应:I +I-=I 。实验表明碘在纯水还是在四氯化碳中溶解性 较好 为什么
分子间的作用力
相似相溶
图2-31 碘在水和四氧化碳中的溶解性
分子间的作用力
相似相溶
碘是非极性分子,所以在极性溶剂水中的溶解度很小,而易溶于非极性溶剂四氯 化碳。我们观察到碘中加水后,碘没有全部溶解,表明碘在水中的溶解度很小。 而在碘水中加人CCl 振荡后,水层颜色明显变浅,而CCl 层呈紫红色,表明碘 在CCl 中溶解度较大,所以使碘从水中萃取到了CC1 中。
碘水中加人浓的KI溶液后,由于发生反应:I +I-=I , 碘生成了无色的I -, 并溶解 到水中,碘的浓度降低,所以溶液紫色变浅。
气体 溶解度/g 气体
溶解度/g
乙炔 0.117 乙烯
0.0149
氨气 52.9 氢气
0.00016
二氧化碳 0.169 甲烷
0.0023
一氧化碳 0.0028 氮气
0.0019
氯气 0.729 氧气
0.0043
乙烷 0.0062 二氧化硫
11.28
分子间的作用力
相似相溶
利用相似相溶原理解释下表数据。
表2-10 气体的溶解度(气体的压强为1.01×10°Pa, 温度为293K, 在100g水中的溶解度)
从“资料卡片”提供的相关数据,我们能发现如下符合“相似相溶”规律的例子:①乙炔、 乙烯、已烷、甲烷、氢气、氮气、氧气都是非极性分子,在水中的溶解度都很小。② SO 和CO 都能和水反应,但SO 是极性分子,CO 是非极性分子,所以SO (11.28 g)比 CO (0.169 g)在水中的溶解度大很多。③氯气也是非极性分子,但氯气能和水反应, 生成物HCI 、HCIO 能溶于水,所以氯气的溶解性比其他非金属单质要好。④NH 分子 能和H O 分子形成分子间氢键,所以NH, 在水中的溶解度很大(52.9 g)。
相似相溶
分子间的作用力
分子间的作用力
相似相溶
乙醇、戊醇都是极性分子,为什么乙醇可以与水任意比例互溶,而戊醇的溶解度小
相似相溶还适用于分子结构的相似性。戊醇
中的烃基较大,其中的—OH 跟水分子的— OH的相似因素小得多了,因而它在水中的 溶解度明显减小。
图2-30 相似相溶——水和甲醇的相 互溶解(虚线表示氢键)
分子间的作用力
相似相溶
影响物质溶解性的因素
> 1.非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
2.外界因素:主要有温度、压强等。 3.氢键:溶剂和溶质之间的氢键作用力越 大,溶解性越好 4.分子结构的相似性:溶质和溶剂的分子结构相似程度越大, 其溶解性越大。如乙醇与水互溶,而戊醇在水中的溶解度明显减小。 5.溶质 是否与水反应:溶质与水发生反应,溶质的溶解度会增大。如SO 与水反应生
成的H SO 可溶于水,故SO 的溶解度增大。
观察下图,图中两只相对的手能否重叠 图中的两个乳酸分子能否重叠
CH CH
C00H C00H
分子手性
C
1 OH
分子间的作用力
H H 一
C
xiW
HO
分子间的作用力
分子的手性
手性异构体具有完全相同的组成和原子排列的 一 对分子,如同左手与右手一样互为镜像,却在三 维空间里不能重叠,互称手性异构体(或对映异构 体)。
>手性分子:具有手性异构体的分子叫做手性分子。
手性原子的判断
具有手性的有机物,是因为其含有手性碳原子造成的。如果一个碳原子所连接 的四个原子或原子团各不相同,那么该碳原子称为手性碳原子。
R 手性碳原子
R C R
R
其 中 ,R 、R 、R 、R 是互不相同的原子或基团。
分子的手性
分子间的作用力
(2)观察有机物分子中是否有手性碳原子,如果有一个手性碳原子,则该有机物分
子就是手性分子,具有手性异构体。含有两个手性碳原子的有机物分子不一定是 手性分子。
手性分子的确定(1)观察实物与其镜像能否重合,如果不能重合,说明是手性分
分子的手性
分子间的作用力
子。如图:
分子间的作用力
分子手性
· 互为手性分子的物质是同一种物质吗 二者具有什么关系
不是同一种物质,二者互为同分异构体。
· 互为手性分子的物质化学性质几乎完全相同,分析其原因。
物质结构决定性质。互为手性分子的物质组成、结 构几乎完全相同,所以其化学性质几乎完全相同。
手性同分异构体(又称对映异构体、光学异构体)的两个分子互为镜像关系,
即分子形式的“左撇子和右撇子”。
构成生命体的有机物绝大多数为手性分子。两个手性分子的性质不同,且手 性有机物中必定含手性碳原子。
分子手性
分子间的作用力
溶解性 相似相溶
分子的手性
课堂小结
范德华力及其对物 质性质的影响
氢键及其对物质性 质的影响
分子间的作用力
范德华力及其对物质性质的影响
氢键及其对物质性质的影响 溶解性 相似相溶
分子间的作用力
分子的手性
本节小结
感 谢 您 的 观 看
