2-4 化学反应的调控(教学课件)--高中化学人教版(2019)选择性必修1(共27张PPT)
文档属性
| 名称 | 2-4 化学反应的调控(教学课件)--高中化学人教版(2019)选择性必修1(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 17:57:34 | ||
图片预览






文档简介
(共27张PPT)
化学反应的调控
人教版化学选择性必修1第二章 第四节
合成氨的提出
氮短缺事关人类的存亡,某一天将会有一位化学家寻找出 一种方法,将成对的氮原子间三键打破,制出一种能为植 物吸收的氮的化合物。
——威廉 · 克鲁克斯
先合成氨,再进一步将之转化为铵盐或者硝酸盐,变成了 土壤可吸收的形式。最好的原料是空气,因为它其中富含 氮元素。
卡尔博施
合成氨很难!
合成氨存在的问题
化学反应速率
调控外界条件:
温度、浓度、压强、催化剂
化学反应的调控
化学平衡
N (g)+3H (g)—2NH (g)△H=-92.4 kJ·mol-1
1903年:哈伯发现在常温的条件下,氮、氢难以生成氨,在
高温的条件下,氨太易于分解。在1000摄氏度时,合成氨只
占到混合气体的0.01,根本没有意义。
升高温度对反应有什么影响
哈伯法合成氨
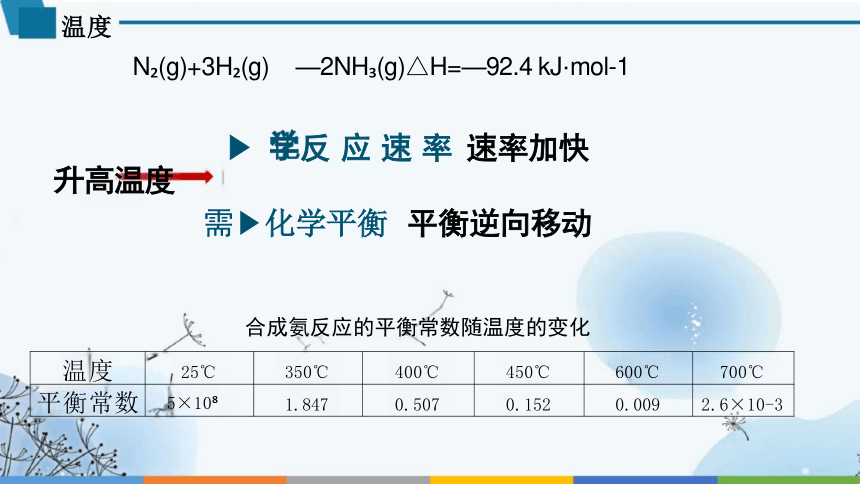
温度
N (g)+3H (g) —2NH (g)△H=—92.4 kJ·mol-1
反 应 速 率 速率加快 升高温度
需 化学平衡 平衡逆向移动
合成氨反应的平衡常数随温度的变化
温度 25℃ 350℃ 400℃ 450℃ 600℃
700℃
平衡常数 5×10 1.847 0.507 0.152 0.009
2.6×10-3
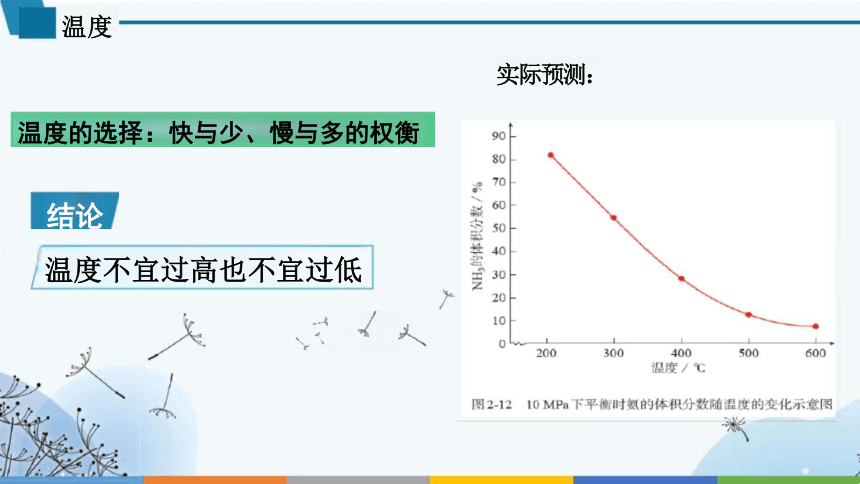
温度的选择:快与少、慢与多的权衡
温度不宜过高也不宜过低
温度
结论
实际预测:
1908年:
哈伯成功地设计出一套精密的高压装置。罗塞格尔和他实验室的机 械师们一起创造了新的阀门,将哈伯的设计变成了现实。
增大压强对反应有什么影响
出 水 口
干燥室
压 缩N 和 H 进 口
反应器
进水口
哈伯法合成氨
冷却室
未反应气 体通过循 环泵返回
液 态NH 出 口
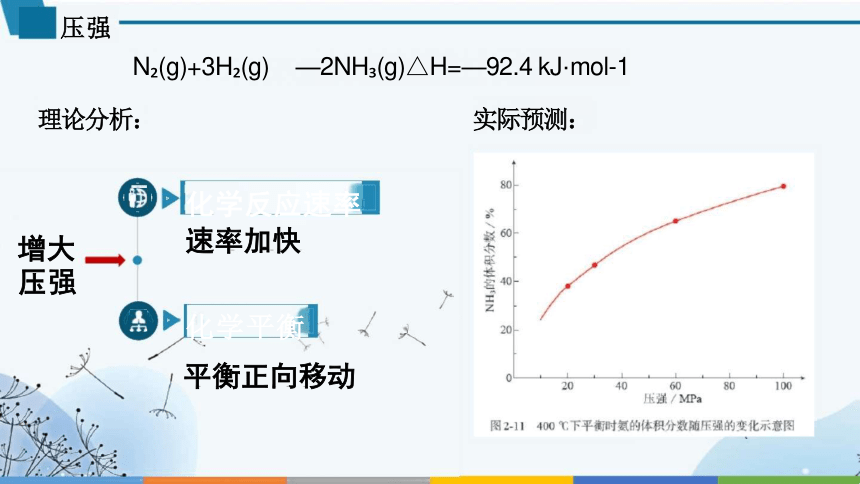
压强
N (g)+3H (g) —2NH (g)△H=—92.4 kJ·mol-1
理论分析: 实际预测:
化学反应速率
速率加快
化学平衡
平衡正向移动
增大 压强
压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,
这会加大生产投资,可能降低综合经济效益。
压强的选择—成本与效益的博弈
压强不宜过高也不宜过低
压强
结论
催化剂
N (g)+3H (g)= 2NH (g) △H=—92.4
kJ·mol-1
合成氨仍然存在的问题
化学反应速率
显著改变反应速率
化学平衡
平衡不移动
加入催化剂
催化剂
铁 效果不够理想
锇 效果好,但储量极少
铀 铀价格昂贵,性质过于敏感
含铅镁的铁 效果好,原料易得,性质稳定
催化剂
N (g)+3H (g)—2NH (g)△H=—92.4 kJ·mol-1
2007年 Ertl1 证实了N 与 H 在催化剂表面合成氨的反应历程如图所示。
扩散→吸附→表面反应→脱附→扩散。
合成氨的研究历程
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究 团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降 到了350℃、1 MPa。
更加节能、降低成本
合成氨的研究历程
温度不宜过高也不宜过低
压强不宜过高也不宜过低
加入含铅镁的铁做催化剂
反应 500℃左右
速率
转化率 →降低温度
温度
催化剂
温度
义已知:合成氨的催化剂在500℃左右时活性最大
数据分析
数据分析
温度/℃ 氨的含量/%
0.1MPa 10MPa 20MPa 30MPa 60MPa
100MPa
200 15.3 81.5 86.4 89.9 95.4
98.8
300 2.20 52.0 64.2 71.0 84.2
92.6
400 0.40 25.1 38.2 47.0 65.2
79.8
500 0.10 10.6 义19.1 26.4 42.2
57.5
600 0.05 4.50 9.10 13.8 23.1
31.4
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)
数据分析
浓度
N (g)+3H (g)—2NH (g)△H=—92.4 kJ·mol-1
增大反应物浓度
降低生成物浓度
化学平衡
平衡正向移动
及时补充N2 和H
将氨气及时从气态混合物中分离出去
增大反应物 浓度
降低生成物 的浓度
原料气循
环利用
还有什么办法可以提高氨的产率
原料气循环通过合成塔
浓度
浓度
· 铁触媒催化剂
·400~500℃
· 10MPa~30MPa
· 原料气循环利用 及时分离出氨气
义
液态NH NH +N +H
N +H
铁触媒 400~500℃
合成氨常用的生产条件
压缩机
加压
10~30 MPa
热交换 N +H NwWWwWw
干燥 N +H 净化
冷却
N +H
N +H
解决实际问题-
在硫酸工业中,通过下列反应使SO 氧化为SO :
2SO (g)+O (g)=2SO (g)△H=-92.4kJ mol-1。下表列出了在不同温度和压强下,
反应达到平衡时SO 的转化率。
温度/℃ 平衡时SO 的转化率/%
0.1MPa 0.5MPa 1MPa 5MPa
10MPa
450 97.5 98.9 99.2 99.6
99.7
550 85.6 92.9 94.9 97.7
98.3
(1)从理论分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是_____。
(2)在实际生产中,选定的温度为400~500℃, 原因是_
,(3)在实际生产中,采用的压强为常压,原因是_
4) 在实际生产中,通入过量的空气,原因是
解决实际问题-
(5)工业上采用接触法制备硫酸,V O 做催化剂,有人提出如下反应历程:
反应I:2SO +V O =SO +V O ( 较慢)
反应Ⅱ:2SO +V O =SO +V O ( 较 快 )
由此推知,活化能较大的是反应 (填“I”或“II”)。
(6)尾气中的SO 必须回收,原因是
化学平衡
反应速率
设备可行
成本核算
“绿色化学” 可持续发展
原理分析
实践层面
思想理念
化工生产中调控反应的一般思路 ·
化学反应
1.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大
满足了当时日益增长的人口对粮食的需求。下列所示是哈伯法的流程图,
其中为提高原料转化率而采取的措施是
A.①②③ B. ②④⑤
—2NH (g)△H=—92.4 kJ·mol-1
D.②③
义
②加压 N 、H (2×107
Pa)
③催化
反应
(500℃、 催化剂)
,N (g)+3H (g)
随堂练习
C.①③⑤
①净化
干燥
④液化
分离
⑤N 和H 再循环
N
H
NH
2.据报道,在300 ℃、70 MPa 下由二氧化碳和氢气合成乙醇已成为现实:
2CO (g)+6H (g)=CH CH OH(g)+3H O(g), 下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
-B.反应需在300℃下进行可推测该反应是吸热反应
C.充入大量CO 气体可提高H 的转化率
D.从平衡混合气体中分离出CH CH OH和H O可提高CO 和H 的利用率
随堂练习
随堂练习
3.某温度下,对于反应:N (g)+3H (g)÷2NH (g)△H=-92.4 kJ ·mol-1 N 的平衡转化率(a)与体系总压强(p)的关系如图所示。下列说法正确的是 A.将1 mol 氮气、3 mol氢气置于1 L 密闭容器中发生反应,放出的热量为
92.4 kJ
v. 平衡状态由A 变为B 时,平衡常数K(A)C.上述反应在达到平衡后,增大压强,H 的
转化率增大
D.升高温度,平衡常数K增大
30%
20%
3 IPa
α(N ) 个
B
化学反应的调控
人教版化学选择性必修1第二章 第四节
合成氨的提出
氮短缺事关人类的存亡,某一天将会有一位化学家寻找出 一种方法,将成对的氮原子间三键打破,制出一种能为植 物吸收的氮的化合物。
——威廉 · 克鲁克斯
先合成氨,再进一步将之转化为铵盐或者硝酸盐,变成了 土壤可吸收的形式。最好的原料是空气,因为它其中富含 氮元素。
卡尔博施
合成氨很难!
合成氨存在的问题
化学反应速率
调控外界条件:
温度、浓度、压强、催化剂
化学反应的调控
化学平衡
N (g)+3H (g)—2NH (g)△H=-92.4 kJ·mol-1
1903年:哈伯发现在常温的条件下,氮、氢难以生成氨,在
高温的条件下,氨太易于分解。在1000摄氏度时,合成氨只
占到混合气体的0.01,根本没有意义。
升高温度对反应有什么影响
哈伯法合成氨
温度
N (g)+3H (g) —2NH (g)△H=—92.4 kJ·mol-1
反 应 速 率 速率加快 升高温度
需 化学平衡 平衡逆向移动
合成氨反应的平衡常数随温度的变化
温度 25℃ 350℃ 400℃ 450℃ 600℃
700℃
平衡常数 5×10 1.847 0.507 0.152 0.009
2.6×10-3
温度的选择:快与少、慢与多的权衡
温度不宜过高也不宜过低
温度
结论
实际预测:
1908年:
哈伯成功地设计出一套精密的高压装置。罗塞格尔和他实验室的机 械师们一起创造了新的阀门,将哈伯的设计变成了现实。
增大压强对反应有什么影响
出 水 口
干燥室
压 缩N 和 H 进 口
反应器
进水口
哈伯法合成氨
冷却室
未反应气 体通过循 环泵返回
液 态NH 出 口
压强
N (g)+3H (g) —2NH (g)△H=—92.4 kJ·mol-1
理论分析: 实际预测:
化学反应速率
速率加快
化学平衡
平衡正向移动
增大 压强
压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,
这会加大生产投资,可能降低综合经济效益。
压强的选择—成本与效益的博弈
压强不宜过高也不宜过低
压强
结论
催化剂
N (g)+3H (g)= 2NH (g) △H=—92.4
kJ·mol-1
合成氨仍然存在的问题
化学反应速率
显著改变反应速率
化学平衡
平衡不移动
加入催化剂
催化剂
铁 效果不够理想
锇 效果好,但储量极少
铀 铀价格昂贵,性质过于敏感
含铅镁的铁 效果好,原料易得,性质稳定
催化剂
N (g)+3H (g)—2NH (g)△H=—92.4 kJ·mol-1
2007年 Ertl1 证实了N 与 H 在催化剂表面合成氨的反应历程如图所示。
扩散→吸附→表面反应→脱附→扩散。
合成氨的研究历程
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究 团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降 到了350℃、1 MPa。
更加节能、降低成本
合成氨的研究历程
温度不宜过高也不宜过低
压强不宜过高也不宜过低
加入含铅镁的铁做催化剂
反应 500℃左右
速率
转化率 →降低温度
温度
催化剂
温度
义已知:合成氨的催化剂在500℃左右时活性最大
数据分析
数据分析
温度/℃ 氨的含量/%
0.1MPa 10MPa 20MPa 30MPa 60MPa
100MPa
200 15.3 81.5 86.4 89.9 95.4
98.8
300 2.20 52.0 64.2 71.0 84.2
92.6
400 0.40 25.1 38.2 47.0 65.2
79.8
500 0.10 10.6 义19.1 26.4 42.2
57.5
600 0.05 4.50 9.10 13.8 23.1
31.4
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)
数据分析
浓度
N (g)+3H (g)—2NH (g)△H=—92.4 kJ·mol-1
增大反应物浓度
降低生成物浓度
化学平衡
平衡正向移动
及时补充N2 和H
将氨气及时从气态混合物中分离出去
增大反应物 浓度
降低生成物 的浓度
原料气循
环利用
还有什么办法可以提高氨的产率
原料气循环通过合成塔
浓度
浓度
· 铁触媒催化剂
·400~500℃
· 10MPa~30MPa
· 原料气循环利用 及时分离出氨气
义
液态NH NH +N +H
N +H
铁触媒 400~500℃
合成氨常用的生产条件
压缩机
加压
10~30 MPa
热交换 N +H NwWWwWw
干燥 N +H 净化
冷却
N +H
N +H
解决实际问题-
在硫酸工业中,通过下列反应使SO 氧化为SO :
2SO (g)+O (g)=2SO (g)△H=-92.4kJ mol-1。下表列出了在不同温度和压强下,
反应达到平衡时SO 的转化率。
温度/℃ 平衡时SO 的转化率/%
0.1MPa 0.5MPa 1MPa 5MPa
10MPa
450 97.5 98.9 99.2 99.6
99.7
550 85.6 92.9 94.9 97.7
98.3
(1)从理论分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是_____。
(2)在实际生产中,选定的温度为400~500℃, 原因是_
,(3)在实际生产中,采用的压强为常压,原因是_
4) 在实际生产中,通入过量的空气,原因是
解决实际问题-
(5)工业上采用接触法制备硫酸,V O 做催化剂,有人提出如下反应历程:
反应I:2SO +V O =SO +V O ( 较慢)
反应Ⅱ:2SO +V O =SO +V O ( 较 快 )
由此推知,活化能较大的是反应 (填“I”或“II”)。
(6)尾气中的SO 必须回收,原因是
化学平衡
反应速率
设备可行
成本核算
“绿色化学” 可持续发展
原理分析
实践层面
思想理念
化工生产中调控反应的一般思路 ·
化学反应
1.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大
满足了当时日益增长的人口对粮食的需求。下列所示是哈伯法的流程图,
其中为提高原料转化率而采取的措施是
A.①②③ B. ②④⑤
—2NH (g)△H=—92.4 kJ·mol-1
D.②③
义
②加压 N 、H (2×107
Pa)
③催化
反应
(500℃、 催化剂)
,N (g)+3H (g)
随堂练习
C.①③⑤
①净化
干燥
④液化
分离
⑤N 和H 再循环
N
H
NH
2.据报道,在300 ℃、70 MPa 下由二氧化碳和氢气合成乙醇已成为现实:
2CO (g)+6H (g)=CH CH OH(g)+3H O(g), 下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
-B.反应需在300℃下进行可推测该反应是吸热反应
C.充入大量CO 气体可提高H 的转化率
D.从平衡混合气体中分离出CH CH OH和H O可提高CO 和H 的利用率
随堂练习
随堂练习
3.某温度下,对于反应:N (g)+3H (g)÷2NH (g)△H=-92.4 kJ ·mol-1 N 的平衡转化率(a)与体系总压强(p)的关系如图所示。下列说法正确的是 A.将1 mol 氮气、3 mol氢气置于1 L 密闭容器中发生反应,放出的热量为
92.4 kJ
v. 平衡状态由A 变为B 时,平衡常数K(A)
转化率增大
D.升高温度,平衡常数K增大
30%
20%
3 IPa
α(N ) 个
B
