高二下学期化学人教版(2019)选择性必修2 第二章 分子结构与性质 教材分析(共36张PPT)
文档属性
| 名称 | 高二下学期化学人教版(2019)选择性必修2 第二章 分子结构与性质 教材分析(共36张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 00:00:00 | ||
图片预览










文档简介
(共36张PPT)
人教版高中化学选择性必修2
第二章分子结构与性质教材分析
01 無 课程标准
02 以 地位和作用
03 教学内容
04 新版教材的变化
05 膏 教学策略和建议
目 录
模块2物质结构与性质
本课程模块将从原子、分子水平上认识物 质构成的规律,以微粒之间不同的作用力为线 索,侧重研究不同类型物质的有关性质,进一 步丰富学生物质结构的知识,提高学生分析问 题和解决问题的能力。
通过本课程模块的学习,提升学生有关物 质结构的基本认识,深入认识物质的结构与性 质之间的关系,发展化学学科核心素养。
宏观辨识与微观探析 证据推理与模型认知
普通高中
化学课程标准
(2 017年版)
中犟人民共和国教言外到定
化学课程标准(2017年版)
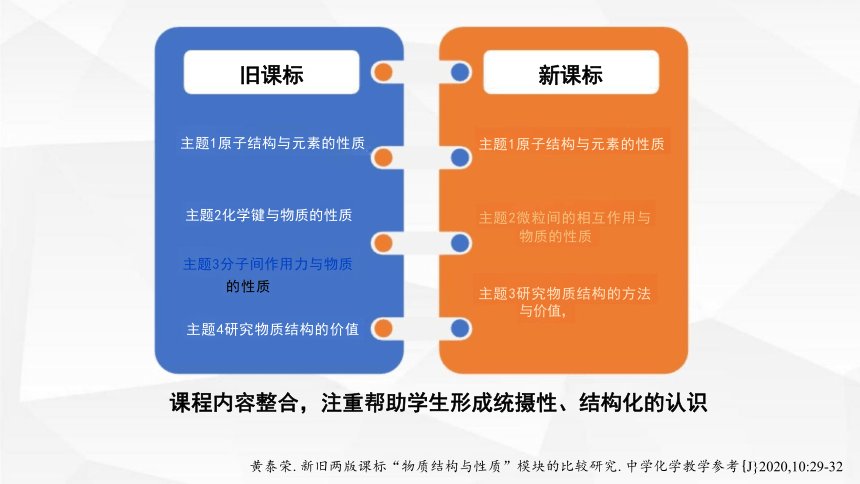
课程内容整合,注重帮助学生形成统摄性、结构化的认识
黄泰荣.新旧两版课标“物质结构与性质”模块的比较研究.中学化学教学参考{J}2020,10:29-32
主题1原子结构与元素的性质
主题2化学键与物质的性质
主题3分子间作用力与物质
的性质
主题4研究物质结构的价值
主题1原子结构与元素的性质
主题2微粒间的相互作用与 物质的性质
主题3研究物质结构的方法 与价值,
旧课标 新课标
以 二 教 学 内
容
教学内容
本章对共价键、分子的空间结构、分子的结构对物质性质的影响等内容进行深入的探讨。
共价键
分子结构
分子的空间结构
共价键的极性
分子性质
分子结构与性质
1.能说出共价键的主要类型、特征与区别,能利用键参数解释物质的 某些性质
2.能根据给定的信息分析常见简单分子的空间结构,能利用价层电子 对互斥模型和杂化轨道理论,预测和解释简单的共价分子的空间结构
3.能利用电负性判断共价键的极性,能根据共价分子的结构特点说明 简单分子的某些性质,能说明分子间作用力(含氢键)对物质熔点、 沸点等性质的影响,能列举含有氢键的物质及其性质特点,知道氢键 对于生命的重大意义
4.能根据键的极性和分子结构特点来判断分子的极性,并据此对分子 的一些典型性质及其应用作出解释
学业要求
2020年 2019年
2018年
全国卷I 未成对电子敢 电离能 空间构型,价属电子对取,杂化方式 品胞中LF PO,单元数、 Li -,FePO,中x求算 电离能 杂化方式 配位键的形成及物定性 分子品体、离子品体熔点差异 原子问的正离及品体密度计算
基态、激发态L原子能量比较
离子半径比较及原因
空间构型、杂化方式
化学键类型
电离能、晶格能,键能
品体电虚计算
全回卷Ⅱ 电子样布式 离子晶体、分子晶体熔游点比较 电负性、微粒间作用力、配位数 杂化方式 晶体位置判断及品体密度计算 室间构型 分于晶体沸点比较 电子排布式 离子半径比较 品体化学式判断、密度计算、坐标 分析
电子排布图,电子云轮肉图
中心原子价层电子对雕、杂化方式,空 间 构
分子晶体缩沸点比较
共价健类型
品体密度及品胞专致
全回要Ⅲ 原子半径,对角线规则 配位键 杂化方式 电负性、等电子体 分子晶体熔点比较 品体密度计算 对角线规刚 双聚分子FeCL结构式及配位弦的 确定 品体类型判断及熔沸点比较 电负性 杂化轨道的形成 瑞酸祖高子化学式通式
电子排布式
电离能比较及原因
化学健类型
空间构型,杂化方式
金属品伴(Zn)堆积方式、密度计算
· 每年均有涉及的基本考点:价
层电子对数、杂化类型、分子 的空间结构、熔沸点比较等。
· 多数为常规考点,学生得分相 对比较容易
·考查形式和命题角度在逐年变 化 ,试题角度新颖,源于教材 又高于教材。
全国卷的命题特点和趋势
(3)(2018 ·全国卷I ·35节选)LiAIH 是有机合成中
常用的还原剂,LiAIH 中的阴离子空间构型是 中心原子的杂化形式为
【答案】正四面体 sp
【例8](2019·全国卷Ⅲ·35节选)苯胺(C-NH ) 的品体类型是 。苯胺与甲苯( C-CH )的相
对分子质量相近,但苯胺的熔点(-5.9℃)、沸点 (184.4 ℃)分别高于甲苯的熔点(一95.0 ℃)、沸点 (110.6 ℃),原因是
【答案】分子品体苯胺分子之间存在氢键
【例9】(2018 ·全国卷Ⅱ ·35节选)如图所示为S。的结 构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要 原因为
近三年全国卷
例如,关于杂化轨道、价层电子对数、空间构型的考查 在2018-2020年高考中分别以如下形式出现:
【例1】1)(2020 ·全国卷I ·35 节选)硕酸根离子的 空问构型为 其中P的价层电子对数为 杂化轨道类型为
【答案】正四面体4 sp
【例4】(2020 ·全国卷Ⅱ ·35节选)Ti的四卤化物熔点 如下表所示,TiF,熔点高于其他三种卤化物,自TiCl 至 TiI,熔点依次升高,原因是
(2)(2019 ·全国卷Ⅲ ·35节选)NH,H PO 中,电负
性最高的元素是 P 的 杂化轨道与0的 2p轨道形成 键。
【答案】0 sp 。
【例6】(2019 ·全国卷I ·35节选)一些氧化物的熔点 如下表所示
【答案】TiF。为离子化合物,熔点高,其他三种均为共价
化合物,随相对分子质量的增大分子间作用力增大,熔点逐 渐升高
【例5】(2020 ·全国卷Ⅲ ·35节选)与NH,BH。 原子总 数相等的等电子体是 _ (写分子式),其熔点比 NH BH (填“高”或“低”)。
【答案】CH CH 低
解释表中氧化物之间熔点差异的原因
【答案】Li O,MgO 为离子品体,P O 、SO 为分子品 体,晶格能MgO>Li O。分子间作用力P O >S0
【例7】(2019 ·全国卷Ⅱ ·35节选)元素As与N 同族。 预测As的氧化物分子的立体结构为 ,其沸点比
NH, 的 (“高”或“低”),其判断理由是 【答案】三角锥形低 NH, 分子间存在氢键
化合物 TiF TCL TiBr
Til
焙点/℃ 377 -24.12 38.3
155
氧化物 Li:0 MgO P O
SO
熔点/℃ 1570 2800 23.8
-75.5
【答案]S 相对分子质量大,分子间范德华力强
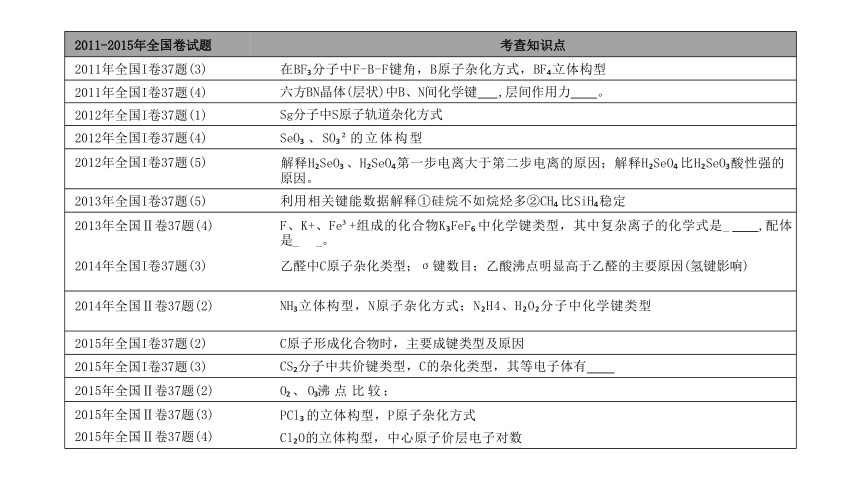
2011-2015年全国卷试题
考查知识点
2011年全国I卷37题(3)
在BF 分子中F-B-F键角,B原子杂化方式,BF 立体构型
2011年全国I卷37题(4)
六方BN晶体(层状)中B、N间化学键 ,层间作用力 。
2012年全国I卷37题(1)
Sg分子中S原子轨道杂化方式
2012年全国I卷37题(4)
SeO 、SO 的立体构型
2012年全国I卷37题(5)
解释H SeO 、H SeO 第一步电离大于第二步电离的原因;解释H SeO 比H SeO 酸性强的 原因。
2013年全国I卷37题(5)
利用相关键能数据解释①硅烷不如烷烃多②CH 比SiH 稳定
2013年全国Ⅱ卷37题(4)
F、K+、Fe +组成的化合物K FeF 中化学键类型,其中复杂离子的化学式是_ ,配体 是_ _。
2014年全国I卷37题(3)
乙醛中C原子杂化类型;σ键数目;乙酸沸点明显高于乙醛的主要原因(氢键影响)
2014年全国Ⅱ卷37题(2)
NH 立体构型,N原子杂化方式;N H4、H O 分子中化学键类型
2015年全国I卷37题(2)
C原子形成化合物时,主要成键类型及原因
2015年全国I卷37题(3)
CS 分子中共价键类型,C的杂化类型,其等电子体有
2015年全国Ⅱ卷37题(2)
O 、 O 沸 点 比 较 ;
2015年全国Ⅱ卷37题(3) 2015年全国Ⅱ卷37题(4)
PCl 的立体构型,P原子杂化方式
Cl O的立体构型,中心原子价层电子对数
三地位和作用
必修2 选择性必
口为什么甲烷是 修3
正四面体结构,
乙烯是平面结
构
口为什么乙烯易
发生加成反应
必修1
1.为什么有O 和H O , 而没 有H 、Cl
H Cl等分子 2.为什么氨气 极易溶于水 萃取
地位和作用
有机化学的核心思想是“结构决定性 质,性质反映结构”,要求学生形成有 机化学的思想和方法,需要进一步增进 化学学科理解,从学科本原上认识化学 知识中所蕴含的学科本原性问题以及解 决本原性问题的学科思维方式和方法。
《课程标准》指出“官能团、碳原子 的饱和性和化学键的极性对有机物的性 质具有决定作用”。
题号 I组平均得分
Ⅱ组平均得分
1 1.20
1.52
2 1.20
1.20
3 1.35
1.38
4 1.40
1.60
5 1.45
1.61
6 选 A 率 8 5 %
选 A 率 9 1 %
《物质结构与性质》和《有机化学基础》模块的教学时序
对“有机物分子结构与性质”学习影响的研究
表2 I、Ⅱ两组学生后测数据统计
注:后测试题6选项A 是认为《物质结构与性质》模块
的知识有利于《有机化学基础》中“有机物分子结构和性质” 知识的学习,选项B 则相反。
王素珍.化学教学[J]2014,6:16-19
共价键的极性、邻近基团对化学键电子云密度 的影响、碳原子的饱和程度
官能团的类别、官能团的相互作用
物质的类别
化学键角度
官能团角度
物质角度
反应类型 物质转化 影响因素
性结 质构
反 应性 用质
物理性质 化学性质
状态、 熔沸点
溶解性
有机物的性质和反应
2.共价键的极性与有机反应
由于不同的成键原子间电负性的差异,共用电子对会 发生偏移。偏移的程度越大,共价键极性越强,在反应中 越容易发生断裂。因此有机化合物的官能团及其邻近的化 学键往往是发生化学反应的活性部位。
■■
烃的衍生物中杂原子的引入使有机物中的共价 键产生极性,基团之间进一步相互作用,从而 对有机物的性质和有机反应产生影响。从化学
键极性的角度对断键、成键的部位和可能发生
的化学反应进行预测和解释,体现有机物结构
与性质关系中的“电子效应”。
实验表明,乙醇与钠能发生反应放出氢气,原因在于 乙醇分子中的氢氧键极性较强,能够发生断裂。同样条件 下,乙醇与钠的反应没有水与钠的反应剧烈,这是由于乙 醇分子中氢氧键的极性比水分子中氢氧键的极性弱。基团 之间的相互影响使得官能团中化学键的极性发生变化,从 而影响着官能团和物质的性质。
另外,由于羟基中氧原子的电负性较大,乙醇分子中 的碳氧键极性也较强,在乙醇与氢溴酸的反应中,碳氧键 发生了断裂。
本章的地位和作用
四新版教材中的变化
旧版教材
新版教材
第三章分子结构与性质
第三章分子结构与性质
第一节共价键
第一节共价键
第二节分子的立体结构
第二节分子的空间结构
第三节分子的性质
第三节分子结构与物质的性质
新旧版教材结构比较
注重物质结构的研究过程
研究物质结构的基本方法和使用手段,尽 管在旧的课标和教材中也有所体现,但是在过 往的教学中却并没有得到足够的重视,而关于 物质结构的理论结论的探讨比较多,但对于得 到这些理论得到的过程却讨论的非常少。
因此,新课标和教材中明确列出了红外光 谱、晶体X射线衍射等实验手段,强调并外显 物质结构研究过程的思路和方法。
新旧版教材内容比较
键长和键角的数值可通过品体的X射线衍射实验获得。
旧版教材
新版教材
二、分子间的作用力
1.范德华力及其对物质性质的影响 2.氢键及其对物质性质的影响
二、范德华力及其对物质性质的影响
三、氡键及其对物质性质的影响
认识分子间存在相互作用,知道范德华力和氢键是两种常见的分子间作用力,
了解分子内氢键和分子间氢键在自然界中的广泛存在及重要作用。
口分子间作用力就是范德华力吗
新旧版教材内容比较
教材版本
价层电子对数目(n)计算方法
人教版
n =σ键电子对数+孤电子对数[中心原子上的孤
电子对数=1/2(a-bx),其中a为中心原子的价电 子数,b为与中心原子结合的原子最多能接受的电 子数,x为与中心原子结合的原子数
鲁科版
n =成键电子对数+孤电子对数[中心原子上的孤 电子对数=1/2(中心原子的价电子数-与中心原
子结合的原子未成对电子数之和)]
苏教版
针对AB。型分子n=1/2(中心原子的价电子数+每 个配位原子提供的价电子数×m),其中,中心原子 的价电子数等于中心原子的最外层电子数,配位原 子中卤素原子、氢原子提供一个价电子,氧原子和硫 原子按不提供价电子计算
价层电子对互斥模型认为,分子的空间结构是中心原 子周围的“价层电子对”相互排斥的结果。VSEPR 的“价 层电子对”是指分子中的中心原子与结合原子间的σ键电 子对和中心原子上的孤电子对。多重键只计其中的σ键电 子对,不计π键电子对。
例如CO 中实际的成键电子对数目是4,计算时 只记σ成键电子对数目为2。由于π键是在σ键形 成的基础上原子轨道从侧面重叠而成的,并不 影响分子的整体构型,因此在计算价层电子对 数目时不考虑π键,这一点要让学生明确。
新旧版教材内容比较
口价层电子对数目的计算方法意义
(6)价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数( )
借助图片、视频、模型和软件把微 观和抽象的内容形象化,直观化
充分利用教材的数据、资料、习题, 发挥知识内容的学科认识功能
重视物质结构学习的“一般性”和 “特殊性”,不要绝对化
知识结构化、系统化,重视学科思 维方法的培养
教学策略和建议
02
DATA
1.借助图片、视频、模型和软件把微观和抽象的内容形象化,直观化
国家中小学课程资源《共价键》张雪
1.借助图片、视频、模型和软件把微观和抽象的内容形象化,直观化
国家中小学课程资源《分子的空间结构》余洁
V2
bend
asymmetric stretch
symmetrc stretch
librations
V3
1.借助图片、视频、模型和软件把微观和抽象的内容形象化,直观化
sp 杂化 sp 杂化
polar molecules 极性分子
手性分子
国家中小学课程资源《分子结构与物质性质》时朔
1.借助图片、视频、模型和软件把微观和抽象的内容形象化,直观化
电子云 密度大
电子云 密度小
蛋白质中的氢键
金属片
金 属 片
键 键能 (kJ ·mor) 键
键能 (kJ ·molr )
H—H 436.0 N=N
946
F—F 157 N—0
176
Cl—CI 242.7 N=0
607
Br—Br 193.7 0-0
142
I—I 152.7 0=(
497.3
C—C 347.7 C—H
413.4
C=C 615 0—H
462.8
C=C 812 N—H
390.8
C—0 351 H—F
568
C=0 745 H—CI
431.8
N—N 193 H—Br
366
N=N 418 H—I
298.7
键 键长/pm① 键
键长/pm
H—H 74 C=C
120
F—F 141 C—H
109
Cl—CI 198 0—H
96
Br—Br 228 N—H
101
I—1 267 N=N
110
C—C 154 Si—Si
235
C=C 133 Si—0
162
口同种类型共价键,成键原子的半径越小,键长越小
口成键原子相同的共价键键长:单键>双键>三键
口一般来说,分子中的键长越小,键能越大,共价键 越稳定
2.充分利用教材的数据、资料、习题,发挥知识内容的学科认识功能
表2-2 某些共价键的键长
表2-1 某些共价键的键能
思考与讨论
(1)试利用表2-1的数据进行计算,1 mol H 分别 与1 mol Cl 、1 mol Br (蒸气)反应,分别形成2 mol HCl和2 mol HBr,哪一个反应释放的能量更多 如何 用计算的结果说明氯化氢分子和溴化氢分子哪个更容 易发生热分解生成相应的单质
(2)N 、O 、F 跟 H 的反应能力依次增强,从 键能的角度应如何理解这一化学事实
(3)通过上述例子,你认为键长、键能对分子的 化学性质有什么影响
(1)从表2-1数据不难计算出,生成2 mol HCI和2 mol HBr分别放出184.9K 和102.3kJ 热 量,显然生成氯化氢放热多,所以HCI比HBr更易生成,更难分解,或者说溴化氢分子更容易发 生热分解。
(2)由于N—N 、0=0 、F—F 的键能依次减小,而N—H 、O-H 、F-H 的键能依次增 大,所以,N 、O 、F 跟H 的反应能力依次增强。
(3)一般来说,分子中共价键的键长越小,键能越大,共价键越稳定。
定量计算
定性分析 结论
以上数据说明:通常键长越小,键能越大,共价键越稳定。
(注:本题的键长数据和热分解温度,需要通过查阅课外资料获得)
键长、键能、共价键稳定性间的关系:一般来说,键长越小,键能越大,共价键越稳定 ★从所给的数据出发,具体问题具体分析,抓问题的主要矛盾,给出合理解释
7. 怎样理解Cl 、Br 、I 的键能依次下降,键长依次增大
8.查出HCI 、HBr和HI的键长、键能的数据和热分解温度,考察它们之间的相关性。通过这个例子说 明分子的结构如何影响分子的化学性质。
7.键能和键长都能描述共价键的强弱,从CI 到I, 原子半径依次增大,可得出从Cl 到 I 其 X—X 键长依次增大,键能依次下降。
8.
键 键长/pm 键能/(kJ · mol )
HX在1273 K的分解百分数/%
H—Cl 127.4 431.8
0.0014
H—Br 141.4 366
0.5
H—I 160.9 298.7
33
气体 溶解度ig 气体 溶解度g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氢气 0.729 氧气 0.0043
乙烷 0.0062 二氧化硫 11.28
水是极性溶剂,根据 “相似相溶”,极性溶质比非极 性溶质在水中的溶解度大。
如果存在氢键,则溶剂和溶质之间的氢键作用力越大, 溶解性越好。相反,无氢键相互作用的溶质在有氢键的水 中的溶解度就比较小。
子间作用力称为范德华力。范德华力很弱,比化学键的键 能小1~2个数量级。 相对分子质量越大,范德华力越大 分子的极性越大,范德华力也越大。
表2-7 某些分子间的范德华力
分子 Ar CO HI HBr
HC1
范德华力 (kJ ·mol) 8.50 8.75 26.00 23.11
21.14
单质 熔点/℃
沸点/℃
F -219.6
-188.1
Cl -101
-34.6
Br -7.2
58.78
I 113.5
184,4
资料卡片
表2-10 气体的溶解度(气体的压强为1.01×10'Pa,湿度为293K, 在100g水中的溶解度)
2.充分利用教材的数据、资料、习题,发挥知识内容的学科认识功能
@思考与讨论
怎样解释卤素单质 从 F ~I 的熔点和沸点 越来越高
表2-8 卤素单质的熔点和沸点
键 键能 (kJ ·mol ) 键
键能 (kJ ·mol- )
H—H 436.0 N=N
946
F—F 157 N—0
176
Cl—CI 242.7 N=0
607
Br—Br 193.7 0-0
142
I—I 152.7 0=(
497.3
C—C 347.7 C—H
413.4
C=C 615 0—H
462.8
C=C 812 N—H
390.8
C—0 351 H—F
568
C=0 745 H—CI
431.8
N—N 193 H—Br
366
N=N 418 H—I
298.7
键 键长/pm 键
键长/pm
H—H 74 C=C
120
F—F 141 C—H
109
Cl—CI 198 0—H
96
Br—Br 228 N—H
101
I—1 267 N=N
110
C—C 154 Si—Si
235
C=C 133 Si—0
162
口 键长越小,键能一定越大吗
新教材中删去了“键长越短,往往键能越大,表明共 价键越稳定”,改为“化学键的键长和键能是相关的”
表2-2 某些共价键的键长
3.重视物质结构学习的“一般性”和“特殊性”,不要绝对化
表2-1 某些共价键的键能
键 健能 (kJ ·mor) 健
键能 (1J ·moli )
H—H 436.0 N=N
946
F—F 157 N-0
176
C—CI 242.7 N=0
607
Br—Br 193.7 0-0
142
I—1 152.7 0=0
497.3
C—C 347,7 C—H
413.4
C=C 615 0—H
462.8
C=C 812 N—H
390.8
C—0 351 H—F
568
C-0 745 H—CI
431.8
N—N 193 H—Br
366
N-N 418 H—I
298.7
原子轨道分子轨道原子轨道
(a) 无s-p 混杂 (b) 存在s-p 混杂的N 分子轨道能级图
图1 第二周期同核双原子分子轨道能级图
□ σ键的键能一定比π键大吗
表2-1 某些共价键的健能
6.已 知O 的空间结构为V形,分子中正电中心和负电中心不重合,则下列关于O 和O 在水中的溶解
度的叙述中,正确的是( )。
A.O 在水中的溶解度和O 的一样 B.O 在水中的溶解度比O 的小
C.O 在水中的溶解度比O 的大 D. 无法比较
口同种元素间形成的共价键一定是非极性键吗
资料卡片
臭氧是极性分子
臭氧是一种重要物质。大气高空的臭氧 层保护了地球生物的生存;空气质量预报中 臭氧含量是空气质量的重要指标;它还是有 机合成的氧化剂、替代氧气的净水剂……出 人意料的是,臭氧分子有极性,但很微弱。 其分子的空间结构与水分子的基本相同,但
极性仅是水分子的极性的28%。臭氧分子中的 共价键是极性键,臭氧分子的中心氧原子是 呈正电性的,而端位的两个氧原子是呈负电 性的。由于臭氧的极性微弱,它在四氯化碳 里的溶解度高于在水中的溶解度。
o键
o键
*头碰头“
S-po键
π键:“肩并肩“
键能
共价键
键参数
键角
方 向性
饱和性
价层电子对数=
成键电子对数+孤电子对数
略去
确定
孤电子对数
价层电 VSEPR
子对数 理想模型
2 直线形
3 平面三角形
4 正四面体形
预测
VSEPR模 型
分子的 空间结构
杂化轨道理论 解释
4 . 知 识 结 构 化 、 系 统 化 , 重 视 学 科 思 维 方 法 的 培 养
1.电子式
2.计算 -xb)
确定价层 电子对数
分子的
空间结构
VSEPR 理想模型
测定
p-Pπ键
孤电子对
光 谱
键长
ss
P-
INTERACTIVE SIMULATIONS
https://phet.colorado.edu/
PhET是一款开放、免费的互动仿真 程序。由诺贝尔物理学奖获得者卡 尔 ·威曼于2002年发起。
火花学院是科学可视化教学内容及工具库,
致力于帮助学生“看见”那些难以“见到” 的科学场景和概念。
推荐资源
mm9
F4 Dstnce (A)
δ (cm) 中 " A(cm”
2000
1600
1200
c 800
300
250
2000
p 1500
1200
1000
24
Dereka B,Yu Q,Lewis NHC,et al.Crossover from hydrogen to chemical bonding[J].Science,2021,371(6525):160-164.
(cm)
图3经典氢键到SHBs的转变 图4经典氢键到氢原子介导的化学键的转变
口最新研究成果
Exctaton Frequency a,(cn')
图2 SHBs 的红外光谱
23
F-FDistance(A) Exdlslon Frequencym(cm)
图1各类氢键
FH
atan
A)
人教版高中化学选择性必修2
第二章分子结构与性质教材分析
01 無 课程标准
02 以 地位和作用
03 教学内容
04 新版教材的变化
05 膏 教学策略和建议
目 录
模块2物质结构与性质
本课程模块将从原子、分子水平上认识物 质构成的规律,以微粒之间不同的作用力为线 索,侧重研究不同类型物质的有关性质,进一 步丰富学生物质结构的知识,提高学生分析问 题和解决问题的能力。
通过本课程模块的学习,提升学生有关物 质结构的基本认识,深入认识物质的结构与性 质之间的关系,发展化学学科核心素养。
宏观辨识与微观探析 证据推理与模型认知
普通高中
化学课程标准
(2 017年版)
中犟人民共和国教言外到定
化学课程标准(2017年版)
课程内容整合,注重帮助学生形成统摄性、结构化的认识
黄泰荣.新旧两版课标“物质结构与性质”模块的比较研究.中学化学教学参考{J}2020,10:29-32
主题1原子结构与元素的性质
主题2化学键与物质的性质
主题3分子间作用力与物质
的性质
主题4研究物质结构的价值
主题1原子结构与元素的性质
主题2微粒间的相互作用与 物质的性质
主题3研究物质结构的方法 与价值,
旧课标 新课标
以 二 教 学 内
容
教学内容
本章对共价键、分子的空间结构、分子的结构对物质性质的影响等内容进行深入的探讨。
共价键
分子结构
分子的空间结构
共价键的极性
分子性质
分子结构与性质
1.能说出共价键的主要类型、特征与区别,能利用键参数解释物质的 某些性质
2.能根据给定的信息分析常见简单分子的空间结构,能利用价层电子 对互斥模型和杂化轨道理论,预测和解释简单的共价分子的空间结构
3.能利用电负性判断共价键的极性,能根据共价分子的结构特点说明 简单分子的某些性质,能说明分子间作用力(含氢键)对物质熔点、 沸点等性质的影响,能列举含有氢键的物质及其性质特点,知道氢键 对于生命的重大意义
4.能根据键的极性和分子结构特点来判断分子的极性,并据此对分子 的一些典型性质及其应用作出解释
学业要求
2020年 2019年
2018年
全国卷I 未成对电子敢 电离能 空间构型,价属电子对取,杂化方式 品胞中LF PO,单元数、 Li -,FePO,中x求算 电离能 杂化方式 配位键的形成及物定性 分子品体、离子品体熔点差异 原子问的正离及品体密度计算
基态、激发态L原子能量比较
离子半径比较及原因
空间构型、杂化方式
化学键类型
电离能、晶格能,键能
品体电虚计算
全回卷Ⅱ 电子样布式 离子晶体、分子晶体熔游点比较 电负性、微粒间作用力、配位数 杂化方式 晶体位置判断及品体密度计算 室间构型 分于晶体沸点比较 电子排布式 离子半径比较 品体化学式判断、密度计算、坐标 分析
电子排布图,电子云轮肉图
中心原子价层电子对雕、杂化方式,空 间 构
分子晶体缩沸点比较
共价健类型
品体密度及品胞专致
全回要Ⅲ 原子半径,对角线规则 配位键 杂化方式 电负性、等电子体 分子晶体熔点比较 品体密度计算 对角线规刚 双聚分子FeCL结构式及配位弦的 确定 品体类型判断及熔沸点比较 电负性 杂化轨道的形成 瑞酸祖高子化学式通式
电子排布式
电离能比较及原因
化学健类型
空间构型,杂化方式
金属品伴(Zn)堆积方式、密度计算
· 每年均有涉及的基本考点:价
层电子对数、杂化类型、分子 的空间结构、熔沸点比较等。
· 多数为常规考点,学生得分相 对比较容易
·考查形式和命题角度在逐年变 化 ,试题角度新颖,源于教材 又高于教材。
全国卷的命题特点和趋势
(3)(2018 ·全国卷I ·35节选)LiAIH 是有机合成中
常用的还原剂,LiAIH 中的阴离子空间构型是 中心原子的杂化形式为
【答案】正四面体 sp
【例8](2019·全国卷Ⅲ·35节选)苯胺(C-NH ) 的品体类型是 。苯胺与甲苯( C-CH )的相
对分子质量相近,但苯胺的熔点(-5.9℃)、沸点 (184.4 ℃)分别高于甲苯的熔点(一95.0 ℃)、沸点 (110.6 ℃),原因是
【答案】分子品体苯胺分子之间存在氢键
【例9】(2018 ·全国卷Ⅱ ·35节选)如图所示为S。的结 构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要 原因为
近三年全国卷
例如,关于杂化轨道、价层电子对数、空间构型的考查 在2018-2020年高考中分别以如下形式出现:
【例1】1)(2020 ·全国卷I ·35 节选)硕酸根离子的 空问构型为 其中P的价层电子对数为 杂化轨道类型为
【答案】正四面体4 sp
【例4】(2020 ·全国卷Ⅱ ·35节选)Ti的四卤化物熔点 如下表所示,TiF,熔点高于其他三种卤化物,自TiCl 至 TiI,熔点依次升高,原因是
(2)(2019 ·全国卷Ⅲ ·35节选)NH,H PO 中,电负
性最高的元素是 P 的 杂化轨道与0的 2p轨道形成 键。
【答案】0 sp 。
【例6】(2019 ·全国卷I ·35节选)一些氧化物的熔点 如下表所示
【答案】TiF。为离子化合物,熔点高,其他三种均为共价
化合物,随相对分子质量的增大分子间作用力增大,熔点逐 渐升高
【例5】(2020 ·全国卷Ⅲ ·35节选)与NH,BH。 原子总 数相等的等电子体是 _ (写分子式),其熔点比 NH BH (填“高”或“低”)。
【答案】CH CH 低
解释表中氧化物之间熔点差异的原因
【答案】Li O,MgO 为离子品体,P O 、SO 为分子品 体,晶格能MgO>Li O。分子间作用力P O >S0
【例7】(2019 ·全国卷Ⅱ ·35节选)元素As与N 同族。 预测As的氧化物分子的立体结构为 ,其沸点比
NH, 的 (“高”或“低”),其判断理由是 【答案】三角锥形低 NH, 分子间存在氢键
化合物 TiF TCL TiBr
Til
焙点/℃ 377 -24.12 38.3
155
氧化物 Li:0 MgO P O
SO
熔点/℃ 1570 2800 23.8
-75.5
【答案]S 相对分子质量大,分子间范德华力强
2011-2015年全国卷试题
考查知识点
2011年全国I卷37题(3)
在BF 分子中F-B-F键角,B原子杂化方式,BF 立体构型
2011年全国I卷37题(4)
六方BN晶体(层状)中B、N间化学键 ,层间作用力 。
2012年全国I卷37题(1)
Sg分子中S原子轨道杂化方式
2012年全国I卷37题(4)
SeO 、SO 的立体构型
2012年全国I卷37题(5)
解释H SeO 、H SeO 第一步电离大于第二步电离的原因;解释H SeO 比H SeO 酸性强的 原因。
2013年全国I卷37题(5)
利用相关键能数据解释①硅烷不如烷烃多②CH 比SiH 稳定
2013年全国Ⅱ卷37题(4)
F、K+、Fe +组成的化合物K FeF 中化学键类型,其中复杂离子的化学式是_ ,配体 是_ _。
2014年全国I卷37题(3)
乙醛中C原子杂化类型;σ键数目;乙酸沸点明显高于乙醛的主要原因(氢键影响)
2014年全国Ⅱ卷37题(2)
NH 立体构型,N原子杂化方式;N H4、H O 分子中化学键类型
2015年全国I卷37题(2)
C原子形成化合物时,主要成键类型及原因
2015年全国I卷37题(3)
CS 分子中共价键类型,C的杂化类型,其等电子体有
2015年全国Ⅱ卷37题(2)
O 、 O 沸 点 比 较 ;
2015年全国Ⅱ卷37题(3) 2015年全国Ⅱ卷37题(4)
PCl 的立体构型,P原子杂化方式
Cl O的立体构型,中心原子价层电子对数
三地位和作用
必修2 选择性必
口为什么甲烷是 修3
正四面体结构,
乙烯是平面结
构
口为什么乙烯易
发生加成反应
必修1
1.为什么有O 和H O , 而没 有H 、Cl
H Cl等分子 2.为什么氨气 极易溶于水 萃取
地位和作用
有机化学的核心思想是“结构决定性 质,性质反映结构”,要求学生形成有 机化学的思想和方法,需要进一步增进 化学学科理解,从学科本原上认识化学 知识中所蕴含的学科本原性问题以及解 决本原性问题的学科思维方式和方法。
《课程标准》指出“官能团、碳原子 的饱和性和化学键的极性对有机物的性 质具有决定作用”。
题号 I组平均得分
Ⅱ组平均得分
1 1.20
1.52
2 1.20
1.20
3 1.35
1.38
4 1.40
1.60
5 1.45
1.61
6 选 A 率 8 5 %
选 A 率 9 1 %
《物质结构与性质》和《有机化学基础》模块的教学时序
对“有机物分子结构与性质”学习影响的研究
表2 I、Ⅱ两组学生后测数据统计
注:后测试题6选项A 是认为《物质结构与性质》模块
的知识有利于《有机化学基础》中“有机物分子结构和性质” 知识的学习,选项B 则相反。
王素珍.化学教学[J]2014,6:16-19
共价键的极性、邻近基团对化学键电子云密度 的影响、碳原子的饱和程度
官能团的类别、官能团的相互作用
物质的类别
化学键角度
官能团角度
物质角度
反应类型 物质转化 影响因素
性结 质构
反 应性 用质
物理性质 化学性质
状态、 熔沸点
溶解性
有机物的性质和反应
2.共价键的极性与有机反应
由于不同的成键原子间电负性的差异,共用电子对会 发生偏移。偏移的程度越大,共价键极性越强,在反应中 越容易发生断裂。因此有机化合物的官能团及其邻近的化 学键往往是发生化学反应的活性部位。
■■
烃的衍生物中杂原子的引入使有机物中的共价 键产生极性,基团之间进一步相互作用,从而 对有机物的性质和有机反应产生影响。从化学
键极性的角度对断键、成键的部位和可能发生
的化学反应进行预测和解释,体现有机物结构
与性质关系中的“电子效应”。
实验表明,乙醇与钠能发生反应放出氢气,原因在于 乙醇分子中的氢氧键极性较强,能够发生断裂。同样条件 下,乙醇与钠的反应没有水与钠的反应剧烈,这是由于乙 醇分子中氢氧键的极性比水分子中氢氧键的极性弱。基团 之间的相互影响使得官能团中化学键的极性发生变化,从 而影响着官能团和物质的性质。
另外,由于羟基中氧原子的电负性较大,乙醇分子中 的碳氧键极性也较强,在乙醇与氢溴酸的反应中,碳氧键 发生了断裂。
本章的地位和作用
四新版教材中的变化
旧版教材
新版教材
第三章分子结构与性质
第三章分子结构与性质
第一节共价键
第一节共价键
第二节分子的立体结构
第二节分子的空间结构
第三节分子的性质
第三节分子结构与物质的性质
新旧版教材结构比较
注重物质结构的研究过程
研究物质结构的基本方法和使用手段,尽 管在旧的课标和教材中也有所体现,但是在过 往的教学中却并没有得到足够的重视,而关于 物质结构的理论结论的探讨比较多,但对于得 到这些理论得到的过程却讨论的非常少。
因此,新课标和教材中明确列出了红外光 谱、晶体X射线衍射等实验手段,强调并外显 物质结构研究过程的思路和方法。
新旧版教材内容比较
键长和键角的数值可通过品体的X射线衍射实验获得。
旧版教材
新版教材
二、分子间的作用力
1.范德华力及其对物质性质的影响 2.氢键及其对物质性质的影响
二、范德华力及其对物质性质的影响
三、氡键及其对物质性质的影响
认识分子间存在相互作用,知道范德华力和氢键是两种常见的分子间作用力,
了解分子内氢键和分子间氢键在自然界中的广泛存在及重要作用。
口分子间作用力就是范德华力吗
新旧版教材内容比较
教材版本
价层电子对数目(n)计算方法
人教版
n =σ键电子对数+孤电子对数[中心原子上的孤
电子对数=1/2(a-bx),其中a为中心原子的价电 子数,b为与中心原子结合的原子最多能接受的电 子数,x为与中心原子结合的原子数
鲁科版
n =成键电子对数+孤电子对数[中心原子上的孤 电子对数=1/2(中心原子的价电子数-与中心原
子结合的原子未成对电子数之和)]
苏教版
针对AB。型分子n=1/2(中心原子的价电子数+每 个配位原子提供的价电子数×m),其中,中心原子 的价电子数等于中心原子的最外层电子数,配位原 子中卤素原子、氢原子提供一个价电子,氧原子和硫 原子按不提供价电子计算
价层电子对互斥模型认为,分子的空间结构是中心原 子周围的“价层电子对”相互排斥的结果。VSEPR 的“价 层电子对”是指分子中的中心原子与结合原子间的σ键电 子对和中心原子上的孤电子对。多重键只计其中的σ键电 子对,不计π键电子对。
例如CO 中实际的成键电子对数目是4,计算时 只记σ成键电子对数目为2。由于π键是在σ键形 成的基础上原子轨道从侧面重叠而成的,并不 影响分子的整体构型,因此在计算价层电子对 数目时不考虑π键,这一点要让学生明确。
新旧版教材内容比较
口价层电子对数目的计算方法意义
(6)价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数( )
借助图片、视频、模型和软件把微 观和抽象的内容形象化,直观化
充分利用教材的数据、资料、习题, 发挥知识内容的学科认识功能
重视物质结构学习的“一般性”和 “特殊性”,不要绝对化
知识结构化、系统化,重视学科思 维方法的培养
教学策略和建议
02
DATA
1.借助图片、视频、模型和软件把微观和抽象的内容形象化,直观化
国家中小学课程资源《共价键》张雪
1.借助图片、视频、模型和软件把微观和抽象的内容形象化,直观化
国家中小学课程资源《分子的空间结构》余洁
V2
bend
asymmetric stretch
symmetrc stretch
librations
V3
1.借助图片、视频、模型和软件把微观和抽象的内容形象化,直观化
sp 杂化 sp 杂化
polar molecules 极性分子
手性分子
国家中小学课程资源《分子结构与物质性质》时朔
1.借助图片、视频、模型和软件把微观和抽象的内容形象化,直观化
电子云 密度大
电子云 密度小
蛋白质中的氢键
金属片
金 属 片
键 键能 (kJ ·mor) 键
键能 (kJ ·molr )
H—H 436.0 N=N
946
F—F 157 N—0
176
Cl—CI 242.7 N=0
607
Br—Br 193.7 0-0
142
I—I 152.7 0=(
497.3
C—C 347.7 C—H
413.4
C=C 615 0—H
462.8
C=C 812 N—H
390.8
C—0 351 H—F
568
C=0 745 H—CI
431.8
N—N 193 H—Br
366
N=N 418 H—I
298.7
键 键长/pm① 键
键长/pm
H—H 74 C=C
120
F—F 141 C—H
109
Cl—CI 198 0—H
96
Br—Br 228 N—H
101
I—1 267 N=N
110
C—C 154 Si—Si
235
C=C 133 Si—0
162
口同种类型共价键,成键原子的半径越小,键长越小
口成键原子相同的共价键键长:单键>双键>三键
口一般来说,分子中的键长越小,键能越大,共价键 越稳定
2.充分利用教材的数据、资料、习题,发挥知识内容的学科认识功能
表2-2 某些共价键的键长
表2-1 某些共价键的键能
思考与讨论
(1)试利用表2-1的数据进行计算,1 mol H 分别 与1 mol Cl 、1 mol Br (蒸气)反应,分别形成2 mol HCl和2 mol HBr,哪一个反应释放的能量更多 如何 用计算的结果说明氯化氢分子和溴化氢分子哪个更容 易发生热分解生成相应的单质
(2)N 、O 、F 跟 H 的反应能力依次增强,从 键能的角度应如何理解这一化学事实
(3)通过上述例子,你认为键长、键能对分子的 化学性质有什么影响
(1)从表2-1数据不难计算出,生成2 mol HCI和2 mol HBr分别放出184.9K 和102.3kJ 热 量,显然生成氯化氢放热多,所以HCI比HBr更易生成,更难分解,或者说溴化氢分子更容易发 生热分解。
(2)由于N—N 、0=0 、F—F 的键能依次减小,而N—H 、O-H 、F-H 的键能依次增 大,所以,N 、O 、F 跟H 的反应能力依次增强。
(3)一般来说,分子中共价键的键长越小,键能越大,共价键越稳定。
定量计算
定性分析 结论
以上数据说明:通常键长越小,键能越大,共价键越稳定。
(注:本题的键长数据和热分解温度,需要通过查阅课外资料获得)
键长、键能、共价键稳定性间的关系:一般来说,键长越小,键能越大,共价键越稳定 ★从所给的数据出发,具体问题具体分析,抓问题的主要矛盾,给出合理解释
7. 怎样理解Cl 、Br 、I 的键能依次下降,键长依次增大
8.查出HCI 、HBr和HI的键长、键能的数据和热分解温度,考察它们之间的相关性。通过这个例子说 明分子的结构如何影响分子的化学性质。
7.键能和键长都能描述共价键的强弱,从CI 到I, 原子半径依次增大,可得出从Cl 到 I 其 X—X 键长依次增大,键能依次下降。
8.
键 键长/pm 键能/(kJ · mol )
HX在1273 K的分解百分数/%
H—Cl 127.4 431.8
0.0014
H—Br 141.4 366
0.5
H—I 160.9 298.7
33
气体 溶解度ig 气体 溶解度g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氢气 0.729 氧气 0.0043
乙烷 0.0062 二氧化硫 11.28
水是极性溶剂,根据 “相似相溶”,极性溶质比非极 性溶质在水中的溶解度大。
如果存在氢键,则溶剂和溶质之间的氢键作用力越大, 溶解性越好。相反,无氢键相互作用的溶质在有氢键的水 中的溶解度就比较小。
子间作用力称为范德华力。范德华力很弱,比化学键的键 能小1~2个数量级。 相对分子质量越大,范德华力越大 分子的极性越大,范德华力也越大。
表2-7 某些分子间的范德华力
分子 Ar CO HI HBr
HC1
范德华力 (kJ ·mol) 8.50 8.75 26.00 23.11
21.14
单质 熔点/℃
沸点/℃
F -219.6
-188.1
Cl -101
-34.6
Br -7.2
58.78
I 113.5
184,4
资料卡片
表2-10 气体的溶解度(气体的压强为1.01×10'Pa,湿度为293K, 在100g水中的溶解度)
2.充分利用教材的数据、资料、习题,发挥知识内容的学科认识功能
@思考与讨论
怎样解释卤素单质 从 F ~I 的熔点和沸点 越来越高
表2-8 卤素单质的熔点和沸点
键 键能 (kJ ·mol ) 键
键能 (kJ ·mol- )
H—H 436.0 N=N
946
F—F 157 N—0
176
Cl—CI 242.7 N=0
607
Br—Br 193.7 0-0
142
I—I 152.7 0=(
497.3
C—C 347.7 C—H
413.4
C=C 615 0—H
462.8
C=C 812 N—H
390.8
C—0 351 H—F
568
C=0 745 H—CI
431.8
N—N 193 H—Br
366
N=N 418 H—I
298.7
键 键长/pm 键
键长/pm
H—H 74 C=C
120
F—F 141 C—H
109
Cl—CI 198 0—H
96
Br—Br 228 N—H
101
I—1 267 N=N
110
C—C 154 Si—Si
235
C=C 133 Si—0
162
口 键长越小,键能一定越大吗
新教材中删去了“键长越短,往往键能越大,表明共 价键越稳定”,改为“化学键的键长和键能是相关的”
表2-2 某些共价键的键长
3.重视物质结构学习的“一般性”和“特殊性”,不要绝对化
表2-1 某些共价键的键能
键 健能 (kJ ·mor) 健
键能 (1J ·moli )
H—H 436.0 N=N
946
F—F 157 N-0
176
C—CI 242.7 N=0
607
Br—Br 193.7 0-0
142
I—1 152.7 0=0
497.3
C—C 347,7 C—H
413.4
C=C 615 0—H
462.8
C=C 812 N—H
390.8
C—0 351 H—F
568
C-0 745 H—CI
431.8
N—N 193 H—Br
366
N-N 418 H—I
298.7
原子轨道分子轨道原子轨道
(a) 无s-p 混杂 (b) 存在s-p 混杂的N 分子轨道能级图
图1 第二周期同核双原子分子轨道能级图
□ σ键的键能一定比π键大吗
表2-1 某些共价键的健能
6.已 知O 的空间结构为V形,分子中正电中心和负电中心不重合,则下列关于O 和O 在水中的溶解
度的叙述中,正确的是( )。
A.O 在水中的溶解度和O 的一样 B.O 在水中的溶解度比O 的小
C.O 在水中的溶解度比O 的大 D. 无法比较
口同种元素间形成的共价键一定是非极性键吗
资料卡片
臭氧是极性分子
臭氧是一种重要物质。大气高空的臭氧 层保护了地球生物的生存;空气质量预报中 臭氧含量是空气质量的重要指标;它还是有 机合成的氧化剂、替代氧气的净水剂……出 人意料的是,臭氧分子有极性,但很微弱。 其分子的空间结构与水分子的基本相同,但
极性仅是水分子的极性的28%。臭氧分子中的 共价键是极性键,臭氧分子的中心氧原子是 呈正电性的,而端位的两个氧原子是呈负电 性的。由于臭氧的极性微弱,它在四氯化碳 里的溶解度高于在水中的溶解度。
o键
o键
*头碰头“
S-po键
π键:“肩并肩“
键能
共价键
键参数
键角
方 向性
饱和性
价层电子对数=
成键电子对数+孤电子对数
略去
确定
孤电子对数
价层电 VSEPR
子对数 理想模型
2 直线形
3 平面三角形
4 正四面体形
预测
VSEPR模 型
分子的 空间结构
杂化轨道理论 解释
4 . 知 识 结 构 化 、 系 统 化 , 重 视 学 科 思 维 方 法 的 培 养
1.电子式
2.计算 -xb)
确定价层 电子对数
分子的
空间结构
VSEPR 理想模型
测定
p-Pπ键
孤电子对
光 谱
键长
ss
P-
INTERACTIVE SIMULATIONS
https://phet.colorado.edu/
PhET是一款开放、免费的互动仿真 程序。由诺贝尔物理学奖获得者卡 尔 ·威曼于2002年发起。
火花学院是科学可视化教学内容及工具库,
致力于帮助学生“看见”那些难以“见到” 的科学场景和概念。
推荐资源
mm9
F4 Dstnce (A)
δ (cm) 中 " A(cm”
2000
1600
1200
c 800
300
250
2000
p 1500
1200
1000
24
Dereka B,Yu Q,Lewis NHC,et al.Crossover from hydrogen to chemical bonding[J].Science,2021,371(6525):160-164.
(cm)
图3经典氢键到SHBs的转变 图4经典氢键到氢原子介导的化学键的转变
口最新研究成果
Exctaton Frequency a,(cn')
图2 SHBs 的红外光谱
23
F-FDistance(A) Exdlslon Frequencym(cm)
图1各类氢键
FH
atan
A)
