高中化学人教版2019选修一公开课化学反应的调控(共33张PPT)
文档属性
| 名称 | 高中化学人教版2019选修一公开课化学反应的调控(共33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 731.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 20:27:55 | ||
图片预览











文档简介
(共33张PPT)
第四节
化学反应的调控
你主要应考虑哪些问题
1、经济效益
2、社会效益
思考:假如你是一个化工厂的老板对工业生产
单位时间里提高合成氨的产量
(从化学反应的速率考虑)
提高平衡混合物中氨的含量
(从化学平衡的移动考虑)
从生产成本、动力、材料、设备等对上述 理论探讨进一步论证,以得出合理的结论。
提 高 综 合 经 济 效 益
理 论 实际
不记得吗
1、影响化学反应速率的因素有哪些
反应物表面积、反应物浓度、温度、能引起气体 反应物浓度改变的压强、催化剂
2、影响化学平衡移动的因素有哪些
浓度、压强、温度
勒夏特列原理:如果改变影响平衡的一个条件(如 浓度、压强或温度等),平衡就向能够减弱这种改 变的方向移动。
1. 合成氨反应的特点
合成氨反应:N (g)+3H (g)=2NH (g)
已知298 K 时:△H=-92.4 kJ ·mol-1,
△S=-198.2 J·mol-1.K-1
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:△H<0, 熵变:△S<0。
(4)自发性:常温(298 K)下,△H-T△S < 0, 能自发进行
【交流 ·研讨】
工业合成氨时主要考虑的因素
(1) 多 即提高平衡混合物里氨的含量
——化学平衡问题
(2) 快 即提高单位时间里氨的产量
——化学反应速率问题
(3) 便宜 降低成本,提高原料利用率。
(4) 绿色 保护环境,对设备的要求。
增大N 、H 的浓度 其物质的量 之比为1:3时 NH 的含量最高
及 时 转 移 走 N H
根据此反应特点分析,什么条件有利于合成氨
1:1 1:2 1:3 1:4 1:5 1:6N2:H
0.6
0.5
0.4 0.3 0.2
0.1
【交流 ·研讨】~多
NH3%
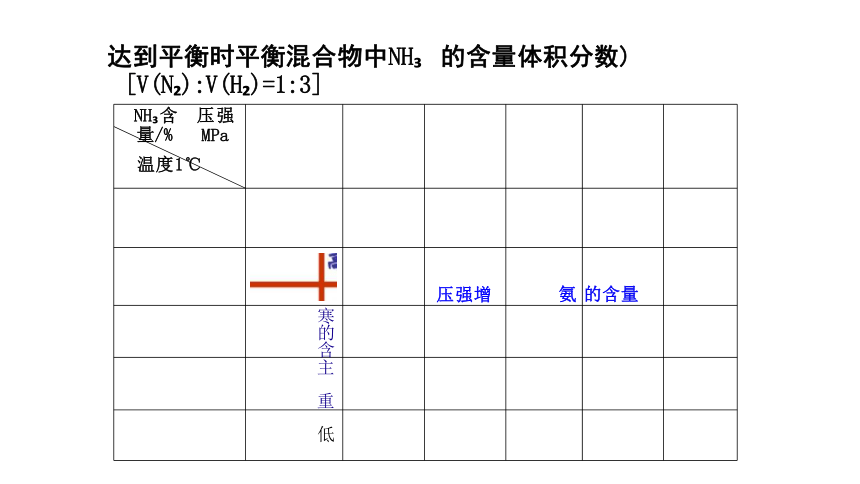
NH 含 压强 量/% MPa 温度1℃
压强增 氨 的含量
寒的含
主 重
低
达到平衡时平衡混合物中NH 的含量体积分数) [V(N ):V(H )=1:3]
及时转移走NH
低温
高压
无影响
【交流 ·研讨】~多
根据此反应特点分析,什么条件有利于合成氨
增大N 、H 的浓度,提高氢气压强更有利
于提高反应速率,其物质的量之比应<1:3
及时转移走NH
高温
高压
正催化剂
【交流 ·研讨】~快
根据此反应特点分析,什么条件有利于提高合成氨 的速率
外界条件 使NH 生产得快 使NH 生产得多
理论选择 适宜条件
速率分析 平衡分析
反应物 的浓度 增大浓度 增大浓度
增大浓度
压强 高压 高压
高压
催化剂 使用 无影响
温度 高温 矛盾 低温
合成氨的适宜条件的选择
( 一 )压强:
合成氨厂一般采用的压强
为10 MPa~30 Mpa。
【思考1】合成氨时压强越大越好,为何不 采用比30 MPa 更大的压强
提示:压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,
这会加大生产投资,可能降低综合经济效益。
压 强 /MPa
图2-11400℃下平衡时氨的体积分数随压强的变化示意图
压强的选择一成本与效益的博弈
NH 的体积分数/%
图2-1210 MPa 下平衡时氨的体积分数随温度的变化示意图
提示:温度太低,反应速率太小,达到平衡所需的时间变长,不经济。升高温度, 转化率降低,另外,合成氨所需的催化剂铁触媒的活性在500 ℃左右活性最
大。
一般采用的温度为400~500℃ 。
【思考2】合成氨采用低温时可提高
转化率,但为何未采用更低的温度
温度的选择—快与少、慢与多的权衡
NH,的体积分数/%
温度/℃
随堂练习
工业上合成氨一般采用400~500℃的温度,其原因是( D )
①适当提高氨的合成速率②提高H 的转化率③提高氨的产 率④催化剂在500 ℃左右活性最大
A.只有① B.只有①②
C.②③④ D.只有①④
(三)催化剂:
目前,合成氨工业中普遍使用的是以铁为主体的多成分催化剂, 又称铁触媒。
铁触媒在500℃左右时的活性最大,这也是合成氨一般选择 400~500℃进行的重要原因。
另外,为了防止混有的杂质使催化剂“中毒”,原料气必须经过 净化。
使用催化剂可使合成氨反应的速率提高上 万 亿倍
(四)浓度:
采取迅速冷却的方法,使气态氨变成液氨后及时从平衡混合物中分 离出去,以促使化学平衡向生成NH 的方向移动。此外,如果让N 和H 的混合气体只一次通过合成塔发生反应也是很不经济的,应将NH 分离 后的原料气循环使用,并及时补充N 和H , 使反应物保持一定的浓度,以 利于合成氨反应。
【思考】合成氨工业采用迅速冷却法,使气态氨变为液氨后及时从混合物中 分离出去的目的是什么
提示:使化学平衡向生成氨的方向移动。
适宜条件
随堂练习
利用原料气在合成塔中合成NH , 为提高N 的转化率所采取的措 施是( B )
A.高温 B.高压
C.使用催化剂 D.增大N 的浓度
随堂练习
有关合成氨工业的说法中,正确的是( B )
A.增大H 的浓度,可提高H 的转化率
B.由于氨易液化,N 、H 在实际生产中会循环使用,所以总体来说氨的 产率很高
C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正 反应方向移动
D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的
活性最大
工业上利用某可逆反应生产产品:
一般要使用催化剂:这样可以大大加快化学反应速 率,提高生产效率,也提高了经济效益;
选择合适的温度:该温度是催化剂活性最大的温度;
选择合适的压强:既要考虑化学反应速率和化学平 衡,还要考虑动力、材料、设备等。
【小结 ·反思】
N +H 干燥
净化
N +H NH +N +H
冷却
液态NH NH +N +H
三、合成氨的生产流程
(一)生产流程
压缩机
加压
10~30 MPa
铁触媒
400~500℃
热交换
-WWWWW 一
N +H
N +H
N +H
机
缩 压 环 循
液氨
氨分离器
m Ⅲ m
水冷器
循环气体
合成氨流程简图
压缩机
氢氮混合气
合 成 塔
随堂练习
合成氨工业有下列流程:①原料气制备;② 氨的合成;③原料气净化和压缩;④氨的分 离。其先后顺序为( B )
A.①②③④ B.①③②④
C.④③②① D.②③④①
随堂练习
NH 是一种重要的工业原料。下列关于合成氨的说法中,不正确 的是( D )
A. 工艺涉及催化技术
B. 工艺涉及高温高压技术
C. 原料之一的氮气来自空气
D.从合成塔出来的气体中,氨的体积分数为100%
(二)流程分析
1、原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质, 防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性
2、压缩机加压:增大压强
3、热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为 原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
4、冷 却 :生成物NH 的液化需较低温度采取迅速冷却的方法,
可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平 衡向生成NH 的方向移动。
5、循环使用原料气:因合成氨反应为可逆反应,平衡混合物中 含有原料气,将NH 分离后的原料气循环利用,并及时补充N 和 H , 使反应物保持一定的浓度,以利于合成氨反应,提高经济效
益。
四 、影响化学反应进行的两个因素
(一)参加反应的物质组成、结构和性质等本身因素
(二)温度、压强、浓度、催化剂等反应条件
五、化学反应的调控
1、定 义 :就是通过改变反应条件使一个可能发生的反应按照 某一方向进行。
2、考 虑 因 素 :在实际生产中常常需要结合设备条件、安全操 作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的 因素,寻找适宜的生产条件。此外,还要根据环境保护及社会效 益等方面的规定和要求做出分析,权衡利弊,才能实施生产。
3、控制反应条件的目的
(1)促进有利的化学反应:通过控制反应条件,可以加快化学反应 速率,提高反应物的转化率,从而促进有利的化学反应进行。
(2)抑制有害的化学反应:通过控制反应条件,也可以减缓化学反 应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而 抑制有害的化学反应继续进行。
4、控制反应条件的基本措施
(1)控制化学反应速率的措施:通过改变反应体系的温度、溶 液的浓度、气体的压强(或浓度)、固体的表面积以及使用催化 剂等途径调控反应速率。
(2)提高转化率的措施:通过改变可逆反应体系的温度、溶液 的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提
高转化率。
判断正误(正确的打“ √ ”,错误的打“×”)
(1)温度越高越利于合成氨反应平衡正向移动。( × )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。(√ )
(3)使用催化剂能提高合成氨反应物的平衡转化率。( × )
(4)充入的N 越多越有利于NH 的合成。( × )
(5)恒容条件下充入稀有气体有利于NH 的合成。 ( ×)
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。
( ×)
随堂练习
某工业生产中发生反应:2A(g)+B(g)=2M(g)△H<0。 下列有关该工业
生产的说法正确的是( D )
A.工业上合成M 时,一定采用高压条件,因为高压有利于M 的生成
B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率 C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
感 谢 您 的 观 看
第四节
化学反应的调控
你主要应考虑哪些问题
1、经济效益
2、社会效益
思考:假如你是一个化工厂的老板对工业生产
单位时间里提高合成氨的产量
(从化学反应的速率考虑)
提高平衡混合物中氨的含量
(从化学平衡的移动考虑)
从生产成本、动力、材料、设备等对上述 理论探讨进一步论证,以得出合理的结论。
提 高 综 合 经 济 效 益
理 论 实际
不记得吗
1、影响化学反应速率的因素有哪些
反应物表面积、反应物浓度、温度、能引起气体 反应物浓度改变的压强、催化剂
2、影响化学平衡移动的因素有哪些
浓度、压强、温度
勒夏特列原理:如果改变影响平衡的一个条件(如 浓度、压强或温度等),平衡就向能够减弱这种改 变的方向移动。
1. 合成氨反应的特点
合成氨反应:N (g)+3H (g)=2NH (g)
已知298 K 时:△H=-92.4 kJ ·mol-1,
△S=-198.2 J·mol-1.K-1
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:△H<0, 熵变:△S<0。
(4)自发性:常温(298 K)下,△H-T△S < 0, 能自发进行
【交流 ·研讨】
工业合成氨时主要考虑的因素
(1) 多 即提高平衡混合物里氨的含量
——化学平衡问题
(2) 快 即提高单位时间里氨的产量
——化学反应速率问题
(3) 便宜 降低成本,提高原料利用率。
(4) 绿色 保护环境,对设备的要求。
增大N 、H 的浓度 其物质的量 之比为1:3时 NH 的含量最高
及 时 转 移 走 N H
根据此反应特点分析,什么条件有利于合成氨
1:1 1:2 1:3 1:4 1:5 1:6N2:H
0.6
0.5
0.4 0.3 0.2
0.1
【交流 ·研讨】~多
NH3%
NH 含 压强 量/% MPa 温度1℃
压强增 氨 的含量
寒的含
主 重
低
达到平衡时平衡混合物中NH 的含量体积分数) [V(N ):V(H )=1:3]
及时转移走NH
低温
高压
无影响
【交流 ·研讨】~多
根据此反应特点分析,什么条件有利于合成氨
增大N 、H 的浓度,提高氢气压强更有利
于提高反应速率,其物质的量之比应<1:3
及时转移走NH
高温
高压
正催化剂
【交流 ·研讨】~快
根据此反应特点分析,什么条件有利于提高合成氨 的速率
外界条件 使NH 生产得快 使NH 生产得多
理论选择 适宜条件
速率分析 平衡分析
反应物 的浓度 增大浓度 增大浓度
增大浓度
压强 高压 高压
高压
催化剂 使用 无影响
温度 高温 矛盾 低温
合成氨的适宜条件的选择
( 一 )压强:
合成氨厂一般采用的压强
为10 MPa~30 Mpa。
【思考1】合成氨时压强越大越好,为何不 采用比30 MPa 更大的压强
提示:压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,
这会加大生产投资,可能降低综合经济效益。
压 强 /MPa
图2-11400℃下平衡时氨的体积分数随压强的变化示意图
压强的选择一成本与效益的博弈
NH 的体积分数/%
图2-1210 MPa 下平衡时氨的体积分数随温度的变化示意图
提示:温度太低,反应速率太小,达到平衡所需的时间变长,不经济。升高温度, 转化率降低,另外,合成氨所需的催化剂铁触媒的活性在500 ℃左右活性最
大。
一般采用的温度为400~500℃ 。
【思考2】合成氨采用低温时可提高
转化率,但为何未采用更低的温度
温度的选择—快与少、慢与多的权衡
NH,的体积分数/%
温度/℃
随堂练习
工业上合成氨一般采用400~500℃的温度,其原因是( D )
①适当提高氨的合成速率②提高H 的转化率③提高氨的产 率④催化剂在500 ℃左右活性最大
A.只有① B.只有①②
C.②③④ D.只有①④
(三)催化剂:
目前,合成氨工业中普遍使用的是以铁为主体的多成分催化剂, 又称铁触媒。
铁触媒在500℃左右时的活性最大,这也是合成氨一般选择 400~500℃进行的重要原因。
另外,为了防止混有的杂质使催化剂“中毒”,原料气必须经过 净化。
使用催化剂可使合成氨反应的速率提高上 万 亿倍
(四)浓度:
采取迅速冷却的方法,使气态氨变成液氨后及时从平衡混合物中分 离出去,以促使化学平衡向生成NH 的方向移动。此外,如果让N 和H 的混合气体只一次通过合成塔发生反应也是很不经济的,应将NH 分离 后的原料气循环使用,并及时补充N 和H , 使反应物保持一定的浓度,以 利于合成氨反应。
【思考】合成氨工业采用迅速冷却法,使气态氨变为液氨后及时从混合物中 分离出去的目的是什么
提示:使化学平衡向生成氨的方向移动。
适宜条件
随堂练习
利用原料气在合成塔中合成NH , 为提高N 的转化率所采取的措 施是( B )
A.高温 B.高压
C.使用催化剂 D.增大N 的浓度
随堂练习
有关合成氨工业的说法中,正确的是( B )
A.增大H 的浓度,可提高H 的转化率
B.由于氨易液化,N 、H 在实际生产中会循环使用,所以总体来说氨的 产率很高
C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正 反应方向移动
D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的
活性最大
工业上利用某可逆反应生产产品:
一般要使用催化剂:这样可以大大加快化学反应速 率,提高生产效率,也提高了经济效益;
选择合适的温度:该温度是催化剂活性最大的温度;
选择合适的压强:既要考虑化学反应速率和化学平 衡,还要考虑动力、材料、设备等。
【小结 ·反思】
N +H 干燥
净化
N +H NH +N +H
冷却
液态NH NH +N +H
三、合成氨的生产流程
(一)生产流程
压缩机
加压
10~30 MPa
铁触媒
400~500℃
热交换
-WWWWW 一
N +H
N +H
N +H
机
缩 压 环 循
液氨
氨分离器
m Ⅲ m
水冷器
循环气体
合成氨流程简图
压缩机
氢氮混合气
合 成 塔
随堂练习
合成氨工业有下列流程:①原料气制备;② 氨的合成;③原料气净化和压缩;④氨的分 离。其先后顺序为( B )
A.①②③④ B.①③②④
C.④③②① D.②③④①
随堂练习
NH 是一种重要的工业原料。下列关于合成氨的说法中,不正确 的是( D )
A. 工艺涉及催化技术
B. 工艺涉及高温高压技术
C. 原料之一的氮气来自空气
D.从合成塔出来的气体中,氨的体积分数为100%
(二)流程分析
1、原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质, 防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性
2、压缩机加压:增大压强
3、热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为 原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
4、冷 却 :生成物NH 的液化需较低温度采取迅速冷却的方法,
可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平 衡向生成NH 的方向移动。
5、循环使用原料气:因合成氨反应为可逆反应,平衡混合物中 含有原料气,将NH 分离后的原料气循环利用,并及时补充N 和 H , 使反应物保持一定的浓度,以利于合成氨反应,提高经济效
益。
四 、影响化学反应进行的两个因素
(一)参加反应的物质组成、结构和性质等本身因素
(二)温度、压强、浓度、催化剂等反应条件
五、化学反应的调控
1、定 义 :就是通过改变反应条件使一个可能发生的反应按照 某一方向进行。
2、考 虑 因 素 :在实际生产中常常需要结合设备条件、安全操 作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的 因素,寻找适宜的生产条件。此外,还要根据环境保护及社会效 益等方面的规定和要求做出分析,权衡利弊,才能实施生产。
3、控制反应条件的目的
(1)促进有利的化学反应:通过控制反应条件,可以加快化学反应 速率,提高反应物的转化率,从而促进有利的化学反应进行。
(2)抑制有害的化学反应:通过控制反应条件,也可以减缓化学反 应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而 抑制有害的化学反应继续进行。
4、控制反应条件的基本措施
(1)控制化学反应速率的措施:通过改变反应体系的温度、溶 液的浓度、气体的压强(或浓度)、固体的表面积以及使用催化 剂等途径调控反应速率。
(2)提高转化率的措施:通过改变可逆反应体系的温度、溶液 的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提
高转化率。
判断正误(正确的打“ √ ”,错误的打“×”)
(1)温度越高越利于合成氨反应平衡正向移动。( × )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。(√ )
(3)使用催化剂能提高合成氨反应物的平衡转化率。( × )
(4)充入的N 越多越有利于NH 的合成。( × )
(5)恒容条件下充入稀有气体有利于NH 的合成。 ( ×)
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。
( ×)
随堂练习
某工业生产中发生反应:2A(g)+B(g)=2M(g)△H<0。 下列有关该工业
生产的说法正确的是( D )
A.工业上合成M 时,一定采用高压条件,因为高压有利于M 的生成
B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率 C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
感 谢 您 的 观 看
