【高中化学】杂化轨道理论 课件 高二化学人教版(2019)选择性必修2(共27张PPT)
文档属性
| 名称 | 【高中化学】杂化轨道理论 课件 高二化学人教版(2019)选择性必修2(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 651.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 20:39:59 | ||
图片预览


文档简介
(共27张PPT)
高二化学
第二章原子结构与性质 第二节分子的空间结构
第3课时杂化轨道理论
新人教化学选择性必修2《物质结构与性质》
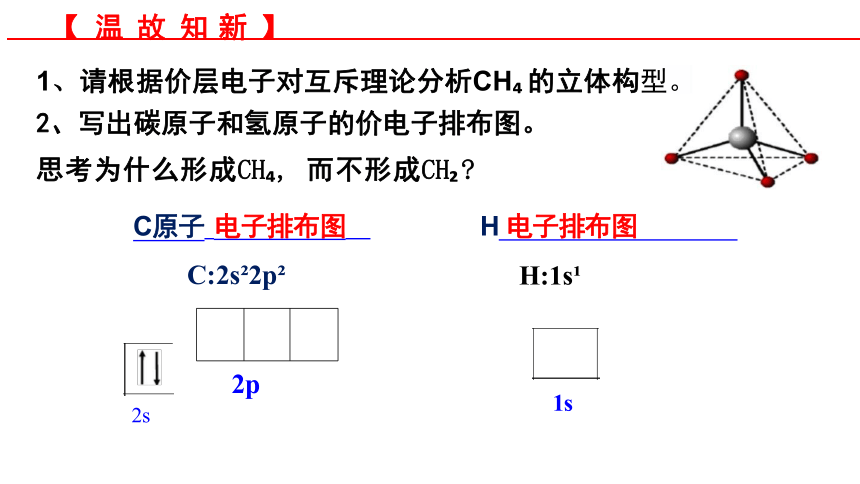
1、请根据价层电子对互斥理论分析CH 的立体构型。
2、写出碳原子和氢原子的价电子排布图。
思考为什么形成CH , 而不形成CH
C原子 电子排布图 H 电子排布图
C:2s 2p H:1s
【 温 故 知 新 】
2p
1s
2s
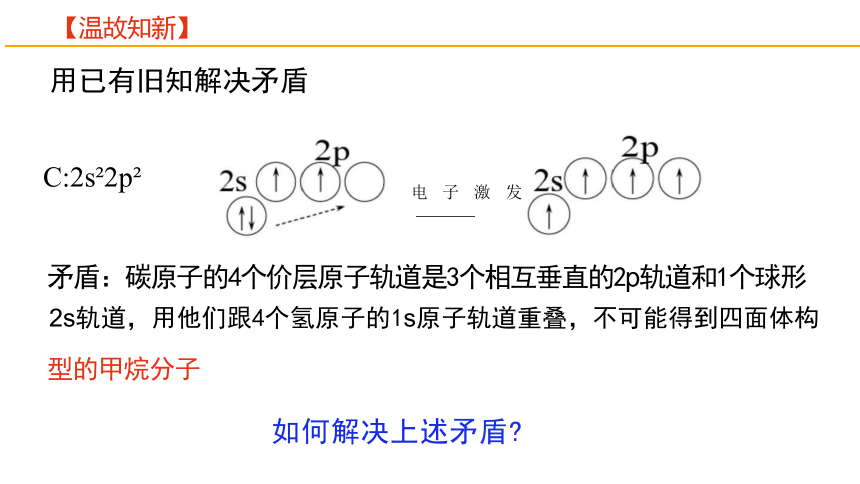
矛盾:碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形
2s轨道,用他们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构
型的甲烷分子
如何解决上述矛盾
用已有旧知解决矛盾
【温故知新】
C:2s 2p
电 子 激 发
在形成分子(化学键)时,由于
原子的相互影响,若干不同类型能量 相近的原子轨道混合起来,重新组合 成一组新轨道的过程叫做杂化。所形 成的新轨道就称为杂化轨道。
【学习任务一】初识杂化轨道理论
杂化轨道理论简介——鲍林(bào lín)
鲍林为解释分子的立体 构型提出杂化轨道理论
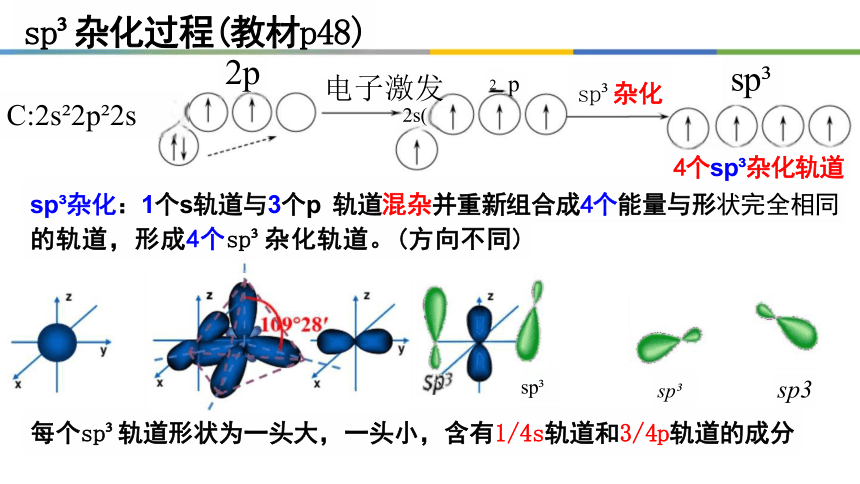
杂化
4个sp 杂化轨道
sp 杂化:1个s轨道与3个p 轨道混杂并重新组合成4个能量与形状完全相同 的轨道,形成4个sp 杂化轨道。(方向不同)
每个sp 轨道形状为一头大,一头小,含有1/4s轨道和3/4p轨道的成分
2p
C:2s 2p 2s
sp 杂化过程(教材p48)
电子激发 2s(
sp sp3
sp 杂化
sp
2 p
sp
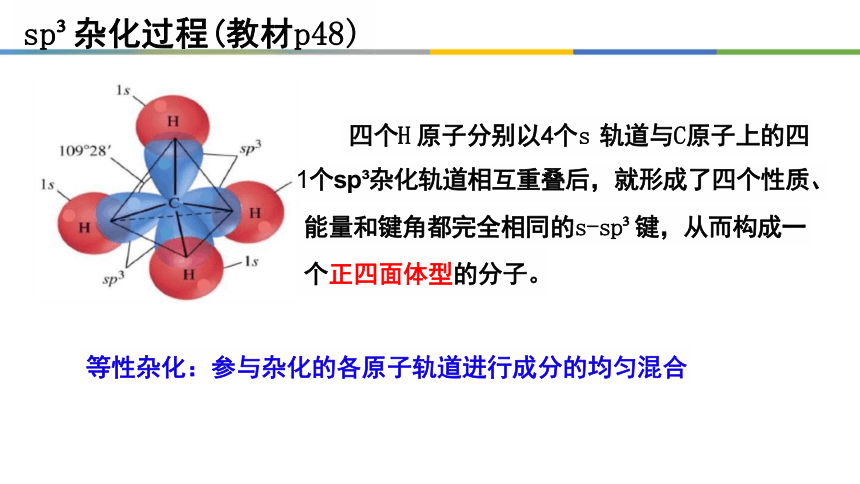
四个H 原子分别以4个s 轨道与C原子上的四
1个sp 杂化轨道相互重叠后,就形成了四个性质、 能量和键角都完全相同的s-sp 键,从而构成一 个正四面体型的分子。
等性杂化:参与杂化的各原子轨道进行成分的均匀混合
sp 杂化过程(教材p48)
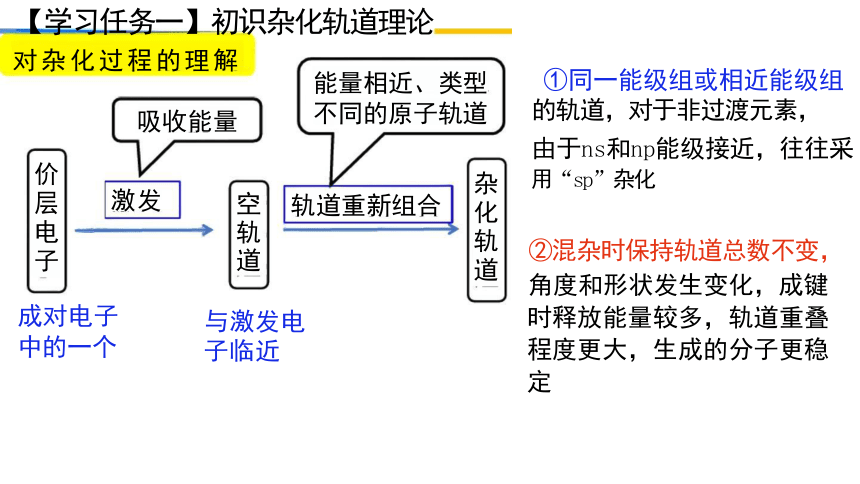
【学习任务一】初识杂化轨道理论
对杂化过程的理解
吸收能量
轨道重新组合
成对电子
中的一个
①同一能级组或相近能级组
的轨道,对于非过渡元素,
由于ns和np能级接近,往往采 用“sp”杂化
②混杂时保持轨道总数不变,
角度和形状发生变化,成键 时释放能量较多,轨道重叠 程度更大,生成的分子更稳 定
能量相近、类型 不同的原子轨道
与激发电 子临近
杂化轨道
价层电子
空轨道
激发
中心原子核外 电子排布式 价层电子对数 杂化轨道数 中心原子 杂化类型
空间构型
NH 1s 2s 2p 4 4 sp
三角锥形
H O 1s 2s 2p 4 4 sp
v形
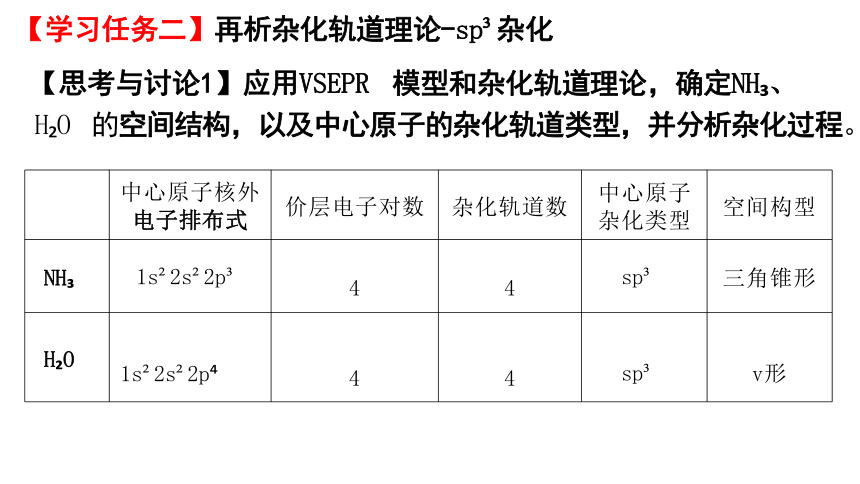
【学习任务二】再析杂化轨道理论-sp 杂化
【思考与讨论1】应用VSEPR 模型和杂化轨道理论,确定NH 、
H O 的空间结构,以及中心原子的杂化轨道类型,并分析杂化过程。
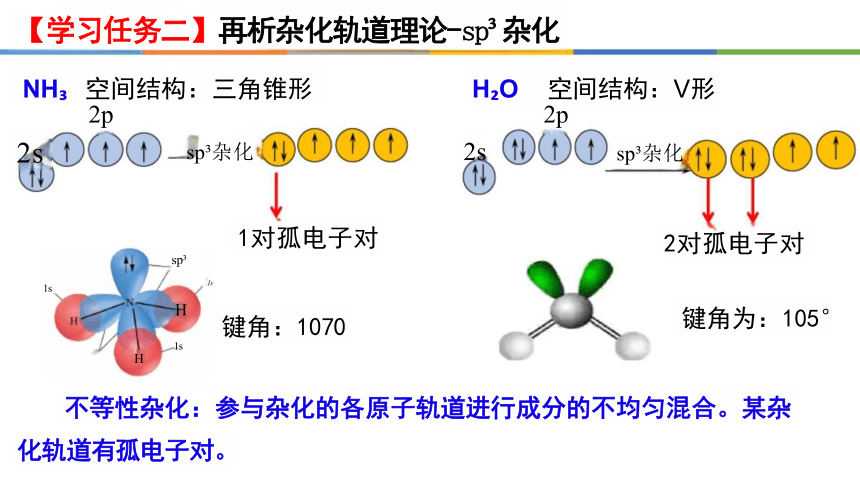
【学习任务二】再析杂化轨道理论-sp 杂化
NH 空间结构:三角锥形 H O 空间结构:V形
2p 2p
2s sp 杂化 2s sp 杂化
1s
sp H
不等性杂化:参与杂化的各原子轨道进行成分的不均匀混合。某杂 化轨道有孤电子对。
2对孤电子对
键角为:105°
1对孤电子对
键角:1070
sp
H
1s
Is
①杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。
②杂化轨道数= 价层电子对数
=中心原子孤电子对数+中心原子σ键电子对数
小结:中心原子的杂化类型与VSEPR模型的关系
中心原子核外 电子排布式 价层电子对数 杂化轨道数 中心原子 杂化类型
空间构型
BF 1s 2s 2p 3 3
平面三角形
BeCl 1s22s2 2 2
直线形
【学习任务三】初探杂化轨道理论-sp 、sp 杂化
【思考与讨论2】应用VSEPR 模型和杂化轨道理论,分析并确定
BF 、BeCl 的空间结构,预 测中心原子的杂化轨道类型。
3个sp 杂化轨道
sp 杂化:1个s轨道与2个p 轨道混杂并重新组合成3个能量与形状完全相同 的轨道,形成3个sp 杂化轨道。(方向不同)
每个sp 轨道形状为一头大,一头小,含有1/3 s轨道和2/3p轨道的成分
sp 杂化过程(教材p48)
2p 2s
电 子 激 发 2s(
B:2s 2p
sp 杂化
sp 2
2p
sp
sp
【学习任务三】初探杂化轨道理论-sp 、sp杂化
sp 杂化轨道——BF 分子的形成
120°
sp
sp
与F成键
sp
sp杂化过程(教材p48)
sp杂化 sp
2s
Be:2s2
2个sp杂化轨道
sp 杂化:1个s轨道与1个p轨道混杂并重新组合成2个能量与形状完全相同
的轨道,形成2个sp 杂化轨道。(方向不同)
180°
每个sp 轨道形状为一头大,一头小,含有1/2 s轨道和1/2p轨道的成分
电子激发 2p
2s(
Sp Sp
2p
【学习任务三】初探杂化轨道理论-sp 、sp 杂化
sp杂化轨道——BeCl 分子的形成
与Cl成键
价层电子对数
VSEPR 模型
杂化轨道数目 2 3
4
空间结构 直线形 平面三角形
正四面体形或三角锥形
杂化轨道之间夹角 180° 120°
109°28'
杂化类型 sp sp
sp
方法2:杂化轨道的空间分布判断杂化轨道类型。
方法1:根据杂化轨道数目判断杂化轨道类型。
杂化轨道类型
分子空间结构
确定中心原子的杂化轨道类型的方法(活力满分P46):
价层电子 互斥理论
杂化 轨道 理论
解释
预测
代表物 杂化轨道数=中心原子孤 对电子对数+σ键电子对 杂化轨道 类型 VS EPR模型 名称
分子的立体构型
(略去孤电子对)
CO 0+2=2 sp 直线形
直线形
CH O 0+3=3 sp 平面三角形
平面三角形
SO 1+2=3 sp 平面三角形
V形
SO - 0+4=4 sp 正四面体形
正四面体形
NH + 0+4=4 sp 正四面体形
正四面体形
【课堂练习】杂化轨道类型与VSEPR 模型、分子的立体构型的关系
【学习任务四】杂化轨道理论的应用
请用杂化轨道理论分析乙烯成键轨道
sp 杂化轨道——CH =CH 分子中碳原子的杂化
电 子 sp 杂化
C 2s 2p p p p 跃迁 S p p p sp p
120°
未参与杂化的p轨道上的电子可用于形成π键
【学习任务四】杂化轨道理论的应用
sp 杂化轨道——CH =CH 分子中碳原子的杂化
π
乙烯分子中的π键
H
C C
H
乙烯分子中的σ键
H
C H
H
H
H
H
c
π
杂化轨道数目 4 3
2
空间结构 正四面体形或三角锥形 平面三角形
直线形
杂化轨道之间夹角 C-C C=C
-C=C-
有机物碳碳键类型 109°28' 120°
180°
杂化类型 sp sp
sp
方法3:有机物中碳原子杂化类型的判断方法
①饱和碳原子均采取sp 杂化,
②连接双键的碳原子均采取sp 杂化,
③连接三键的碳原子均采取sp杂化。
【学习任务四】杂化轨道理论的应用
思考与讨论3:请用杂化轨道理论分析乙炔(CH=CH) 成
键轨道
【学习任务四】杂化轨道理论的应用
sp杂化轨道——CH=CH分子中碳原子的杂化
电子 sp杂化 p p
跃迁 S p p p sp
Z Z
y
X x
Py Pz
sp杂化
C 2s 2p
S p p p
未参与杂化的p轨道可用于形成π键
Z
Px
x
S
【学习任务四】杂化轨道理论的应用
sp 杂化轨道 ——CH=CH分子中碳原子的杂化 π键
乙炔分子结构示意图
乙炔分子中的σ键
课堂小结
价层电 子对数 中心原子的杂 化轨道类型 VSEPR模 型名称 孤电子 对数 类型 分子的空间 构型
实例
2 Sp 直线形 0 2 直线形
3 sp 平面三角 形 0 V形
3 sp 1 2 平面三角形
SO
4 sp 正四面体 形 0 V形
CH
4 sp 1 3 三角锥形
NH
4 sp 2 正四面体形
H O
1. 判断正误(正确的打“ √”,错误的打“×”)
①价电子对之间的夹角越小,排斥力越小。(×)
②NH 分子的VSEPR模型与分子空间结构不一致。(√)
③五原子分子的空间结构都是正四面体形。(×)
④杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。( √)
⑤凡是中心原子采取sp 杂化轨道成键的分子,其空间结构都是正四面体形。 (×)
⑥凡AB 型的共价化合物,其中心原子A均采用sp 杂化轨道成键。(×)
课堂小结
课堂小结
2.在BrCH=CHBr分子中,C—Br键采用的成键轨道是(C)
A.sp-p
B.sp -s
C.sp -p
D.sp -p
3、化 合 物A 是 — 种 新 型 锅 炉 水 除 氧 剂 , 其 结 构 式 如 图 所 示 :
, 下 列 说 法 正 确 的 是(B) A. 碳、氮原子的杂化类型相同
B. 氮 原 子 与 碳 原 子 分 别 为sp 杂 化 与sp 杂 化
C.1molA 分 子 中 所 含 σ 键 为 1 0mol
D. 编 号 为a 的 氮 原 子 和 与 其 成 键 的 另 外 三 个 原 子 在 同 一 面 内
课堂小结
高二化学
第二章原子结构与性质 第二节分子的空间结构
第3课时杂化轨道理论
新人教化学选择性必修2《物质结构与性质》
1、请根据价层电子对互斥理论分析CH 的立体构型。
2、写出碳原子和氢原子的价电子排布图。
思考为什么形成CH , 而不形成CH
C原子 电子排布图 H 电子排布图
C:2s 2p H:1s
【 温 故 知 新 】
2p
1s
2s
矛盾:碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形
2s轨道,用他们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构
型的甲烷分子
如何解决上述矛盾
用已有旧知解决矛盾
【温故知新】
C:2s 2p
电 子 激 发
在形成分子(化学键)时,由于
原子的相互影响,若干不同类型能量 相近的原子轨道混合起来,重新组合 成一组新轨道的过程叫做杂化。所形 成的新轨道就称为杂化轨道。
【学习任务一】初识杂化轨道理论
杂化轨道理论简介——鲍林(bào lín)
鲍林为解释分子的立体 构型提出杂化轨道理论
杂化
4个sp 杂化轨道
sp 杂化:1个s轨道与3个p 轨道混杂并重新组合成4个能量与形状完全相同 的轨道,形成4个sp 杂化轨道。(方向不同)
每个sp 轨道形状为一头大,一头小,含有1/4s轨道和3/4p轨道的成分
2p
C:2s 2p 2s
sp 杂化过程(教材p48)
电子激发 2s(
sp sp3
sp 杂化
sp
2 p
sp
四个H 原子分别以4个s 轨道与C原子上的四
1个sp 杂化轨道相互重叠后,就形成了四个性质、 能量和键角都完全相同的s-sp 键,从而构成一 个正四面体型的分子。
等性杂化:参与杂化的各原子轨道进行成分的均匀混合
sp 杂化过程(教材p48)
【学习任务一】初识杂化轨道理论
对杂化过程的理解
吸收能量
轨道重新组合
成对电子
中的一个
①同一能级组或相近能级组
的轨道,对于非过渡元素,
由于ns和np能级接近,往往采 用“sp”杂化
②混杂时保持轨道总数不变,
角度和形状发生变化,成键 时释放能量较多,轨道重叠 程度更大,生成的分子更稳 定
能量相近、类型 不同的原子轨道
与激发电 子临近
杂化轨道
价层电子
空轨道
激发
中心原子核外 电子排布式 价层电子对数 杂化轨道数 中心原子 杂化类型
空间构型
NH 1s 2s 2p 4 4 sp
三角锥形
H O 1s 2s 2p 4 4 sp
v形
【学习任务二】再析杂化轨道理论-sp 杂化
【思考与讨论1】应用VSEPR 模型和杂化轨道理论,确定NH 、
H O 的空间结构,以及中心原子的杂化轨道类型,并分析杂化过程。
【学习任务二】再析杂化轨道理论-sp 杂化
NH 空间结构:三角锥形 H O 空间结构:V形
2p 2p
2s sp 杂化 2s sp 杂化
1s
sp H
不等性杂化:参与杂化的各原子轨道进行成分的不均匀混合。某杂 化轨道有孤电子对。
2对孤电子对
键角为:105°
1对孤电子对
键角:1070
sp
H
1s
Is
①杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。
②杂化轨道数= 价层电子对数
=中心原子孤电子对数+中心原子σ键电子对数
小结:中心原子的杂化类型与VSEPR模型的关系
中心原子核外 电子排布式 价层电子对数 杂化轨道数 中心原子 杂化类型
空间构型
BF 1s 2s 2p 3 3
平面三角形
BeCl 1s22s2 2 2
直线形
【学习任务三】初探杂化轨道理论-sp 、sp 杂化
【思考与讨论2】应用VSEPR 模型和杂化轨道理论,分析并确定
BF 、BeCl 的空间结构,预 测中心原子的杂化轨道类型。
3个sp 杂化轨道
sp 杂化:1个s轨道与2个p 轨道混杂并重新组合成3个能量与形状完全相同 的轨道,形成3个sp 杂化轨道。(方向不同)
每个sp 轨道形状为一头大,一头小,含有1/3 s轨道和2/3p轨道的成分
sp 杂化过程(教材p48)
2p 2s
电 子 激 发 2s(
B:2s 2p
sp 杂化
sp 2
2p
sp
sp
【学习任务三】初探杂化轨道理论-sp 、sp杂化
sp 杂化轨道——BF 分子的形成
120°
sp
sp
与F成键
sp
sp杂化过程(教材p48)
sp杂化 sp
2s
Be:2s2
2个sp杂化轨道
sp 杂化:1个s轨道与1个p轨道混杂并重新组合成2个能量与形状完全相同
的轨道,形成2个sp 杂化轨道。(方向不同)
180°
每个sp 轨道形状为一头大,一头小,含有1/2 s轨道和1/2p轨道的成分
电子激发 2p
2s(
Sp Sp
2p
【学习任务三】初探杂化轨道理论-sp 、sp 杂化
sp杂化轨道——BeCl 分子的形成
与Cl成键
价层电子对数
VSEPR 模型
杂化轨道数目 2 3
4
空间结构 直线形 平面三角形
正四面体形或三角锥形
杂化轨道之间夹角 180° 120°
109°28'
杂化类型 sp sp
sp
方法2:杂化轨道的空间分布判断杂化轨道类型。
方法1:根据杂化轨道数目判断杂化轨道类型。
杂化轨道类型
分子空间结构
确定中心原子的杂化轨道类型的方法(活力满分P46):
价层电子 互斥理论
杂化 轨道 理论
解释
预测
代表物 杂化轨道数=中心原子孤 对电子对数+σ键电子对 杂化轨道 类型 VS EPR模型 名称
分子的立体构型
(略去孤电子对)
CO 0+2=2 sp 直线形
直线形
CH O 0+3=3 sp 平面三角形
平面三角形
SO 1+2=3 sp 平面三角形
V形
SO - 0+4=4 sp 正四面体形
正四面体形
NH + 0+4=4 sp 正四面体形
正四面体形
【课堂练习】杂化轨道类型与VSEPR 模型、分子的立体构型的关系
【学习任务四】杂化轨道理论的应用
请用杂化轨道理论分析乙烯成键轨道
sp 杂化轨道——CH =CH 分子中碳原子的杂化
电 子 sp 杂化
C 2s 2p p p p 跃迁 S p p p sp p
120°
未参与杂化的p轨道上的电子可用于形成π键
【学习任务四】杂化轨道理论的应用
sp 杂化轨道——CH =CH 分子中碳原子的杂化
π
乙烯分子中的π键
H
C C
H
乙烯分子中的σ键
H
C H
H
H
H
H
c
π
杂化轨道数目 4 3
2
空间结构 正四面体形或三角锥形 平面三角形
直线形
杂化轨道之间夹角 C-C C=C
-C=C-
有机物碳碳键类型 109°28' 120°
180°
杂化类型 sp sp
sp
方法3:有机物中碳原子杂化类型的判断方法
①饱和碳原子均采取sp 杂化,
②连接双键的碳原子均采取sp 杂化,
③连接三键的碳原子均采取sp杂化。
【学习任务四】杂化轨道理论的应用
思考与讨论3:请用杂化轨道理论分析乙炔(CH=CH) 成
键轨道
【学习任务四】杂化轨道理论的应用
sp杂化轨道——CH=CH分子中碳原子的杂化
电子 sp杂化 p p
跃迁 S p p p sp
Z Z
y
X x
Py Pz
sp杂化
C 2s 2p
S p p p
未参与杂化的p轨道可用于形成π键
Z
Px
x
S
【学习任务四】杂化轨道理论的应用
sp 杂化轨道 ——CH=CH分子中碳原子的杂化 π键
乙炔分子结构示意图
乙炔分子中的σ键
课堂小结
价层电 子对数 中心原子的杂 化轨道类型 VSEPR模 型名称 孤电子 对数 类型 分子的空间 构型
实例
2 Sp 直线形 0 2 直线形
3 sp 平面三角 形 0 V形
3 sp 1 2 平面三角形
SO
4 sp 正四面体 形 0 V形
CH
4 sp 1 3 三角锥形
NH
4 sp 2 正四面体形
H O
1. 判断正误(正确的打“ √”,错误的打“×”)
①价电子对之间的夹角越小,排斥力越小。(×)
②NH 分子的VSEPR模型与分子空间结构不一致。(√)
③五原子分子的空间结构都是正四面体形。(×)
④杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。( √)
⑤凡是中心原子采取sp 杂化轨道成键的分子,其空间结构都是正四面体形。 (×)
⑥凡AB 型的共价化合物,其中心原子A均采用sp 杂化轨道成键。(×)
课堂小结
课堂小结
2.在BrCH=CHBr分子中,C—Br键采用的成键轨道是(C)
A.sp-p
B.sp -s
C.sp -p
D.sp -p
3、化 合 物A 是 — 种 新 型 锅 炉 水 除 氧 剂 , 其 结 构 式 如 图 所 示 :
, 下 列 说 法 正 确 的 是(B) A. 碳、氮原子的杂化类型相同
B. 氮 原 子 与 碳 原 子 分 别 为sp 杂 化 与sp 杂 化
C.1molA 分 子 中 所 含 σ 键 为 1 0mol
D. 编 号 为a 的 氮 原 子 和 与 其 成 键 的 另 外 三 个 原 子 在 同 一 面 内
课堂小结
