【新教材】配制一定物质的量浓度溶液 课件【新教材】人教版(2019)高中化学必修一(共31张PPT)
文档属性
| 名称 | 【新教材】配制一定物质的量浓度溶液 课件【新教材】人教版(2019)高中化学必修一(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 00:00:00 | ||
图片预览








文档简介
(共31张PPT)
配制一定物质的量浓度的溶液
初中是如何配制一定质量分数的溶
液的
计算、称量、溶解
如何配制100mL 0.1 mol/L Na CO 溶液
思考 交流
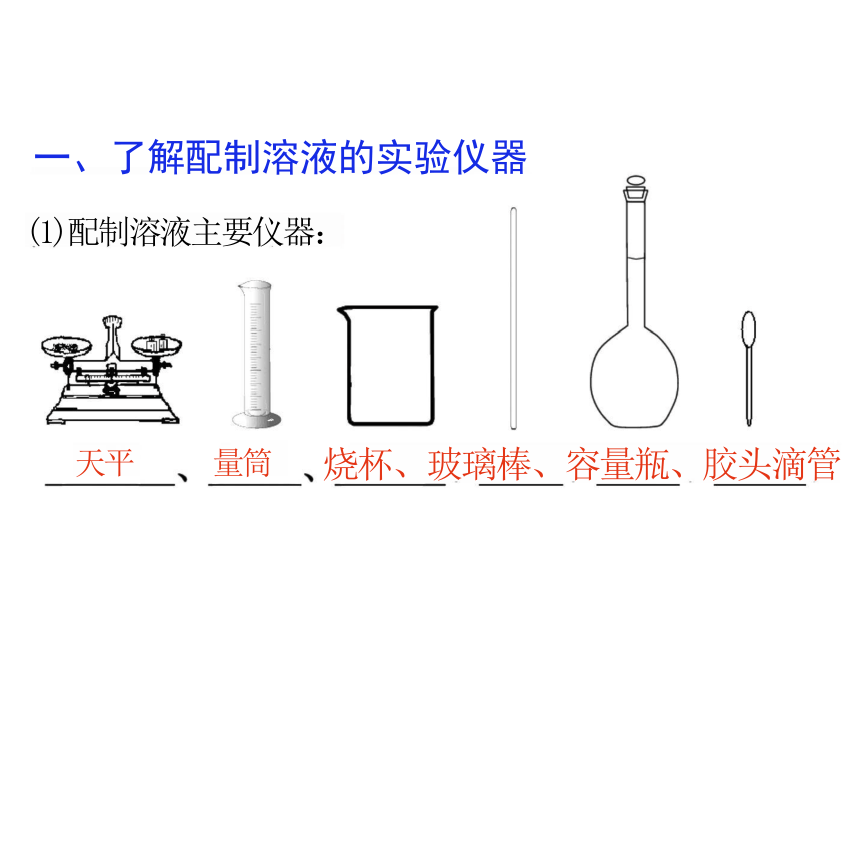
一、了解配制溶液的实验仪器
(1)配制溶液主要仪器:
天平 量筒 烧杯、玻璃棒、容量瓶、胶头滴管
1.构造:细颈、平底玻璃瓶,
瓶口配有磨口玻璃塞
2.特点:①瓶身标有温度和容积
②瓶颈标有刻度线
一、配制溶液的实验仪器
(2)认识容量瓶(常见规格)
3.使用范围:准确控制配制溶液的体积
(容量瓶是量器不是容器)
①使用前要检查是否漏水
②溶解(或稀释)的操作不能在容量瓶中进行
③不能长期存放溶液或进行化学反应
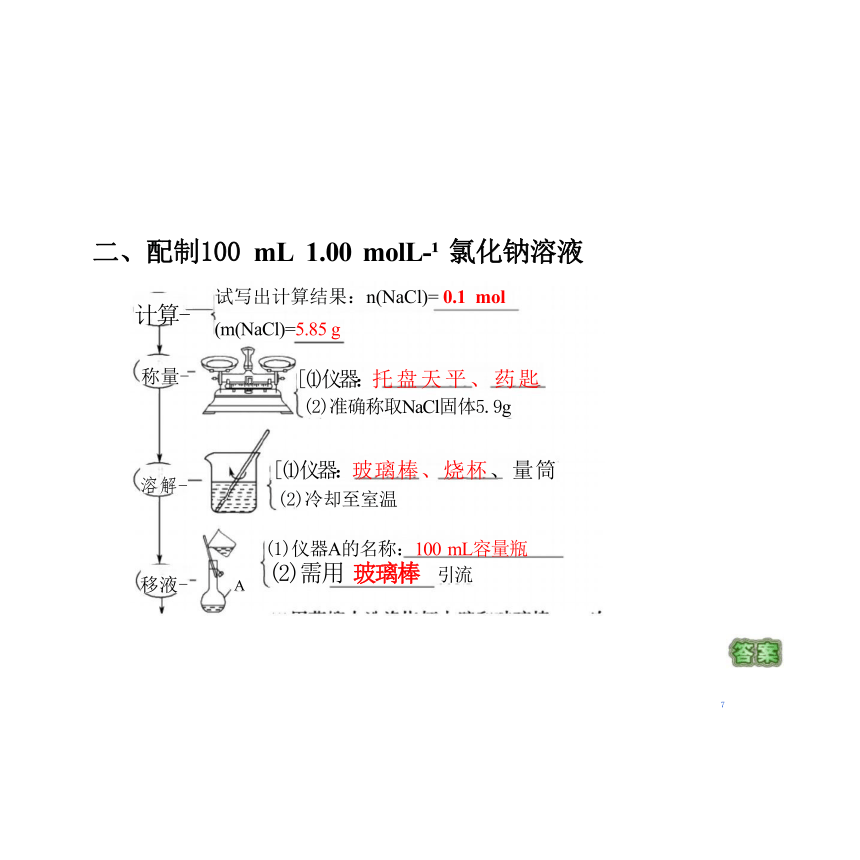
试写出计算结果:n(NaCl)= 0.1 mol
(m(NaCl)=5.85 g
[(1)仪器:托盘天平、药匙
(2)准确称取NaCl固体5.9g
[(1)仪器:玻璃棒、烧杯、量筒
(2)冷却至室温
(1)仪器A的名称:100 mL容量瓶
(2)需用 玻璃棒 引流
二、配制100 mL 1.00 molL- 氯化钠溶液
计算-
称量-
溶解-
移液-
A
7
实验过程
实验操作
计算
根据稀释定律c V =c V ,计算所需1.00 mol-L- NaCl溶液的体积为50.0 mL
量取
用量筒量取50.0 mL1.00mol-L- NaCl溶液并注入烧杯
配制
向盛有1.00 mol-L- NaCl溶液的烧杯中加入20 mL蒸馏水,用玻璃棒慢慢搅
动,使其混合均匀。将烧杯中的溶液沿玻璃棒注入容量瓶。用少量蒸馏水洗
涤烧杯内壁和玻璃棒2~3次,并将洗涤液也都注入容量瓶。继续向容量瓶中
加入蒸馏水,直到液面在刻度线以下1~2 cm时,改用胶头滴管滴加蒸馏水,至 液面与刻度线相切。盖好容量瓶瓶塞,反复上下颠倒,摇匀
分装
将配制好的100 mL 0.50 mol-L-1 NaCl溶液倒入指定的容器中
2.用1.00 mol-L- NaCl溶液配制100 mL 0.50 mol-L- NaCl溶液
3、误差分析
原理依据:
其它正常时,
凡是使m或n 增大的因素都使c偏大; 凡是使m或n减小的因素,都使c 偏 小; 凡是使V增大的因素,都使c偏小;
凡是使V减小的因素,都使c偏大。
引起误差的操作 m V
C
称取时间过长或用滤纸盛放 偏小 不变
偏小
向容量瓶注液时少量流出 偏小 不变
偏小
未洗涤烧杯内壁和玻璃棒 偏小 不变
偏小
未冷却至室温而注入定容 不变 偏小
偏大
3、溶液配制的误差分析 原理依据:
根据c=n/V 分析(以配制某浓度NaOH 溶液为 例,请同学们将c 的结果填入表中)
引起误差的操作 m V
C
定容时加水过量用滴管吸 出 偏小 不变
偏小
定容时仰视刻度线 不变 偏大
偏小
定容时俯视刻度线 不变 偏小
偏大
定容摇匀后液面下降又加 水 不变 偏大
偏小
容量瓶在使用前,用蒸馏水 洗净,在瓶内有少量水残留 不变 不变
不变
【实验反思】
问题1:配制溶液前,容量瓶洗涤后残留少量蒸馏水,对所配溶 液的浓度有何影响
[答案]分析:配制溶液时,在定容步骤要加入蒸馏水,故配制 前容量瓶中残留少量蒸馏水,对所配溶液的浓度无影响。
问题2:实验过程中,忘记洗涤烧杯和玻璃棒,对所配溶液的浓 度有何影响
[答案]分析:溶解固体过程中,烧杯及玻璃棒上均沾有溶质, 忘记洗涤烧杯和玻璃棒,会损失溶质,导致所配溶液的浓度 偏低。
问题3:定容时,滴加蒸馏水超过刻度线,又迅速用滴管吸出多
余溶液,对所配溶液的浓度有何影响
[答案]分析:定容时,滴加蒸馏水超过刻度线,又迅速用滴管 吸出多余溶液,溶液中含有溶质,会使所配溶液的浓度偏低。
问题4:摇匀后,发现液面低于刻度线,又重新滴加蒸馏水至刻 度线,对所配溶液的浓度有何影响
[答案]分析:摇匀后,部分液体附着在容量瓶刻度线以上部 分,重新滴加蒸馏水至刻度线,待液体回流后,液面会高于刻 度线,故使所配溶液的浓度偏低。
【实验评价】
1.实验室需要用480 mL0.1 mol-L-1的 硫酸铜溶液,以下配制方法正确的是 ( )
A.称取12.5 g 胆矾(CuSO ·5H O),配成
500 mL溶液
B.称取12.5 g 胆矾(CuSO ·5H O),加入
500 mL水配成溶液
C.称取7.68 g无水硫酸铜粉末,加入480 mL水配成溶液
D.称取8.0 g无水硫酸铜粉末,加入500 mL 水配成溶液
[解析]取500 mL 容量瓶配制
0.1 mol-L- CuSO 溶液,称取胆 矾的质量为0.1 mol-L- ×0.5
L×250 g ·mol- =12.5 g,称取无水 硫酸铜粉末的质量为0.1 mol-L- 1×0.5 L×160 g ·mol- =8.0 g,最后 要加水配成500 mL 溶液。
2.用36.5%的浓盐酸(密度1.2 g·cm-3)
配制100 mL1 mol-L- 的稀盐酸,配 制过程需用到哪些仪器,且先后顺序 正确的是(B)
①100 mL量筒 ②10 mL量筒
③50 mL烧杯 ④托盘天平
⑤100 mL容量瓶⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②⑥③
⑦⑤⑥
C.③⑤⑦⑥① D.④③⑦
12 mol·L-1,配制100 mL 1 mol-L- 的稀
盐酸,据“稀释定律”可得:12 mol ·L- × V(浓盐酸)=0.1 L×1 mol-L-1,则有
V(浓盐酸)≈8.3 mL, 应选取10 mL 量筒
[解析]密度为1.2g ·cm- 、36.5%的 浓
盐酸的物质的量浓度为c(HC1)=
⑤⑥
3.某同学在配制100 mL 0.5 mol-L-1的
NaOH 溶液时有以下实验操作,其中会 导致所配制的溶液浓度偏高的是(
A.未冷却到室温就注入容量瓶定容
B.定容后,经振荡、摇匀、静置,液面下 降再加水
C. 配好的溶液转入干净的试剂瓶时,不 慎溅出部分溶液
D.向容量瓶转移溶液时有少量液体流
[解析]未冷却至室温就注入 容量瓶并马上定容,导致溶液 体积偏小,浓度偏高,A正确; 定容后,轻轻振荡、摇匀、静 置,液面下降再加水,导致v偏 大,则配制的溶液浓度偏低, B错误;
出
4.用质量分数为36.5%的浓盐酸(密度为 1.16 g·cm-3)
配制成1 mol-L-1的稀盐酸。现实验室仅需要这种盐酸 220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用规格为 250 mL
的容量瓶。
11.6 mol-L- ,设需要浓盐酸的体积为VmL,根据溶液稀释定律c浓V浓=C稀V稀可知
11.6 mol-L- ×VmL=1 mol-L- ×250 mL,解得V=21.6。按照“大而近”的原则,根据需要量 取的浓盐酸的体积为21.6 mL来选择合适的量筒,故应选择25 mL量筒,故答案为C。
(2)经计算需 1.6 mL 浓盐酸,在量取时宜选用下列量筒
中的
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸冷却至室温后,沿玻璃棒注入容量瓶中。
② 往容量瓶中小心加蒸馏水至液面离容量瓶刻度线 1~2 cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与 瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合 均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容 量瓶。
上述操作中,正确的顺序是(填序号)_
(4)在上述配制过程中,用刚
刚洗涤洁净的量筒来量取浓 盐酸,其配制的稀盐酸浓度
偏 低 (填“偏高”“偏低”或
“无影响”)。若未用蒸馏水洗 涤烧杯内壁或未将洗涤液注 入容量瓶,则配制的稀盐酸浓 度 偏 低_ (填“偏高”“偏低”或 “无影响”)。
[解析]在上述配制过程中,用刚刚洗涤洁净 的量筒来量取浓盐酸,会将浓盐酸稀释,导
致所取的盐酸的量偏小,则其配制的稀盐酸 浓度偏低;若未用蒸馏水洗涤烧杯内壁或
未将洗涤液注入容量瓶,会造成溶质的损失, 则配制的稀盐酸浓度偏低。
5.某校化学实验小组欲帮助环保
局 配 制 4 8 0 mL0.5 mol·L-1的
NaOH 溶液,用于当
地水质检测。试回答相关问题: (1)该小组同学选择 500 mL的 容量瓶。
[解析]容量瓶的规格相对固定, 当所配制溶液的体积与容量瓶 规格不相符时,应选择规格比
所配制溶液体积稍大的容量瓶。
(2)其操作步骤如图(a)所示,则如图(b)所示操作应在图(a)中
的 c (填选项字母)之间。
A.②和③ B.①和② C.④和⑤ D.③和④
① ② ③ ④ ⑤ ⑥
(a)
[解析]根据溶液配制步骤:称量→溶解→转移→洗涤→定容→摇匀,结合图示步骤,向容 量瓶中直接加蒸馏水的操作应在洗涤之后、定容操作之前,即在④与⑤之间。
蒸馏水
(b)
(4)下列操作对所配制溶液的浓
度大小有何影响
①转移完溶液后未洗涤玻璃棒 和烧杯,浓度会 偏 小 (填“偏
大”“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水, 浓度会 无影响 0
解析]据c="可知,转移溶液后未 洗涤玻璃棒和烧杯,会使部分溶 质残留在玻璃棒和烧杯内壁上, 使n偏小,导致c偏小,而容量瓶中 有少量蒸馏水,则无影响。
课堂巩固练习
1.实验中需2 mol-L-1的Na CO 溶液950mL, 配制时
应选用的容量瓶的规格和称取Na CO 的质量分别是
A.1000mL,212g B.950mL,543.4g( A )
C. 任意规格,572g D.500mL,286g
2.用已准确称量过的氯化钠固体配制1.00 mol ·L-1的 NaCl溶液0.5L, 需要用的仪器是①坩埚②分液漏斗 ③容量瓶④烧杯⑤胶头滴管⑥烧瓶⑦玻璃棒⑧托盘 天平⑨药匙 ( C )
A.③④⑤⑦⑨ B.①②⑤⑥⑧
C.③④⑤⑦ D.③④⑤⑥
3.实验室用固体烧碱配制500mL0.1mol/LNaOH溶液。
(1)需称取2.0 g烧碱固体,固体应放在小烧杯中称量
(2)配制过程中一定不需要的仪器是 --0
A.烧 杯 B. 量筒 C.玻璃棒 D.1000mL容量瓶 E.锥形瓶 F. 胶头滴管 G.500mL试剂瓶
(3)根据实验的实验需要和(2)中列出的仪器判
断完成实验还缺少的仪器是 500mL容量瓶、天平
0
(4)在准确确定溶液体积过程中,完成后期加入
少量水的正确做法是 -0
向容量瓶中加蒸馏水,距刻度线1~2cm处,
改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度 线相切。
课堂小结
一 、容量瓶的构造特点
二、配制一定物质的量浓度溶液的步骤
1.计算 2.称量(或量取) 3.溶解
4.转移和洗涤5.定容6.摇匀7.装瓶贴签
三、误差分析
同学们再见
09/9/2088
100 mL
蒸馏水
NaCl
仰视刻度线,实际加水量超 过刻度线,使溶液的物质的 量浓度减小。
俯视刻度线,实际加水 未到刻度线,使溶液的 质的量浓度增大
·仰视
· 俯视
返回
配制一定物质的量浓度的溶液
初中是如何配制一定质量分数的溶
液的
计算、称量、溶解
如何配制100mL 0.1 mol/L Na CO 溶液
思考 交流
一、了解配制溶液的实验仪器
(1)配制溶液主要仪器:
天平 量筒 烧杯、玻璃棒、容量瓶、胶头滴管
1.构造:细颈、平底玻璃瓶,
瓶口配有磨口玻璃塞
2.特点:①瓶身标有温度和容积
②瓶颈标有刻度线
一、配制溶液的实验仪器
(2)认识容量瓶(常见规格)
3.使用范围:准确控制配制溶液的体积
(容量瓶是量器不是容器)
①使用前要检查是否漏水
②溶解(或稀释)的操作不能在容量瓶中进行
③不能长期存放溶液或进行化学反应
试写出计算结果:n(NaCl)= 0.1 mol
(m(NaCl)=5.85 g
[(1)仪器:托盘天平、药匙
(2)准确称取NaCl固体5.9g
[(1)仪器:玻璃棒、烧杯、量筒
(2)冷却至室温
(1)仪器A的名称:100 mL容量瓶
(2)需用 玻璃棒 引流
二、配制100 mL 1.00 molL- 氯化钠溶液
计算-
称量-
溶解-
移液-
A
7
实验过程
实验操作
计算
根据稀释定律c V =c V ,计算所需1.00 mol-L- NaCl溶液的体积为50.0 mL
量取
用量筒量取50.0 mL1.00mol-L- NaCl溶液并注入烧杯
配制
向盛有1.00 mol-L- NaCl溶液的烧杯中加入20 mL蒸馏水,用玻璃棒慢慢搅
动,使其混合均匀。将烧杯中的溶液沿玻璃棒注入容量瓶。用少量蒸馏水洗
涤烧杯内壁和玻璃棒2~3次,并将洗涤液也都注入容量瓶。继续向容量瓶中
加入蒸馏水,直到液面在刻度线以下1~2 cm时,改用胶头滴管滴加蒸馏水,至 液面与刻度线相切。盖好容量瓶瓶塞,反复上下颠倒,摇匀
分装
将配制好的100 mL 0.50 mol-L-1 NaCl溶液倒入指定的容器中
2.用1.00 mol-L- NaCl溶液配制100 mL 0.50 mol-L- NaCl溶液
3、误差分析
原理依据:
其它正常时,
凡是使m或n 增大的因素都使c偏大; 凡是使m或n减小的因素,都使c 偏 小; 凡是使V增大的因素,都使c偏小;
凡是使V减小的因素,都使c偏大。
引起误差的操作 m V
C
称取时间过长或用滤纸盛放 偏小 不变
偏小
向容量瓶注液时少量流出 偏小 不变
偏小
未洗涤烧杯内壁和玻璃棒 偏小 不变
偏小
未冷却至室温而注入定容 不变 偏小
偏大
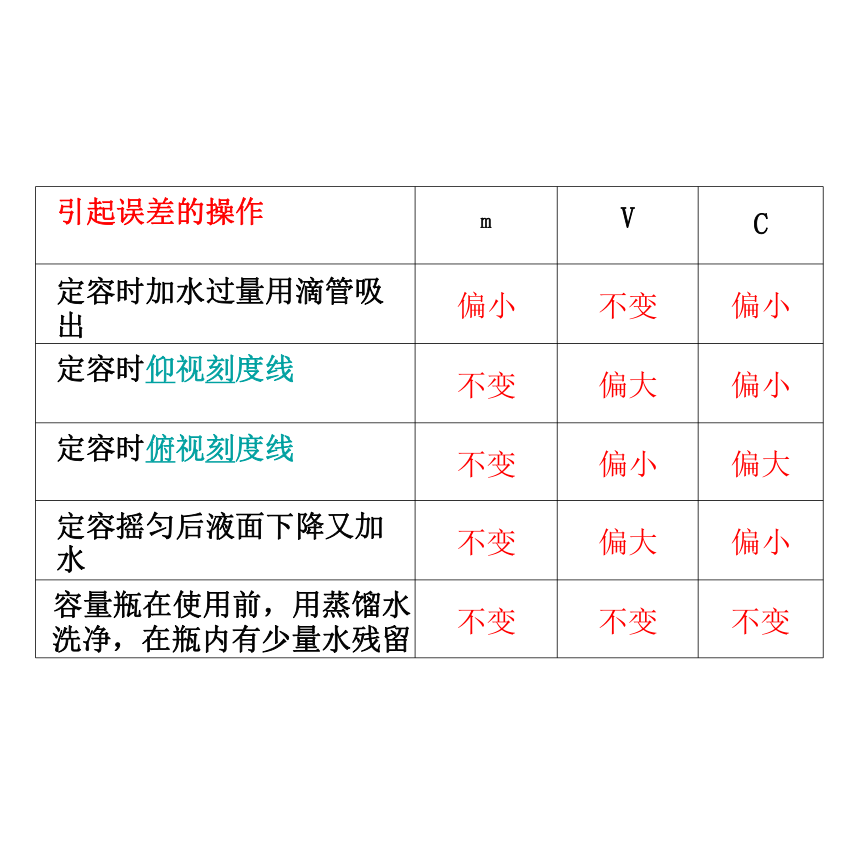
3、溶液配制的误差分析 原理依据:
根据c=n/V 分析(以配制某浓度NaOH 溶液为 例,请同学们将c 的结果填入表中)
引起误差的操作 m V
C
定容时加水过量用滴管吸 出 偏小 不变
偏小
定容时仰视刻度线 不变 偏大
偏小
定容时俯视刻度线 不变 偏小
偏大
定容摇匀后液面下降又加 水 不变 偏大
偏小
容量瓶在使用前,用蒸馏水 洗净,在瓶内有少量水残留 不变 不变
不变
【实验反思】
问题1:配制溶液前,容量瓶洗涤后残留少量蒸馏水,对所配溶 液的浓度有何影响
[答案]分析:配制溶液时,在定容步骤要加入蒸馏水,故配制 前容量瓶中残留少量蒸馏水,对所配溶液的浓度无影响。
问题2:实验过程中,忘记洗涤烧杯和玻璃棒,对所配溶液的浓 度有何影响
[答案]分析:溶解固体过程中,烧杯及玻璃棒上均沾有溶质, 忘记洗涤烧杯和玻璃棒,会损失溶质,导致所配溶液的浓度 偏低。
问题3:定容时,滴加蒸馏水超过刻度线,又迅速用滴管吸出多
余溶液,对所配溶液的浓度有何影响
[答案]分析:定容时,滴加蒸馏水超过刻度线,又迅速用滴管 吸出多余溶液,溶液中含有溶质,会使所配溶液的浓度偏低。
问题4:摇匀后,发现液面低于刻度线,又重新滴加蒸馏水至刻 度线,对所配溶液的浓度有何影响
[答案]分析:摇匀后,部分液体附着在容量瓶刻度线以上部 分,重新滴加蒸馏水至刻度线,待液体回流后,液面会高于刻 度线,故使所配溶液的浓度偏低。
【实验评价】
1.实验室需要用480 mL0.1 mol-L-1的 硫酸铜溶液,以下配制方法正确的是 ( )
A.称取12.5 g 胆矾(CuSO ·5H O),配成
500 mL溶液
B.称取12.5 g 胆矾(CuSO ·5H O),加入
500 mL水配成溶液
C.称取7.68 g无水硫酸铜粉末,加入480 mL水配成溶液
D.称取8.0 g无水硫酸铜粉末,加入500 mL 水配成溶液
[解析]取500 mL 容量瓶配制
0.1 mol-L- CuSO 溶液,称取胆 矾的质量为0.1 mol-L- ×0.5
L×250 g ·mol- =12.5 g,称取无水 硫酸铜粉末的质量为0.1 mol-L- 1×0.5 L×160 g ·mol- =8.0 g,最后 要加水配成500 mL 溶液。
2.用36.5%的浓盐酸(密度1.2 g·cm-3)
配制100 mL1 mol-L- 的稀盐酸,配 制过程需用到哪些仪器,且先后顺序 正确的是(B)
①100 mL量筒 ②10 mL量筒
③50 mL烧杯 ④托盘天平
⑤100 mL容量瓶⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②⑥③
⑦⑤⑥
C.③⑤⑦⑥① D.④③⑦
12 mol·L-1,配制100 mL 1 mol-L- 的稀
盐酸,据“稀释定律”可得:12 mol ·L- × V(浓盐酸)=0.1 L×1 mol-L-1,则有
V(浓盐酸)≈8.3 mL, 应选取10 mL 量筒
[解析]密度为1.2g ·cm- 、36.5%的 浓
盐酸的物质的量浓度为c(HC1)=
⑤⑥
3.某同学在配制100 mL 0.5 mol-L-1的
NaOH 溶液时有以下实验操作,其中会 导致所配制的溶液浓度偏高的是(
A.未冷却到室温就注入容量瓶定容
B.定容后,经振荡、摇匀、静置,液面下 降再加水
C. 配好的溶液转入干净的试剂瓶时,不 慎溅出部分溶液
D.向容量瓶转移溶液时有少量液体流
[解析]未冷却至室温就注入 容量瓶并马上定容,导致溶液 体积偏小,浓度偏高,A正确; 定容后,轻轻振荡、摇匀、静 置,液面下降再加水,导致v偏 大,则配制的溶液浓度偏低, B错误;
出
4.用质量分数为36.5%的浓盐酸(密度为 1.16 g·cm-3)
配制成1 mol-L-1的稀盐酸。现实验室仅需要这种盐酸 220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用规格为 250 mL
的容量瓶。
11.6 mol-L- ,设需要浓盐酸的体积为VmL,根据溶液稀释定律c浓V浓=C稀V稀可知
11.6 mol-L- ×VmL=1 mol-L- ×250 mL,解得V=21.6。按照“大而近”的原则,根据需要量 取的浓盐酸的体积为21.6 mL来选择合适的量筒,故应选择25 mL量筒,故答案为C。
(2)经计算需 1.6 mL 浓盐酸,在量取时宜选用下列量筒
中的
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸冷却至室温后,沿玻璃棒注入容量瓶中。
② 往容量瓶中小心加蒸馏水至液面离容量瓶刻度线 1~2 cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与 瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合 均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容 量瓶。
上述操作中,正确的顺序是(填序号)_
(4)在上述配制过程中,用刚
刚洗涤洁净的量筒来量取浓 盐酸,其配制的稀盐酸浓度
偏 低 (填“偏高”“偏低”或
“无影响”)。若未用蒸馏水洗 涤烧杯内壁或未将洗涤液注 入容量瓶,则配制的稀盐酸浓 度 偏 低_ (填“偏高”“偏低”或 “无影响”)。
[解析]在上述配制过程中,用刚刚洗涤洁净 的量筒来量取浓盐酸,会将浓盐酸稀释,导
致所取的盐酸的量偏小,则其配制的稀盐酸 浓度偏低;若未用蒸馏水洗涤烧杯内壁或
未将洗涤液注入容量瓶,会造成溶质的损失, 则配制的稀盐酸浓度偏低。
5.某校化学实验小组欲帮助环保
局 配 制 4 8 0 mL0.5 mol·L-1的
NaOH 溶液,用于当
地水质检测。试回答相关问题: (1)该小组同学选择 500 mL的 容量瓶。
[解析]容量瓶的规格相对固定, 当所配制溶液的体积与容量瓶 规格不相符时,应选择规格比
所配制溶液体积稍大的容量瓶。
(2)其操作步骤如图(a)所示,则如图(b)所示操作应在图(a)中
的 c (填选项字母)之间。
A.②和③ B.①和② C.④和⑤ D.③和④
① ② ③ ④ ⑤ ⑥
(a)
[解析]根据溶液配制步骤:称量→溶解→转移→洗涤→定容→摇匀,结合图示步骤,向容 量瓶中直接加蒸馏水的操作应在洗涤之后、定容操作之前,即在④与⑤之间。
蒸馏水
(b)
(4)下列操作对所配制溶液的浓
度大小有何影响
①转移完溶液后未洗涤玻璃棒 和烧杯,浓度会 偏 小 (填“偏
大”“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水, 浓度会 无影响 0
解析]据c="可知,转移溶液后未 洗涤玻璃棒和烧杯,会使部分溶 质残留在玻璃棒和烧杯内壁上, 使n偏小,导致c偏小,而容量瓶中 有少量蒸馏水,则无影响。
课堂巩固练习
1.实验中需2 mol-L-1的Na CO 溶液950mL, 配制时
应选用的容量瓶的规格和称取Na CO 的质量分别是
A.1000mL,212g B.950mL,543.4g( A )
C. 任意规格,572g D.500mL,286g
2.用已准确称量过的氯化钠固体配制1.00 mol ·L-1的 NaCl溶液0.5L, 需要用的仪器是①坩埚②分液漏斗 ③容量瓶④烧杯⑤胶头滴管⑥烧瓶⑦玻璃棒⑧托盘 天平⑨药匙 ( C )
A.③④⑤⑦⑨ B.①②⑤⑥⑧
C.③④⑤⑦ D.③④⑤⑥
3.实验室用固体烧碱配制500mL0.1mol/LNaOH溶液。
(1)需称取2.0 g烧碱固体,固体应放在小烧杯中称量
(2)配制过程中一定不需要的仪器是 --0
A.烧 杯 B. 量筒 C.玻璃棒 D.1000mL容量瓶 E.锥形瓶 F. 胶头滴管 G.500mL试剂瓶
(3)根据实验的实验需要和(2)中列出的仪器判
断完成实验还缺少的仪器是 500mL容量瓶、天平
0
(4)在准确确定溶液体积过程中,完成后期加入
少量水的正确做法是 -0
向容量瓶中加蒸馏水,距刻度线1~2cm处,
改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度 线相切。
课堂小结
一 、容量瓶的构造特点
二、配制一定物质的量浓度溶液的步骤
1.计算 2.称量(或量取) 3.溶解
4.转移和洗涤5.定容6.摇匀7.装瓶贴签
三、误差分析
同学们再见
09/9/2088
100 mL
蒸馏水
NaCl
仰视刻度线,实际加水量超 过刻度线,使溶液的物质的 量浓度减小。
俯视刻度线,实际加水 未到刻度线,使溶液的 质的量浓度增大
·仰视
· 俯视
返回
