8.1.2海水资源的开发利用 (教学课件)-高中化学人教版(2019)必修第二册(共19张PPT)
文档属性
| 名称 | 8.1.2海水资源的开发利用 (教学课件)-高中化学人教版(2019)必修第二册(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 20:48:47 | ||
图片预览





文档简介
(共19张PPT)
海水资源的开发利用
自然资源的开发利用
1. 了解海水资源的开发利用;
2. 以海水资源的开发利用为例,体会化学在资源利用中的重 要作用,认识化学对社会发展的重要意义。
学习目标
化学资源
如提取食盐、石膏、卤水、淡水等
海洋生物资源
如海鱼、海带、紫菜食用、珊瑚等观赏
矿产资源 如海底矿沙、可燃冰等
海洋能源资源 如潮汐发电、温差发电等
海洋占地球表面积的71%,海水约占地 球上水储量的97%。
导入
丰富的海洋资源
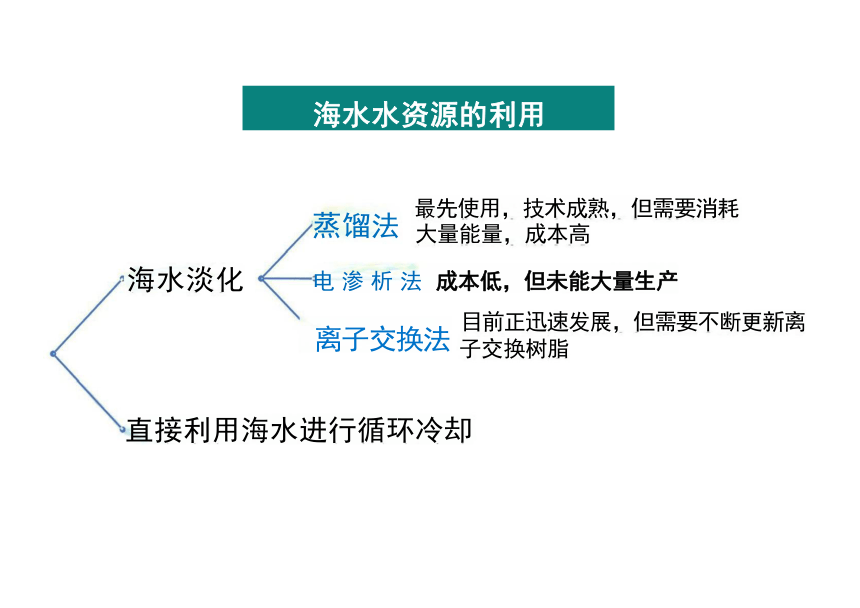
最先使用,技术成熟,但需要消耗 大量能量,成本高
电 渗 析 法 成本低,但未能大量生产
目前正迅速发展,但需要不断更新离 子交换树脂
直接利用海水进行循环冷却
海水水资源的利用
离子交换法
海水淡化
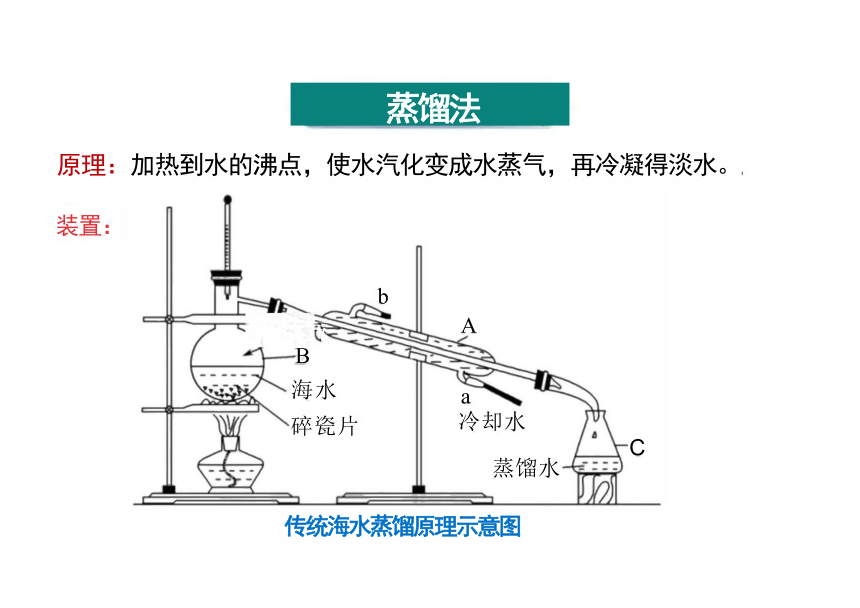
蒸馏法
原理:加热到水的沸点,使水汽化变成水蒸气,再冷凝得淡水。
装置:
b
水蒸气
B
海水
碎瓷片
蒸馏法
a
冷却水
蒸馏水
传统海水蒸馏原理示意图
C
A
蒸馏还适用于 分离两种沸 点 相差较大的 液 体。
牛角管
冷却水 锥形瓶
△
蒸馏水
C
温度计
冷凝管
水蒸气
B
海水
碎瓷片
蒸馏烧瓶
酒精灯
装置分析
a
250ml *GG-17
500ml
100ml
3、须向蒸馏烧瓶中加几粒沸石或几片碎瓷片,以防液体爆沸。
4、温度计的量程应高于馏分的最高沸点,要使温度计的水银球与蒸馏 烧瓶支管口持平。
5、冷凝管内冷却水走向:下口进,上口出。与蒸汽流向相反,更有利 于蒸汽的冷却。
1、蒸馏烧瓶须垫石棉网加热或水浴加热(防止
温度过高且能使溶液受热均匀)。
2、蒸馏烧瓶所盛液体不能超过烧瓶容量的三 分之二,不能少于三分之一。
装置分析
注意事项
冷却水
蒸馏水专
海水
碎瓷片
C
海水
太阳能蒸发原理示意图
太阳能蒸发海水
太阳能
水蒸气
淡水
淡水
· 海水化学资源的特点
海水中含量最多的O、H 两种元素,加上Cl、Na、Mg、S、Ca、K、
Br、C、Sr、B、F等11中元素,其总含量超过99%。虽然海水中元 素的种类很多,总储量很大,但许多元素的富集程度却很低。
· 海水中化学资源的开发利用
(1)海水制盐 从海水中制得的氯化钠,可以食用,同时也是生 产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
海水中化学资源的开发利用
· 海水中化学资源的开发利用
(1)海水制盐 从海水中制得的氯化钠,可以食用,同时也是生 产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
①氯碱工业:电解饱和食盐水,可生产氢氧化钠、氢气和氯气。 化学反应方程式:2 NaCl+2H O 电解H 个 +Cl 个 + 2NaOH
②制钠和氯气:2NaCl(熔融)电 解 2Na+Cl 个
③制盐酸:
④制漂白剂(84消毒液):Cl +2NaOH=NaCl+NaClO+H O
⑤制纯碱:NaCl+CO +H O+NH ===NH Cl+NaHCO V
海水中化学资源的开发利用
· 海水化学资源的特点
海水中含量最多的O、H 两种元素,加上Cl、Na、Mg、S、Ca、K、 Br、C、Sr、B、F等11中元素,其总含量超过99%。虽然海水中元 素的种类很多,总储量很大,但许多元素的富集程度却很低。
· 海水中化学资源的开发利用
(1)海水制盐 从海水中制得的氯化钠,可以食用,同时也是生 产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
(2)在海水制盐工业的基础上,还可以从海水中提取镁、钾、溴 以及其他化工产品。
海水中化学资源的开发利用
海水中化学资源的开发利用
(2)海水制镁
生石灰一 石灰乳 Mg
海水 引入 沉淀池操作aMg(OH) 试剂M
请写出上述流程中涉及到的化学反应方程式以及离子方程式。
MgCl 操作bMgCl 溶 液 晶 体
无水MgCl
电解
③空气
吹出 含 Br 的空气
④SO
溴水
混合物 ⑤氧化
粗溴水
(3)海水提溴
世界上99%的溴以Br-的形式存在于海水中,因此溴也被称为“海 洋元素”。
①海水提溴的方法(吹出法)
海水中化学资源的开发利用
①硫酸酸化 含 Br
②氯气氧化 的海水
⑦冷凝 ⑧分离
提取 粗盐
吸收液
⑥蒸馏
液溴
海水
苦 卤
蒸 气
吸收
浓缩
海水晒盐和海水淡化的过程中副产物Br-得到浓缩
氧化
向浓缩的海水中通入Cl ,将Br-氧化成Br
吹出
利用溴的挥发性,通入热空气和水蒸气,吹出溴蒸气
吸收
吹出的溴蒸气用SO 吸收
蒸馏
再用Cl 将HBr氧化得到产品溴后蒸馏分离
海水中化学资源的开发利用
②请书写氧化、吸收环节主要离子方程式。
①海水提溴的方法(吹出法)
·海带中提碘 ①流程:海带→浸泡→氧化→过滤→提纯→碘单质
②主要化学原理:Cl +2KI=2KCl+I 。
(4)海带提碘
·海带中碘元素的检验
①反应原理:2H++2I-+H O =I +2H O
海水中化学资源的开发利用
海带灼烧 海带灰②加热
③过滤
含碘(I-) 水溶液
晒干 ①水
淀粉
I /H O
②工艺流程
滴入H O (H+,aq)
变蓝色
纯碱 烧碱
食盐 氢气
钠 氯气
海水中化学资源的开发利用
淡水 海水
火电厂、核电厂
的循环冷却水
溴化物
溴
镁
镁盐
钾盐
钾
1.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( D )
A.将海带灼烧成灰 B.过滤得含I-溶液 C. 放出碘的苯溶液 D.分离碘并回收苯
A. 向苦卤中通入Cl 是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH 作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO 将其还原吸收
|Cl
苦卤(含K+、Mg +、Br 等)
Br K+、Mg +等 沉淀剂
Mg(OH)
2. 海水开发利用的部分过程如图所示。下列说法错误的是 ( C )
海水
粗盐
海水资源的开发利用
自然资源的开发利用
1. 了解海水资源的开发利用;
2. 以海水资源的开发利用为例,体会化学在资源利用中的重 要作用,认识化学对社会发展的重要意义。
学习目标
化学资源
如提取食盐、石膏、卤水、淡水等
海洋生物资源
如海鱼、海带、紫菜食用、珊瑚等观赏
矿产资源 如海底矿沙、可燃冰等
海洋能源资源 如潮汐发电、温差发电等
海洋占地球表面积的71%,海水约占地 球上水储量的97%。
导入
丰富的海洋资源
最先使用,技术成熟,但需要消耗 大量能量,成本高
电 渗 析 法 成本低,但未能大量生产
目前正迅速发展,但需要不断更新离 子交换树脂
直接利用海水进行循环冷却
海水水资源的利用
离子交换法
海水淡化
蒸馏法
原理:加热到水的沸点,使水汽化变成水蒸气,再冷凝得淡水。
装置:
b
水蒸气
B
海水
碎瓷片
蒸馏法
a
冷却水
蒸馏水
传统海水蒸馏原理示意图
C
A
蒸馏还适用于 分离两种沸 点 相差较大的 液 体。
牛角管
冷却水 锥形瓶
△
蒸馏水
C
温度计
冷凝管
水蒸气
B
海水
碎瓷片
蒸馏烧瓶
酒精灯
装置分析
a
250ml *GG-17
500ml
100ml
3、须向蒸馏烧瓶中加几粒沸石或几片碎瓷片,以防液体爆沸。
4、温度计的量程应高于馏分的最高沸点,要使温度计的水银球与蒸馏 烧瓶支管口持平。
5、冷凝管内冷却水走向:下口进,上口出。与蒸汽流向相反,更有利 于蒸汽的冷却。
1、蒸馏烧瓶须垫石棉网加热或水浴加热(防止
温度过高且能使溶液受热均匀)。
2、蒸馏烧瓶所盛液体不能超过烧瓶容量的三 分之二,不能少于三分之一。
装置分析
注意事项
冷却水
蒸馏水专
海水
碎瓷片
C
海水
太阳能蒸发原理示意图
太阳能蒸发海水
太阳能
水蒸气
淡水
淡水
· 海水化学资源的特点
海水中含量最多的O、H 两种元素,加上Cl、Na、Mg、S、Ca、K、
Br、C、Sr、B、F等11中元素,其总含量超过99%。虽然海水中元 素的种类很多,总储量很大,但许多元素的富集程度却很低。
· 海水中化学资源的开发利用
(1)海水制盐 从海水中制得的氯化钠,可以食用,同时也是生 产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
海水中化学资源的开发利用
· 海水中化学资源的开发利用
(1)海水制盐 从海水中制得的氯化钠,可以食用,同时也是生 产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
①氯碱工业:电解饱和食盐水,可生产氢氧化钠、氢气和氯气。 化学反应方程式:2 NaCl+2H O 电解H 个 +Cl 个 + 2NaOH
②制钠和氯气:2NaCl(熔融)电 解 2Na+Cl 个
③制盐酸:
④制漂白剂(84消毒液):Cl +2NaOH=NaCl+NaClO+H O
⑤制纯碱:NaCl+CO +H O+NH ===NH Cl+NaHCO V
海水中化学资源的开发利用
· 海水化学资源的特点
海水中含量最多的O、H 两种元素,加上Cl、Na、Mg、S、Ca、K、 Br、C、Sr、B、F等11中元素,其总含量超过99%。虽然海水中元 素的种类很多,总储量很大,但许多元素的富集程度却很低。
· 海水中化学资源的开发利用
(1)海水制盐 从海水中制得的氯化钠,可以食用,同时也是生 产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
(2)在海水制盐工业的基础上,还可以从海水中提取镁、钾、溴 以及其他化工产品。
海水中化学资源的开发利用
海水中化学资源的开发利用
(2)海水制镁
生石灰一 石灰乳 Mg
海水 引入 沉淀池操作aMg(OH) 试剂M
请写出上述流程中涉及到的化学反应方程式以及离子方程式。
MgCl 操作bMgCl 溶 液 晶 体
无水MgCl
电解
③空气
吹出 含 Br 的空气
④SO
溴水
混合物 ⑤氧化
粗溴水
(3)海水提溴
世界上99%的溴以Br-的形式存在于海水中,因此溴也被称为“海 洋元素”。
①海水提溴的方法(吹出法)
海水中化学资源的开发利用
①硫酸酸化 含 Br
②氯气氧化 的海水
⑦冷凝 ⑧分离
提取 粗盐
吸收液
⑥蒸馏
液溴
海水
苦 卤
蒸 气
吸收
浓缩
海水晒盐和海水淡化的过程中副产物Br-得到浓缩
氧化
向浓缩的海水中通入Cl ,将Br-氧化成Br
吹出
利用溴的挥发性,通入热空气和水蒸气,吹出溴蒸气
吸收
吹出的溴蒸气用SO 吸收
蒸馏
再用Cl 将HBr氧化得到产品溴后蒸馏分离
海水中化学资源的开发利用
②请书写氧化、吸收环节主要离子方程式。
①海水提溴的方法(吹出法)
·海带中提碘 ①流程:海带→浸泡→氧化→过滤→提纯→碘单质
②主要化学原理:Cl +2KI=2KCl+I 。
(4)海带提碘
·海带中碘元素的检验
①反应原理:2H++2I-+H O =I +2H O
海水中化学资源的开发利用
海带灼烧 海带灰②加热
③过滤
含碘(I-) 水溶液
晒干 ①水
淀粉
I /H O
②工艺流程
滴入H O (H+,aq)
变蓝色
纯碱 烧碱
食盐 氢气
钠 氯气
海水中化学资源的开发利用
淡水 海水
火电厂、核电厂
的循环冷却水
溴化物
溴
镁
镁盐
钾盐
钾
1.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( D )
A.将海带灼烧成灰 B.过滤得含I-溶液 C. 放出碘的苯溶液 D.分离碘并回收苯
A. 向苦卤中通入Cl 是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH 作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO 将其还原吸收
|Cl
苦卤(含K+、Mg +、Br 等)
Br K+、Mg +等 沉淀剂
Mg(OH)
2. 海水开发利用的部分过程如图所示。下列说法错误的是 ( C )
海水
粗盐
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
