2.1共价键 (教学课件) -高中化学人教版(2019)选择性必修第二册(共43张PPT)
文档属性
| 名称 | 2.1共价键 (教学课件) -高中化学人教版(2019)选择性必修第二册(共43张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 00:00:00 | ||
图片预览





文档简介
(共43张PPT)
第二章第一节第1课时
《共价键》
学习目标:
1.认识共价键的本质——原子间通过原子轨道重叠形成共价键
2.了解共价键具有饱和性、方向性;正确区分σ键和π键
3.了解共价键的键能、键长、键角;能通过键参数判断分子的 稳定性及空间结构
NaCl 和HCl 的性质差异大,请用电子式描述NaCl 和HCl 的形成过
程,从微粒间相互作用的角度解释NaCl
和HCl 性质差异大的原因。
思考讨论
NaCl晶体
HCl 气体
2
NaCl和HCl的形成过程
Na · + · Ci: —→ Na+[:Cl ]
H · + ·Cl: → H: Cl 共价键
微粒间的相互作用
离子键
分享交流
3
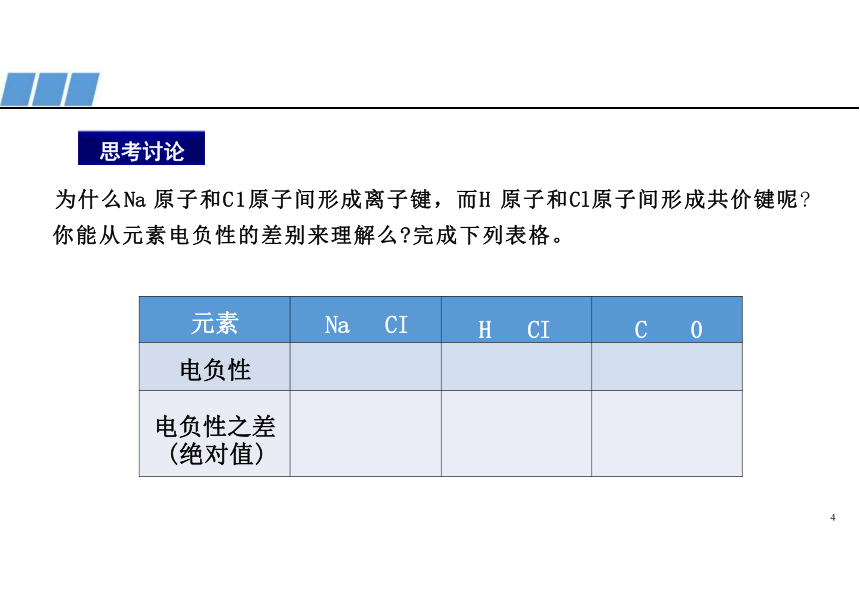
元素 Na CI H CI
C 0
电负性
电负性之差 (绝对值)
为什么Na 原子和C1原子间形成离子键,而H 原子和Cl原子间形成共价键呢
你能从元素电负性的差别来理解么 完成下列表格。
思考讨论
4
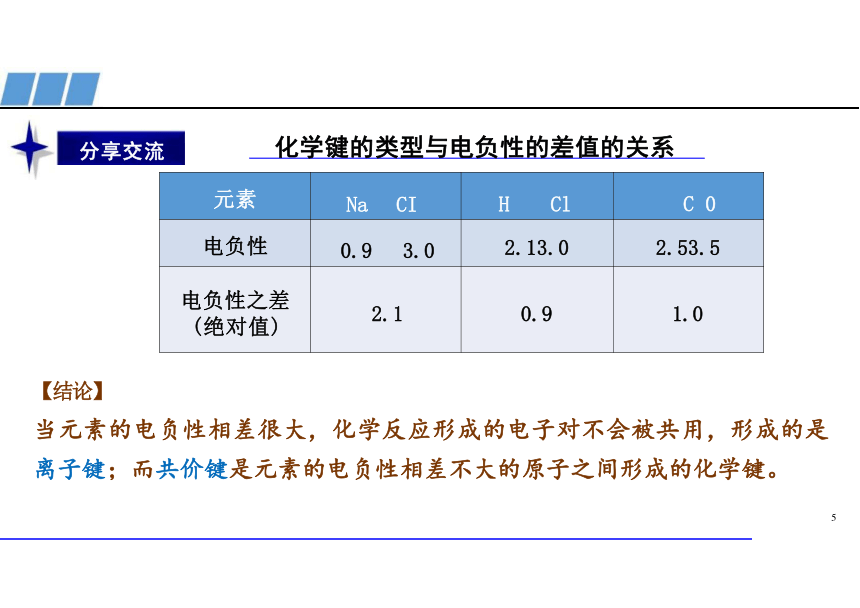
【结论】
当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的是
离子键;而共价键是元素的电负性相差不大的原子之间形成的化学键。
5
元素 Na CI H Cl
C 0
电负性 0.9 3.0 2.13.0
2.53.5
电负性之差 (绝对值) 2.1 0.9
1.0
化学键的类型与电负性的差值的关系
分享交流
小结
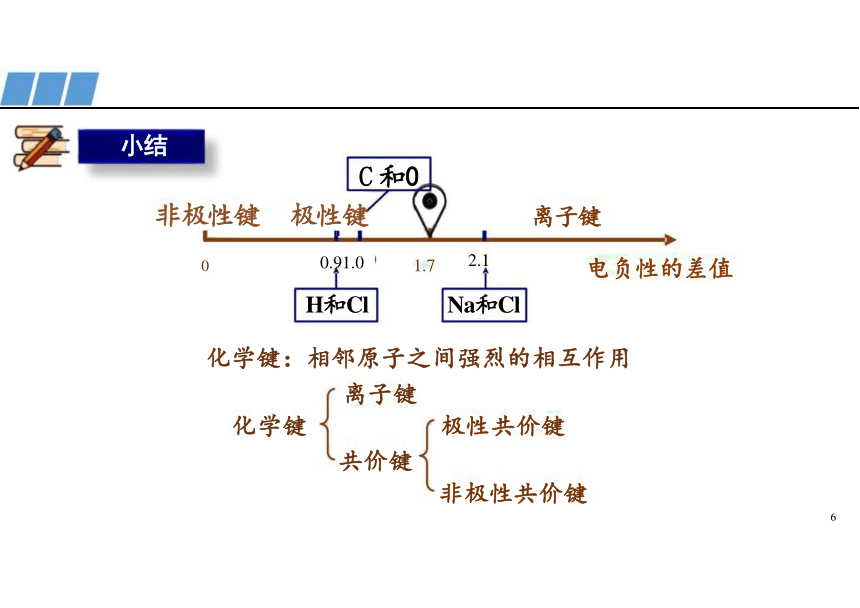
C 和0
非极性键 极性键 离子键
0 0.91.0 1.7 2.1 电负性的差值
H和Cl Na和Cl
化学键:相邻原子之间强烈的相互作用 离子键
化学键 极性共价键
共价键
非极性共价键
6
如何通过原子轨道进一步理解共价键的形成
思考讨论
7
资料卡片
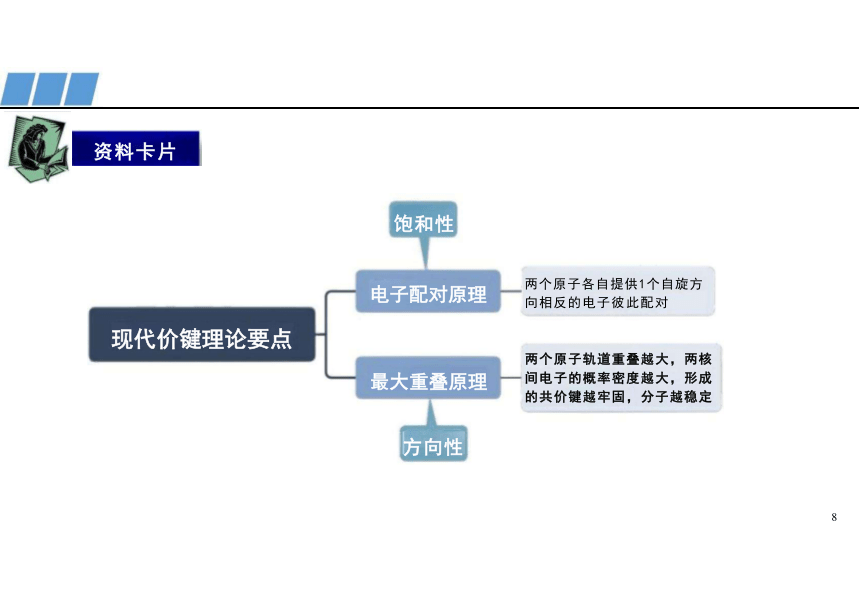
饱和性
两个原子各自提供1个自旋方 向相反的电子彼此配对
两个原子轨道重叠越大,两核 间电子的概率密度越大,形成 的共价键越牢固,分子越稳定
电子配对原理
最大重叠原理
现代价键理论要点
方向性
8
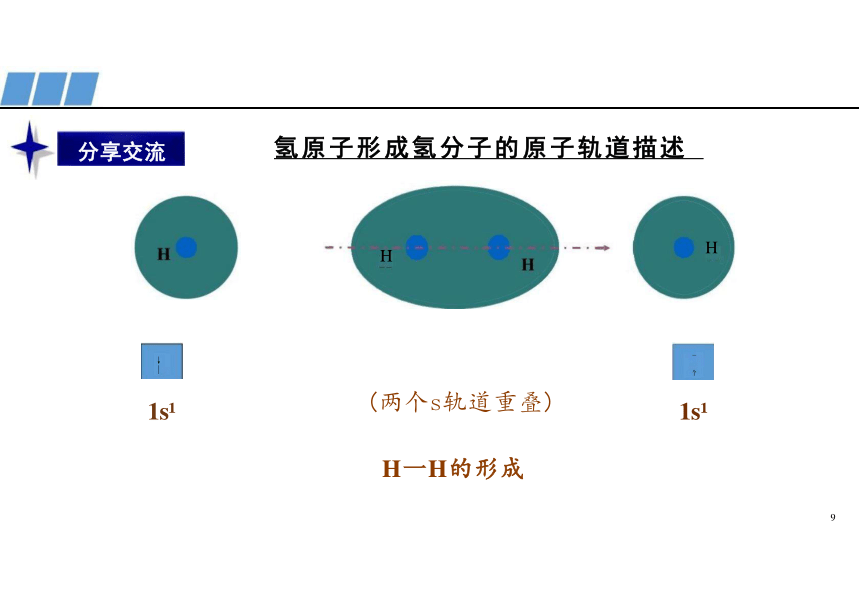
H H
(两个s轨道重叠)
H一H的形成
氢原子形成氢分子的原子轨道描述
分享交流
一 个
1s
1s
→—
9
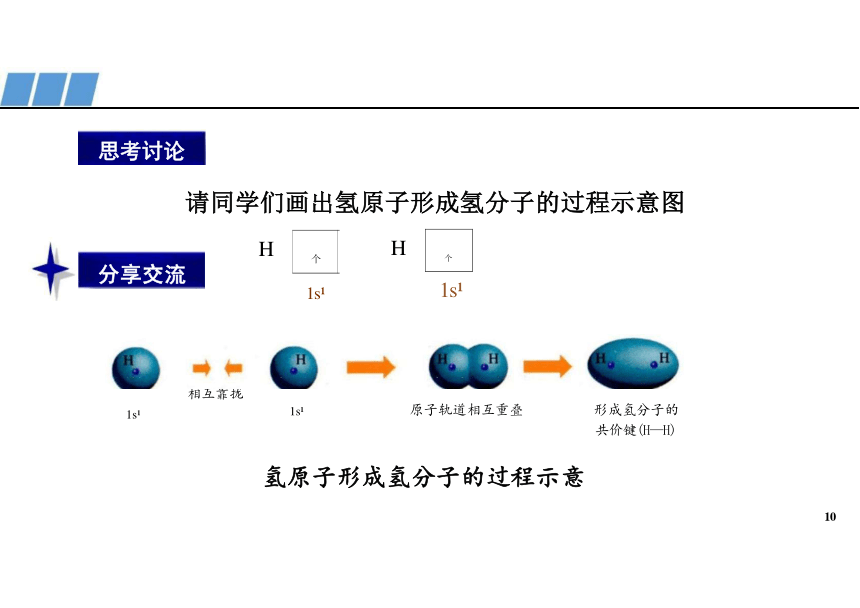
相互靠拢
1s 1s 原子轨道相互重叠 形成氢分子的
共价键(H—H)
氢原子形成氢分子的过程示意
请同学们画出氢原子形成氢分子的过程示意图
分享交流
思考讨论
个
个
1s
1s
H
H
10
s轨道和p轨道,p 轨道和p轨道重叠是否也能形成共价键呢
我们看一看HCl和Cl 中的共价键。
思考讨论
11
1s1 3s 3p
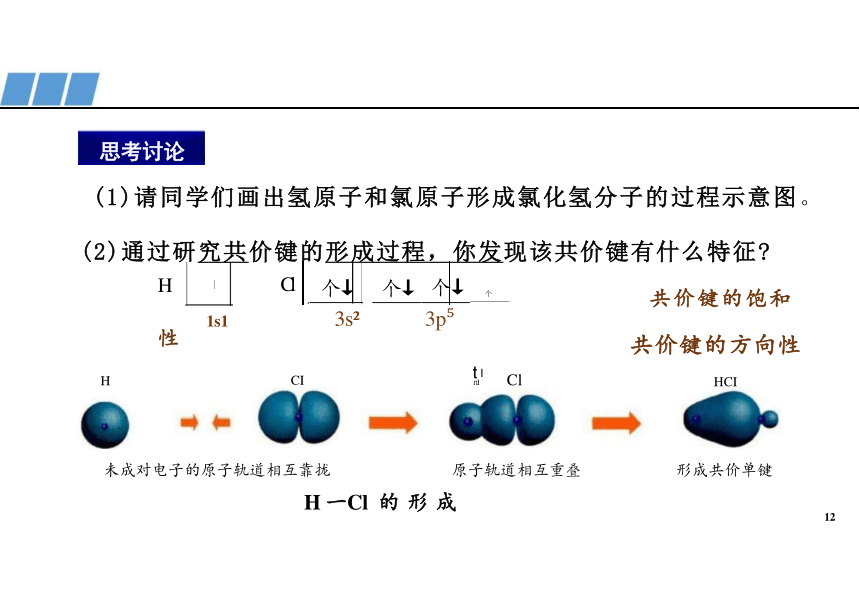
共价键的方向性
H CI Cl HCI
未成对电子的原子轨道相互靠拢 原子轨道相互重叠 形成共价单键
H 一Cl 的 形 成
1
I
(1)请同学们画出氢原子和氯原子形成氯化氢分子的过程示意图。
(2)通过研究共价键的形成过程,你发现该共价键有什么特征 H Cl 个↓ 个↓ 个↓ 个 共价键的饱和性
思考讨论
12
—
Cl C Cl
个 个↓ 个个个个 个↓个↓个 个↓ 个个个个个个个个
1s 2s 2p 3s 3p 1s 2s 2p 3s 3p
Cl—Cl 的形成
(两个p轨道重叠)
氯原子形成氯气分子的原子轨道描述
分享交流
13
H一H H一Cl Cl-Cl
σ键 原子轨道的重叠方式:“头碰头”
请归纳H-H 、H-Cl 和Cl-Cl 的特点。
HCI Cl
思考讨论
14
如果将σ键沿着键轴旋转,会发生什么情况呢
分享交流
电子云的对称方式:轴对称
15
p轨道和p轨道除了以“头碰头”的方式重叠以外,
还有没有可能以其他的方式重叠成键
思考讨论
16
分享交流
p-pπ键的形成
“肩并肩”
17
(1)π键的电子云形状有何特征
(2)如果将π键沿着键轴旋转,会发生什么情况呢
电子云为镜面对称:每个π键的
电子云由两块组成,互为镜像
π键的特征
观察思考
18
用电子式表示N 的形成过程,并用原子轨道重叠来解释
其共价键的形成过程。
十 :N: N:
●
个 — 个
个
思考讨论
个↓
2p
2s
N
19
通过氮气中氮氮三键形成过程的分析,如何
判断共价键是σ键或是π键
20
思考讨论
得出:在1000℃时,卤化氢分解率大小比较为HCl说明:卤化氢的稳定性大小比较为H Cl>HBr >HI
如何解释HCl 、HBr 、HI 的稳定性的差异呢
卤化氢
在1000℃分解的百分数/%
HCl
0.0014
HBr
0.5
HI
33
观察思考
思考讨论
1 H-Cl、H-Br 和H-I的强度不同
稳 、 的、 I想 2 Cl、Br和I的原子半径依次增大
3 H 与Cl 、Br 和I 反应放出的热量变化
猜
H
差异
HBr
定性
HCl
思考讨论
如何衡量共价键的强度呢
原子半径是如何影响
共价键的强度呢
化学反应中热量变化与共价 键的强度的关系是什么
1、定义:气态分子中1 mol化学键解离成气态原子所吸收的能量。
2、单位:kJ·mol-1
通常是298.15K,101kPa 条件下的标准值
一、键参数之键能
分子
越稳定
共价键
越牢固
键能:气态分子中1 mol 化学键解离成气态原子所吸收的能量。
键能是共价键强弱的一种标度。
气态分子中1 mol 化学键解离 成气态原子所吸 收的能量越多
键能的大小与共价键的强弱有什么关系呢
思考讨论
键能越大
共价键键能规律:
(1)成键原子相同时,键能强弱比较:单键键能<双键键能<三键键能。
(2)形成共价键的原子的半径越大,键能越小。
键
键能(kJ · mol- )
N-O
176.0
N=0
607.0
O-0
142.0
O=0
497.3
C-C
347.7
C=C
615.0
C=C
812.0
键 卤素原子半径(pm)
键能(kJ · mol- )
H-F 71
568.0
H-Cl 99
431.8
H-Br 114
366.0
H-I 133
298.7
你能发现哪些规律呢
某些共价键的键能
资料卡片
1、定义:构成化学键的两个原子的核间距。
2、单位:pm(1 pm=10-12m)
由于分子中的原子始终处于不断振动之中,因此,键长只能是振动着 的原子处于平衡位置时的核间距。
二、键参数之键长
共价键键长规律:
(1) 对于同种类型的共价键,成键原子的原子半径越大,键长越大。
(2)成键原子相同的共价键的键长:单键键长>双键键长>三键键长
卤素
原子半径(pm)
71
Cl
99
Br
114
I
133
键
键长(pm)
F-F
141
C1-Cl
198
Br-Br
228
I-I
267
键
键 长 ( p m )
H-F
92
H-Cl
127
H-Br
142
H-I
161
键
键 长 ( p m )
C-C
154
C=C
133
C=C
120
某些共价键的键长 你能发现哪些规律呢
资料卡片
通过观察共价键的键长和键能的数据,你能发现键长和键能之间的关系吗
关系:键长越短,键能越大
F-F不符合“键长越短,键能越大”的规律,为什么
键 键长 (pm)
键能
(kJ ·mol-1)
H-F 92
568
H-Cl 127
431.8
H-Br 142
366
H-I 161
298.7
键 键长 (pm)
键能
(kJ ·mol- )
F-F 141
157.0
Cl-Cl 198
242.7
Br-Br 228
193.7
I-I 267
152.7
键 键长 (pm)
键能
(kJ ·mol-1)
C-C 154
347.7
C=C 133
615
C=C 120
812
资料卡片
氟原子的原子半径很小,因此F-F的键长短,而由于键长短,两个F原
子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。
键 键长 (pm)
键能
(kJ ·mol-1)
F-F 141
157.0
Cl-Cl 198
242.7
Br-Br 228
193.7
I-I 267
152.7
F-F 不符合“键长越短,键能越大”的规律
为什么
特殊性
键
键能(kJ ·mol-1)
H-Cl
431.8
H-Br
366.0
H-I
298.7
键能越大,共价键越牢 固,由此构成的分子越 稳定。
思考讨论
HCl 、HBr 、HI
稳定性差异的分析
H-Cl 、H-Br和H-I的强度不同
键 键 长 ( p m )
键能(kJ ·mol-1)
H-Cl 127
431.8
H-Br 142
366
H-I 161
298.7
一般地,原子半径越大, 形成的共价键键长越长, 键能越小,共价键越不牢 固,形成的分子越不稳定。
卤素
原子半径(pm)
Cl
99
Br
114
I
133
Cl、Br 和I的原子半径依次增大
HCl 、HBr 、HI
稳定性差异的猜想
H-Cl 、H-Br 和H-I的强度不同
思考讨论
思考讨论
1 H-Cl 、H-Br和H-I的强度不同 键能
化学反应
3 H 与Cl 、Br 和I 反应放出的热量变化 的热量变化
HCl 、HBr 、HI
稳定性差异的分析
2 Cl 、Br 和I的原子半径依次增大
键长
旧化学键的断裂
化学反应
实质
化学键断裂吸收能量
键能与化学反应的能量变化存在一定的关系
如何用键能计算H 与Cl 、Br 和I 反应放出的热量呢
化学键形成释放能量
思考讨论
新化学键的形成
动手计算
吸收436.0 kJ·mol-1 能 量
吸收242.7 kJ·mol-1能 量
依据键能的数据,计算1
mol H 和1mol Cl 反应生
成2 mol HCl释放的能量。
键断裂
H H H
十
键断裂
Cl Cl Cl
H Cl H Cl
各释放431.8 kJ·mol-1能 量
键能 (kJ·mol-1)
436.0
242.7
431.8
键
H-H
Cl-Cl
H-Cl
H
十
Cl
键 形 成
键 形 成
吸收436.0 kJ·mol-1能量
吸收242.7 kJ·mol- 能 量
436.0+242.7—431.8×2=-184.9 kJ
放出184.9 kJ 的热量
H
十
Cl
H Cl
H
十
Cl
H Cl
键断裂
Cl Cl
各释放431.8 kJ·mol- 能 量
动手计算
键 形 成
键 形 成
键断裂
H( H
H +I =2HI
放出热量8.7 kJ
键
键能(kJ ·mol-1)
H-H
436.0
Br-Br
193.7
H-Br
366.0
I-I
152.7
H-I
298.7
计算1 mol H 分别与1mol Br (蒸气)
和1mol I (蒸气)反应,生成2 mol HBr 和2 mol HI,反应的热量变化。
H +Br =2HBr
放出热量102.3 kJ
动手计算
生成1 molHX 放出的热量:HCl>HBr>HI
同类型的化学反应,相同物质的量的反应物放出的热量越多,产物越稳定, 故HCl最稳定,分解的百分数最小,HI 最不稳定,更易发生热分解反应。
键能的应用:计算化学反应的反应热。
△H= 反应物键能总和一生成物键能总和
卤化氢
在1000℃分解的百分数/%
HCl
0.0014
HBr
0.5
HI
33
生成物
放出的热量(kJ)
HCl
184.9
HBr
102.3
HI
8.7
得出结论
键能和键长是衡量共价键强弱和分子稳定性的重要参数。
一般来说,形成的共价键的键能越大,键长越短,共价键越稳定, 含有该键的分子越稳定,分子性质越稳定。
以上两个参数定量地对分子进行了分析,而要更好的描述分子的 空间构型,还必须引入共价键的第三个键参数——键角。
小 结
1、定义:在多原子分子中,两个相邻共价键之间的夹角。
键角是描述分子空间结构的重要参数。
104.5°
H O
V 形 ( 角 形 )
三、键参数之键角
180°
CO
直线形
NH
三角锥形
衡量共价键的稳定性,判断分子稳定性;计算反应热
衡量共价键的稳定性,判断分子稳定性
描述分子空间结构的重要参数
结
小
键 参 数
键能
键长
键角
物质 分子结构
共价键的类型和数量
乙烷
7个σ键
乙烯
5个σ键+1个π键
乙炔
3个σ键+2个π键
分享交流
42
键类型 σ 键
π 键
常见类型 S-S、S-p、p-p
p-p
原子轨道重叠方式 “头碰头”重叠
“肩并肩”重叠
键的特征 轴对称,可旋转
镜面对称,不可旋转
原子轨道重叠程度 大
小
成键规律判断 单键:σ键; 双键:1个σ键、1个π键; 三键:1个σ键、2个π键
σ键与π键的比较
小结
43
第二章第一节第1课时
《共价键》
学习目标:
1.认识共价键的本质——原子间通过原子轨道重叠形成共价键
2.了解共价键具有饱和性、方向性;正确区分σ键和π键
3.了解共价键的键能、键长、键角;能通过键参数判断分子的 稳定性及空间结构
NaCl 和HCl 的性质差异大,请用电子式描述NaCl 和HCl 的形成过
程,从微粒间相互作用的角度解释NaCl
和HCl 性质差异大的原因。
思考讨论
NaCl晶体
HCl 气体
2
NaCl和HCl的形成过程
Na · + · Ci: —→ Na+[:Cl ]
H · + ·Cl: → H: Cl 共价键
微粒间的相互作用
离子键
分享交流
3
元素 Na CI H CI
C 0
电负性
电负性之差 (绝对值)
为什么Na 原子和C1原子间形成离子键,而H 原子和Cl原子间形成共价键呢
你能从元素电负性的差别来理解么 完成下列表格。
思考讨论
4
【结论】
当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的是
离子键;而共价键是元素的电负性相差不大的原子之间形成的化学键。
5
元素 Na CI H Cl
C 0
电负性 0.9 3.0 2.13.0
2.53.5
电负性之差 (绝对值) 2.1 0.9
1.0
化学键的类型与电负性的差值的关系
分享交流
小结
C 和0
非极性键 极性键 离子键
0 0.91.0 1.7 2.1 电负性的差值
H和Cl Na和Cl
化学键:相邻原子之间强烈的相互作用 离子键
化学键 极性共价键
共价键
非极性共价键
6
如何通过原子轨道进一步理解共价键的形成
思考讨论
7
资料卡片
饱和性
两个原子各自提供1个自旋方 向相反的电子彼此配对
两个原子轨道重叠越大,两核 间电子的概率密度越大,形成 的共价键越牢固,分子越稳定
电子配对原理
最大重叠原理
现代价键理论要点
方向性
8
H H
(两个s轨道重叠)
H一H的形成
氢原子形成氢分子的原子轨道描述
分享交流
一 个
1s
1s
→—
9
相互靠拢
1s 1s 原子轨道相互重叠 形成氢分子的
共价键(H—H)
氢原子形成氢分子的过程示意
请同学们画出氢原子形成氢分子的过程示意图
分享交流
思考讨论
个
个
1s
1s
H
H
10
s轨道和p轨道,p 轨道和p轨道重叠是否也能形成共价键呢
我们看一看HCl和Cl 中的共价键。
思考讨论
11
1s1 3s 3p
共价键的方向性
H CI Cl HCI
未成对电子的原子轨道相互靠拢 原子轨道相互重叠 形成共价单键
H 一Cl 的 形 成
1
I
(1)请同学们画出氢原子和氯原子形成氯化氢分子的过程示意图。
(2)通过研究共价键的形成过程,你发现该共价键有什么特征 H Cl 个↓ 个↓ 个↓ 个 共价键的饱和性
思考讨论
12
—
Cl C Cl
个 个↓ 个个个个 个↓个↓个 个↓ 个个个个个个个个
1s 2s 2p 3s 3p 1s 2s 2p 3s 3p
Cl—Cl 的形成
(两个p轨道重叠)
氯原子形成氯气分子的原子轨道描述
分享交流
13
H一H H一Cl Cl-Cl
σ键 原子轨道的重叠方式:“头碰头”
请归纳H-H 、H-Cl 和Cl-Cl 的特点。
HCI Cl
思考讨论
14
如果将σ键沿着键轴旋转,会发生什么情况呢
分享交流
电子云的对称方式:轴对称
15
p轨道和p轨道除了以“头碰头”的方式重叠以外,
还有没有可能以其他的方式重叠成键
思考讨论
16
分享交流
p-pπ键的形成
“肩并肩”
17
(1)π键的电子云形状有何特征
(2)如果将π键沿着键轴旋转,会发生什么情况呢
电子云为镜面对称:每个π键的
电子云由两块组成,互为镜像
π键的特征
观察思考
18
用电子式表示N 的形成过程,并用原子轨道重叠来解释
其共价键的形成过程。
十 :N: N:
●
个 — 个
个
思考讨论
个↓
2p
2s
N
19
通过氮气中氮氮三键形成过程的分析,如何
判断共价键是σ键或是π键
20
思考讨论
得出:在1000℃时,卤化氢分解率大小比较为HCl
如何解释HCl 、HBr 、HI 的稳定性的差异呢
卤化氢
在1000℃分解的百分数/%
HCl
0.0014
HBr
0.5
HI
33
观察思考
思考讨论
1 H-Cl、H-Br 和H-I的强度不同
稳 、 的、 I想 2 Cl、Br和I的原子半径依次增大
3 H 与Cl 、Br 和I 反应放出的热量变化
猜
H
差异
HBr
定性
HCl
思考讨论
如何衡量共价键的强度呢
原子半径是如何影响
共价键的强度呢
化学反应中热量变化与共价 键的强度的关系是什么
1、定义:气态分子中1 mol化学键解离成气态原子所吸收的能量。
2、单位:kJ·mol-1
通常是298.15K,101kPa 条件下的标准值
一、键参数之键能
分子
越稳定
共价键
越牢固
键能:气态分子中1 mol 化学键解离成气态原子所吸收的能量。
键能是共价键强弱的一种标度。
气态分子中1 mol 化学键解离 成气态原子所吸 收的能量越多
键能的大小与共价键的强弱有什么关系呢
思考讨论
键能越大
共价键键能规律:
(1)成键原子相同时,键能强弱比较:单键键能<双键键能<三键键能。
(2)形成共价键的原子的半径越大,键能越小。
键
键能(kJ · mol- )
N-O
176.0
N=0
607.0
O-0
142.0
O=0
497.3
C-C
347.7
C=C
615.0
C=C
812.0
键 卤素原子半径(pm)
键能(kJ · mol- )
H-F 71
568.0
H-Cl 99
431.8
H-Br 114
366.0
H-I 133
298.7
你能发现哪些规律呢
某些共价键的键能
资料卡片
1、定义:构成化学键的两个原子的核间距。
2、单位:pm(1 pm=10-12m)
由于分子中的原子始终处于不断振动之中,因此,键长只能是振动着 的原子处于平衡位置时的核间距。
二、键参数之键长
共价键键长规律:
(1) 对于同种类型的共价键,成键原子的原子半径越大,键长越大。
(2)成键原子相同的共价键的键长:单键键长>双键键长>三键键长
卤素
原子半径(pm)
71
Cl
99
Br
114
I
133
键
键长(pm)
F-F
141
C1-Cl
198
Br-Br
228
I-I
267
键
键 长 ( p m )
H-F
92
H-Cl
127
H-Br
142
H-I
161
键
键 长 ( p m )
C-C
154
C=C
133
C=C
120
某些共价键的键长 你能发现哪些规律呢
资料卡片
通过观察共价键的键长和键能的数据,你能发现键长和键能之间的关系吗
关系:键长越短,键能越大
F-F不符合“键长越短,键能越大”的规律,为什么
键 键长 (pm)
键能
(kJ ·mol-1)
H-F 92
568
H-Cl 127
431.8
H-Br 142
366
H-I 161
298.7
键 键长 (pm)
键能
(kJ ·mol- )
F-F 141
157.0
Cl-Cl 198
242.7
Br-Br 228
193.7
I-I 267
152.7
键 键长 (pm)
键能
(kJ ·mol-1)
C-C 154
347.7
C=C 133
615
C=C 120
812
资料卡片
氟原子的原子半径很小,因此F-F的键长短,而由于键长短,两个F原
子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。
键 键长 (pm)
键能
(kJ ·mol-1)
F-F 141
157.0
Cl-Cl 198
242.7
Br-Br 228
193.7
I-I 267
152.7
F-F 不符合“键长越短,键能越大”的规律
为什么
特殊性
键
键能(kJ ·mol-1)
H-Cl
431.8
H-Br
366.0
H-I
298.7
键能越大,共价键越牢 固,由此构成的分子越 稳定。
思考讨论
HCl 、HBr 、HI
稳定性差异的分析
H-Cl 、H-Br和H-I的强度不同
键 键 长 ( p m )
键能(kJ ·mol-1)
H-Cl 127
431.8
H-Br 142
366
H-I 161
298.7
一般地,原子半径越大, 形成的共价键键长越长, 键能越小,共价键越不牢 固,形成的分子越不稳定。
卤素
原子半径(pm)
Cl
99
Br
114
I
133
Cl、Br 和I的原子半径依次增大
HCl 、HBr 、HI
稳定性差异的猜想
H-Cl 、H-Br 和H-I的强度不同
思考讨论
思考讨论
1 H-Cl 、H-Br和H-I的强度不同 键能
化学反应
3 H 与Cl 、Br 和I 反应放出的热量变化 的热量变化
HCl 、HBr 、HI
稳定性差异的分析
2 Cl 、Br 和I的原子半径依次增大
键长
旧化学键的断裂
化学反应
实质
化学键断裂吸收能量
键能与化学反应的能量变化存在一定的关系
如何用键能计算H 与Cl 、Br 和I 反应放出的热量呢
化学键形成释放能量
思考讨论
新化学键的形成
动手计算
吸收436.0 kJ·mol-1 能 量
吸收242.7 kJ·mol-1能 量
依据键能的数据,计算1
mol H 和1mol Cl 反应生
成2 mol HCl释放的能量。
键断裂
H H H
十
键断裂
Cl Cl Cl
H Cl H Cl
各释放431.8 kJ·mol-1能 量
键能 (kJ·mol-1)
436.0
242.7
431.8
键
H-H
Cl-Cl
H-Cl
H
十
Cl
键 形 成
键 形 成
吸收436.0 kJ·mol-1能量
吸收242.7 kJ·mol- 能 量
436.0+242.7—431.8×2=-184.9 kJ
放出184.9 kJ 的热量
H
十
Cl
H Cl
H
十
Cl
H Cl
键断裂
Cl Cl
各释放431.8 kJ·mol- 能 量
动手计算
键 形 成
键 形 成
键断裂
H( H
H +I =2HI
放出热量8.7 kJ
键
键能(kJ ·mol-1)
H-H
436.0
Br-Br
193.7
H-Br
366.0
I-I
152.7
H-I
298.7
计算1 mol H 分别与1mol Br (蒸气)
和1mol I (蒸气)反应,生成2 mol HBr 和2 mol HI,反应的热量变化。
H +Br =2HBr
放出热量102.3 kJ
动手计算
生成1 molHX 放出的热量:HCl>HBr>HI
同类型的化学反应,相同物质的量的反应物放出的热量越多,产物越稳定, 故HCl最稳定,分解的百分数最小,HI 最不稳定,更易发生热分解反应。
键能的应用:计算化学反应的反应热。
△H= 反应物键能总和一生成物键能总和
卤化氢
在1000℃分解的百分数/%
HCl
0.0014
HBr
0.5
HI
33
生成物
放出的热量(kJ)
HCl
184.9
HBr
102.3
HI
8.7
得出结论
键能和键长是衡量共价键强弱和分子稳定性的重要参数。
一般来说,形成的共价键的键能越大,键长越短,共价键越稳定, 含有该键的分子越稳定,分子性质越稳定。
以上两个参数定量地对分子进行了分析,而要更好的描述分子的 空间构型,还必须引入共价键的第三个键参数——键角。
小 结
1、定义:在多原子分子中,两个相邻共价键之间的夹角。
键角是描述分子空间结构的重要参数。
104.5°
H O
V 形 ( 角 形 )
三、键参数之键角
180°
CO
直线形
NH
三角锥形
衡量共价键的稳定性,判断分子稳定性;计算反应热
衡量共价键的稳定性,判断分子稳定性
描述分子空间结构的重要参数
结
小
键 参 数
键能
键长
键角
物质 分子结构
共价键的类型和数量
乙烷
7个σ键
乙烯
5个σ键+1个π键
乙炔
3个σ键+2个π键
分享交流
42
键类型 σ 键
π 键
常见类型 S-S、S-p、p-p
p-p
原子轨道重叠方式 “头碰头”重叠
“肩并肩”重叠
键的特征 轴对称,可旋转
镜面对称,不可旋转
原子轨道重叠程度 大
小
成键规律判断 单键:σ键; 双键:1个σ键、1个π键; 三键:1个σ键、2个π键
σ键与π键的比较
小结
43
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
