乙醇 高一化学人教版(2019)必修第二册(共39张PPT)
文档属性
| 名称 | 乙醇 高一化学人教版(2019)必修第二册(共39张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 21:01:45 | ||
图片预览








文档简介
(共39张PPT)
第三节 乙醇和乙酸
第一课时
乙 醇
2019人教版必修二
第七章有机化合物
209个教版必修二
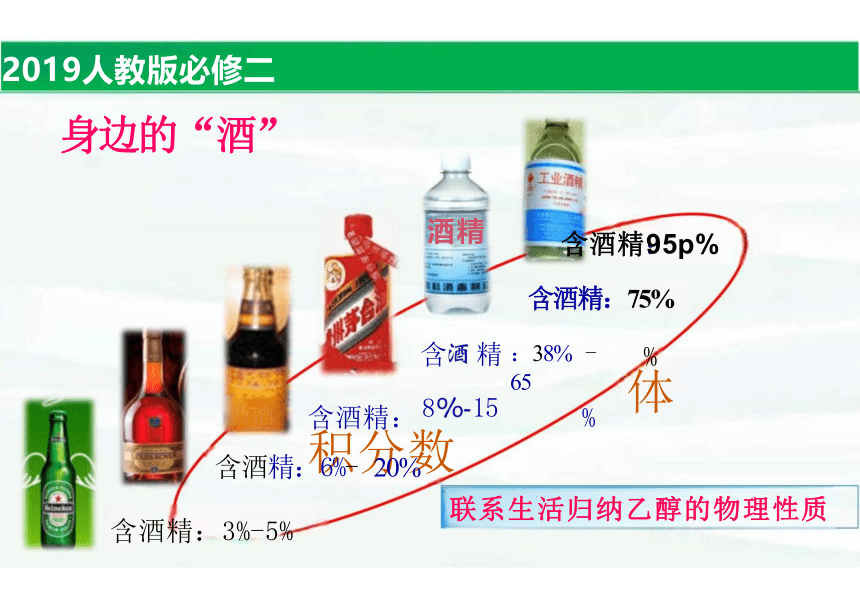
何以解忧,唯有杜康
酒 精 含酒精:95p%
含酒精:75%
含酒精: % 积分数
:38% - 65
体
%
15
精
8
含
2019人教版必修二
身边的“酒”
含酒精:6%- 20%
含酒精:3%-5%
联系生活归纳乙醇的物理性质
责酒
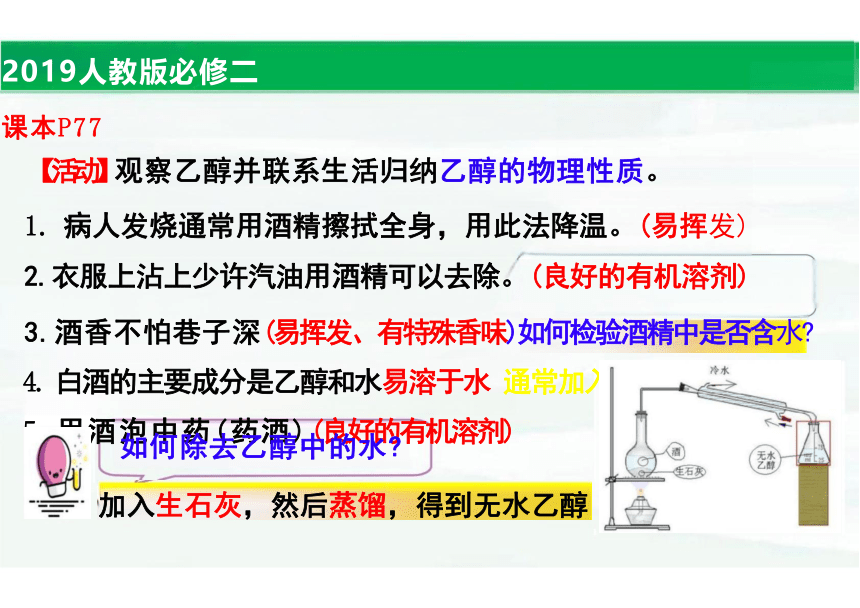
2019人教版必修二 课本P77
【活动】观察乙醇并联系生活归纳乙醇的物理性质。
1. 病人发烧通常用酒精擦拭全身,用此法降温。(易挥发) 2.衣服上沾上少许汽油用酒精可以去除。(良好的有机溶剂)
3.酒香不怕巷子深(易挥发、有特殊香味)如何检验酒精中是否含水 4. 白酒的主要成分是乙醇和水易溶于水 通常加入无水硫酸铜固体 5.用酒泡中药(药酒)(良好的有机溶剂)
加入生石灰,然后蒸馏,得到无水乙醇
如何除去乙醇中的水
2019人教版必修二
二、乙醇的物理性质
俗称: 酒精
颜色: 无色
气味: 特殊香味
状态: 液 体
密 度 : 比水小
水溶性:与水以任意比互溶
挥发性:易挥发(沸点:78.5℃)
乙醇
熔点:-117 ℃ 沸点:78.5 ℃
密度:0.789 g/cm
数据
课本P77
2019人教版必修二
C H O
H H
H-C-C-0-H
H H
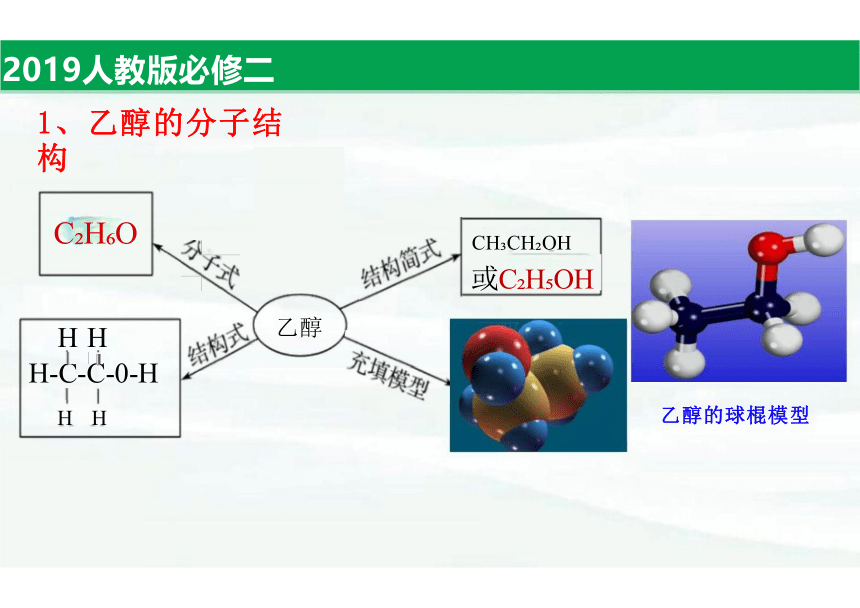
1、乙醇的分子结构
CH CH OH
或C H OH
乙醇的球棍模型
乙醇
2019人教版必修二
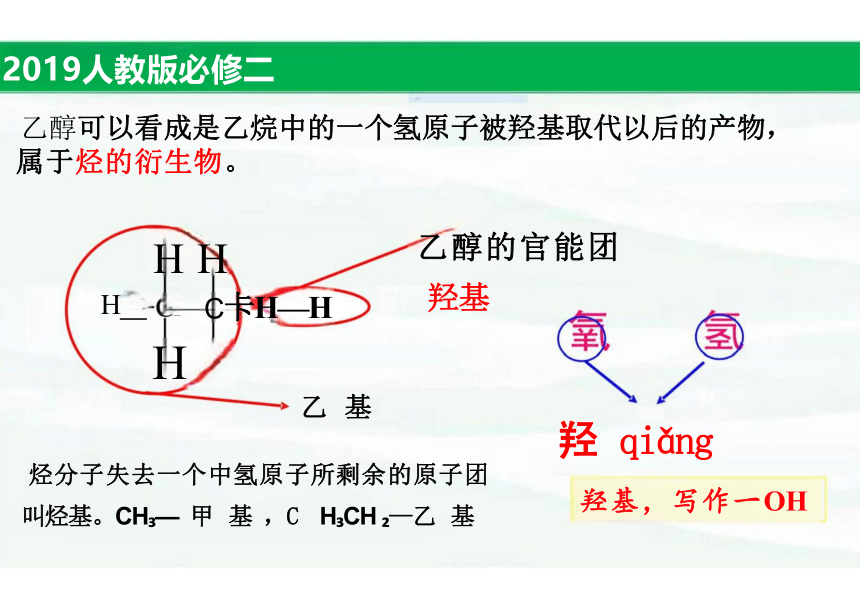
乙醇可以看成是乙烷中的一个氢原子被羟基取代以后的产物, 属于烃的衍生物。
H H 乙醇的官能团
H _ C卡H—H 羟基
H
乙 基
烃分子失去一个中氢原子所剩余的原子团 叫烃基。CH — 甲 基 ,C H CH —乙 基
羟 qiǎng
羟基,写作一OH
-OH OH-
电子式 0 :H [:0:H]- 电性 电中性 负电性 存在方式 不能独立存在 能够独立存在 稳定性 不稳定 较稳定
2019人教版必修二
概念辨析
2019人教版必修二
2、烃的衍生物和官能团:
烃的衍生物:从结构上看,烃分子中的氢原子被其他原子或原子团 所 取代而生成的 一 系列化合物称为烃的衍生物。列举两例以上。
判断方法:出含有碳氢元素外还含有其他元素。
2019人教版必修二
(1)乙醇的密度小于水的密度,故可用分液的方法分离乙醇和水(× ) 提示 乙醇和水互溶,无法用分液的方法分离。
(2)乙醇是一种优良的有机溶剂,能溶解很多有机物和无机物(√ )
(3)乙烷(CH CH )可以看成CH 分子中的一个H原子被甲基(—CH )所取 代而生成的产物,故乙烷为烃的衍生物( × )
(4)乙醇可以看作乙烷分子中氢原子被氢氧根(OH 一)取代后的产物,故乙 醇水溶液应呈碱性(× )
(5)乙醇的官能团为羟基,其电子式为:O:H × )
2019人教版必修二
2.下列有关乙醇的物理性质的应用不正确的是()
A.由于乙醇的密度比水小,所以乙醇中的水可以通过 分液的方法除去
B.由于乙醇能溶解很多有机物和无机物,所以可用乙醇 提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑
各种浓度的酒
D.从化学学科角度看,俗语“酒香不怕巷子深”中包含
乙醇容易挥发的性质
乙醇和水都含有羟基
乙思料C0 友反应呢
1.与活泼金属Na反应
线索
问题
探究
2019人教版必修二
三、乙醇的化学性质
2019人教版必修二
【实验7-4】在盛有少量无水乙醇的试管中,
加入一小块新切的、用滤纸吸干表面煤油的 钠,在试管口迅速塞上带尖嘴导管的橡胶塞 用小试管收集气体并检验其纯度,然后点燃 再将干燥的小烧杯罩在火焰上。待烧杯壁上 出现液滴后,迅速倒转烧杯,向其中加入少 量澄清石灰水,观察现象,并与前面做过的 水与钠反应的实验现象进行比较。
【实验现象】
钠下沉,且不熔;
有气泡,无响声。
【实验结论】有氢气生成
密度:水>钠>乙醇
1. 乙醇与金属钠反应 2 CH CH O- H+2Na→2CH CH ONa +H 个
2019人教版必修二
四、乙醇的化学性质
迅速倒转
澄清 石灰水
验纯后
无水乙醇
课本P78
钠
实际上是钠取代了乙醇羟基上的氢原子生成了乙醇钠,
Na
氢原子被取代之后和另外一个氢原子形成氢气的过程。
H
乙醇和钠能发生反应
反应原理:
结论
教版必修二
202给
2019人数版必候
四、乙醇的化学性质 课 本P78
1 . 乙醇与金属钠反应( 置 换 反 应)
2CH CH O-H+2Na→2CH CH ONa+H 个
[练习]钾、镁和铝等也可与乙醇反应产生H , 请写出镁与乙醇反应的方程式。
2CH CH OH+ Mg —→(CH CH O) Mg + H 个
乙醇镁
反应实质:
钠原子置换了羟基中的氢原 子生成了H
①处O -H键断开
2019人教版必修二
1 . 能证明乙醇分子中含有一个羟基的事实是(B )
A . 乙醇完全燃烧生成水
B.1 mol乙醇与足量的钠反应生成0.5 mol氢气
C. 乙醇能与水以任意比例互溶
D. 乙醇容易挥发
2.比较乙烷和乙醇的结构,下列说法错误的是( B )
A.两个碳原子都以单键相连
B. 分子里都含有6个相同的氢原子
C. 乙醇可以看成是乙烷分子中的一个氢原子被羟基取代后的产物
D. 乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的
氢原子活泼
当堂检测)
2019人教版必修二
3.将—小粒金属钠投入到盛有无水乙醇的小烧杯中,以下描述合
理的是( )
A. 无明显现象
B.烧杯内溶液颜色逐渐变红
C. 金属钠浮于液面上,四处游动
D. 金属钠沉入烧杯底部,并产生气泡
【答案】D
2019人教版必修二
四、乙醇的化学性质
2、氧化反应
①燃烧:
乙醇在空气中燃烧、产生 淡蓝色火焰, 同时放出大量热。
点燃
C H OH+30 → 2CO +3H O
思考:该反应中断什么键
燃烧时乙醇分子中所有的化学键都断裂。
乙醇的燃烧
2019人教版必修二
高温焊接银器或铜器 时,表面会生成黑色的氧化物, 师傅说:把铜、银器具趁热蘸一下酒精,铜、银会光亮如 初 !真的这么神奇吗
2 0 1 9 人 教 版
四、乙醇的化学性质
2、氧化反应
②催化氧化 【实验7-5】
铜丝
乙醇
课本P78
实验现象: 铜丝红
Cu
反应①:
反应②:CuO+CH CH OH一 Cu +CH CHO+H O
乙醇 乙醛
插入乙醇
溶液中②
Cu 作催化剂
2019人教版必修二
②催化氧化 铜丝
变黑 插入乙醇溶 二又变红
C— H 或 —CHO
官能团:醛基
有刺激性气味
O
CuO 一
中间产物
液 中 ②
①+②=
课本P78
△
①
乙醇一
2019人教版必修二
【反应机理】 2CH CH OH+0或A2CH CHO+2H O
—铜原子
—碳原子
—氧原子
—氢原子
课本P78
2019人教版必修二
2.氧化反应
2)催化氧化
C-—0—H,①、 ② 处0—H 键断开
②
H
H
断键: H- C
H
—
氧化反应:去氢或加氧
还原反应:加氢或去氧
①
H
乙醇与强氧化剂的反应
(交警检查酒后驾车的检测原理)
2019人教版必修二
你知道吗
酸性高锰酸钾溶液
CH CH OH → CH COOH
酸性重铬酸钾溶液
酸性K Cr O (aq) 由橙色变为绿色,判定司机饮酒超标。
2019人教版必修二
加入 乙醇
重铬酸钾 酸性溶液
K Cr O
重铬酸钾(橙色)
(3)被强氧化剂氧化
Cr (SO )
硫酸铬(绿色)
酒驾快速检测
KMnO (紫色)
MnSO (无色)
与Na反应,断 ①键
催化氧化,断①③键
燃烧,断 ①②③④⑤键
【课堂小结】
CH CH ONa+H ←
2019人教版必修二
CH COOH 或 酸 性K C O溶液
酸性KMnO 溶液
Cu或Ag
△
CH CHO+H O
燃烧
→CO +H O
乙醇
Na
2019人教版必修二
【当堂检测】
1. 乙醇分子中不同的化学键如下图,下列关于乙醇在各种反应中断裂
键的说法不正确的是()
A. 乙醇和钠反应,键①断裂
B. 在Ag催化下和O 反反,键①③断裂 H H
C. 在Cu催化下和O 反应,键④⑤不断裂 H⑤ o①H
D. 乙醇是电解质,在水中键①断裂能电离出氢离 ③
H H
20 的修二
2.某有机物的结构简式为
下列关于该有机物的叙述中,不正确的是( C )
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与H 发生加成反应
C. 不能使酸性KMnO 溶液褪色
D. 在铜作催化剂条件下能发生催化氧化反应生成醛
2019人教版必修二
课堂练习
3.探究乙醇性质的实验中,下列描述正确的是( D ) A.金属钠沉在乙醇液面之下,熔化成小球,剧烈反应 B.向乙醇的水溶液滴入几滴酚酞,溶液变红色
C.将灼烧的铜丝伸入乙醇中,铜丝溶解,生成刺激性物质
D.向乙醇中滴加酸性KMnO 溶液,紫红色褪去
2019人教版必修二
四、用途 (1)用作酒精灯、火锅、内燃机等的燃料。
生活小常识
酒类产品标签中的酒精度
是指乙醇的体积分数。 白酒一般在25%~68% 啤酒一般在3%~5%
医用酒精(体积分数为75%的 乙醇溶液)可以杀菌、消毒、治 疗伤病,也是家中消毒、清洁的
(2)用作化工原料、香料、化妆品、涂料等。
好帮手。
2019人教版必修二
资料卡片P79:了解酒精在人体中的变化
乙醇
A 百度百科 三
2017年10月27日,世界卫生组织国际癌症研
究机构公布的致癌物清单初步整理参考,与 酒精饮料摄入有关的乙醛在一类致癌物清单 中、乙醛在2类致癌物清单中。
二氧化碳 水
乙醇在人体中的代谢过程示意图
乙醛
乙酸
消
化
A、醒酒原理: 第一是去除葡萄酒中的沉淀,使杯
中的酒看起来更靓丽。第二是让葡萄酒中的单宁 (干涩感和细微的苦味) 充分氧化,同时去除由 SO 带来的异味,使葡萄酒本身的香气更具活力。
B、变酸原理:醇氧化为醛,醛氧化为酸。
2CH CHO+O 准化剂 2 CH COOH
2019人教版必修二
葡萄酒开瓶后,喝酒前要进行“醒 酒”,但如果开瓶后多余的葡萄酒密封不够 严实,时间久了就会发酸,你知道其中的科学原理吗
生 活 中 的 化 学
1.某有机物的结构简式为 CH =CH—CH—CH OH
下列关于该有机物的叙述中,不正确的是( C ) A。能与金属钠发生反应并放出氢气
B.能在催化剂作用下与H 发生加成反应
C.不能使酸性KMnO 溶液褪色
D. 在铜作催化剂条件下能发生催化氧化反应生成醛
2019人教版必修二
课堂练习
CH
2019人教版必修二
2.下列有关乙醇物理性质的应用中不正确的是( D )
A. 由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法
B、由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药中 的有效成分
C 、由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D. 由于乙醇的密度比水小,所以乙醇会浮在水的上层
2019人教版必修二
3.下列有关乙醇的表述正确的是( D )
H
A.乙醇分子中含有甲基,甲基的电子式为:C :H H
B.乙醇的结构简式为C H O
C.乙醇分子中羟基的电子式为[xO:H]
D.乙醇分子的空间充填模型为
2019人教版必修二
4.决定乙醇主要化学性质的原子或原子团是( A )
A. 羟 基 B. 乙 基 ( —CH CH ) C. 氢 氧 根 离 子 D. 氢离子
2019人教版必修二
H H② ①
5.乙醇分子中有5种化学键,如图所示H—C—C—0÷H, 在不同的反应中
⑤H - ③
会有不同形式的化学键断裂,根据下列不同反应,按要求回答相关问题。
(1)和金属钠反应,断裂的化学键为_ ① (填断键序号,下同),化学方程 式 为_ 2 CH CH OH+2Na—→2CH CH ONa 古Hm ol 乙醇和足量的金 属钠反应,生成标准状况下的氢气为11.2 L。
(2)乙醇在空气中充分燃烧,反应时断裂的化学键为_ ①②③④ ⑤, 反 应的化学方程式为CH CH OH+30 点燃2CO +3H O。
H
十
2019人教版必修二
(3)①将弯成螺旋状的铜丝灼烧,铜丝变黑,反应原理为2 Cu+O =
2C uO(用化学方程式表示)。然后将灼热的铜丝插入乙醇中,铜丝表面 由黑变红,在此过程中,乙醇分子中断裂的化学键为 ①③, 反应方程 式为CH CH OH + Cuo—→Cu+CH CHO + H O , 整个过程反应总方
程式为 2CH CH OH+o2A-2CH CHO+2H O ,铜在反应中起到
催化剂作用。
第三节 乙醇和乙酸
第一课时
乙 醇
2019人教版必修二
第七章有机化合物
209个教版必修二
何以解忧,唯有杜康
酒 精 含酒精:95p%
含酒精:75%
含酒精: % 积分数
:38% - 65
体
%
15
精
8
含
2019人教版必修二
身边的“酒”
含酒精:6%- 20%
含酒精:3%-5%
联系生活归纳乙醇的物理性质
责酒
2019人教版必修二 课本P77
【活动】观察乙醇并联系生活归纳乙醇的物理性质。
1. 病人发烧通常用酒精擦拭全身,用此法降温。(易挥发) 2.衣服上沾上少许汽油用酒精可以去除。(良好的有机溶剂)
3.酒香不怕巷子深(易挥发、有特殊香味)如何检验酒精中是否含水 4. 白酒的主要成分是乙醇和水易溶于水 通常加入无水硫酸铜固体 5.用酒泡中药(药酒)(良好的有机溶剂)
加入生石灰,然后蒸馏,得到无水乙醇
如何除去乙醇中的水
2019人教版必修二
二、乙醇的物理性质
俗称: 酒精
颜色: 无色
气味: 特殊香味
状态: 液 体
密 度 : 比水小
水溶性:与水以任意比互溶
挥发性:易挥发(沸点:78.5℃)
乙醇
熔点:-117 ℃ 沸点:78.5 ℃
密度:0.789 g/cm
数据
课本P77
2019人教版必修二
C H O
H H
H-C-C-0-H
H H
1、乙醇的分子结构
CH CH OH
或C H OH
乙醇的球棍模型
乙醇
2019人教版必修二
乙醇可以看成是乙烷中的一个氢原子被羟基取代以后的产物, 属于烃的衍生物。
H H 乙醇的官能团
H _ C卡H—H 羟基
H
乙 基
烃分子失去一个中氢原子所剩余的原子团 叫烃基。CH — 甲 基 ,C H CH —乙 基
羟 qiǎng
羟基,写作一OH
-OH OH-
电子式 0 :H [:0:H]- 电性 电中性 负电性 存在方式 不能独立存在 能够独立存在 稳定性 不稳定 较稳定
2019人教版必修二
概念辨析
2019人教版必修二
2、烃的衍生物和官能团:
烃的衍生物:从结构上看,烃分子中的氢原子被其他原子或原子团 所 取代而生成的 一 系列化合物称为烃的衍生物。列举两例以上。
判断方法:出含有碳氢元素外还含有其他元素。
2019人教版必修二
(1)乙醇的密度小于水的密度,故可用分液的方法分离乙醇和水(× ) 提示 乙醇和水互溶,无法用分液的方法分离。
(2)乙醇是一种优良的有机溶剂,能溶解很多有机物和无机物(√ )
(3)乙烷(CH CH )可以看成CH 分子中的一个H原子被甲基(—CH )所取 代而生成的产物,故乙烷为烃的衍生物( × )
(4)乙醇可以看作乙烷分子中氢原子被氢氧根(OH 一)取代后的产物,故乙 醇水溶液应呈碱性(× )
(5)乙醇的官能团为羟基,其电子式为:O:H × )
2019人教版必修二
2.下列有关乙醇的物理性质的应用不正确的是()
A.由于乙醇的密度比水小,所以乙醇中的水可以通过 分液的方法除去
B.由于乙醇能溶解很多有机物和无机物,所以可用乙醇 提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑
各种浓度的酒
D.从化学学科角度看,俗语“酒香不怕巷子深”中包含
乙醇容易挥发的性质
乙醇和水都含有羟基
乙思料C0 友反应呢
1.与活泼金属Na反应
线索
问题
探究
2019人教版必修二
三、乙醇的化学性质
2019人教版必修二
【实验7-4】在盛有少量无水乙醇的试管中,
加入一小块新切的、用滤纸吸干表面煤油的 钠,在试管口迅速塞上带尖嘴导管的橡胶塞 用小试管收集气体并检验其纯度,然后点燃 再将干燥的小烧杯罩在火焰上。待烧杯壁上 出现液滴后,迅速倒转烧杯,向其中加入少 量澄清石灰水,观察现象,并与前面做过的 水与钠反应的实验现象进行比较。
【实验现象】
钠下沉,且不熔;
有气泡,无响声。
【实验结论】有氢气生成
密度:水>钠>乙醇
1. 乙醇与金属钠反应 2 CH CH O- H+2Na→2CH CH ONa +H 个
2019人教版必修二
四、乙醇的化学性质
迅速倒转
澄清 石灰水
验纯后
无水乙醇
课本P78
钠
实际上是钠取代了乙醇羟基上的氢原子生成了乙醇钠,
Na
氢原子被取代之后和另外一个氢原子形成氢气的过程。
H
乙醇和钠能发生反应
反应原理:
结论
教版必修二
202给
2019人数版必候
四、乙醇的化学性质 课 本P78
1 . 乙醇与金属钠反应( 置 换 反 应)
2CH CH O-H+2Na→2CH CH ONa+H 个
[练习]钾、镁和铝等也可与乙醇反应产生H , 请写出镁与乙醇反应的方程式。
2CH CH OH+ Mg —→(CH CH O) Mg + H 个
乙醇镁
反应实质:
钠原子置换了羟基中的氢原 子生成了H
①处O -H键断开
2019人教版必修二
1 . 能证明乙醇分子中含有一个羟基的事实是(B )
A . 乙醇完全燃烧生成水
B.1 mol乙醇与足量的钠反应生成0.5 mol氢气
C. 乙醇能与水以任意比例互溶
D. 乙醇容易挥发
2.比较乙烷和乙醇的结构,下列说法错误的是( B )
A.两个碳原子都以单键相连
B. 分子里都含有6个相同的氢原子
C. 乙醇可以看成是乙烷分子中的一个氢原子被羟基取代后的产物
D. 乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的
氢原子活泼
当堂检测)
2019人教版必修二
3.将—小粒金属钠投入到盛有无水乙醇的小烧杯中,以下描述合
理的是( )
A. 无明显现象
B.烧杯内溶液颜色逐渐变红
C. 金属钠浮于液面上,四处游动
D. 金属钠沉入烧杯底部,并产生气泡
【答案】D
2019人教版必修二
四、乙醇的化学性质
2、氧化反应
①燃烧:
乙醇在空气中燃烧、产生 淡蓝色火焰, 同时放出大量热。
点燃
C H OH+30 → 2CO +3H O
思考:该反应中断什么键
燃烧时乙醇分子中所有的化学键都断裂。
乙醇的燃烧
2019人教版必修二
高温焊接银器或铜器 时,表面会生成黑色的氧化物, 师傅说:把铜、银器具趁热蘸一下酒精,铜、银会光亮如 初 !真的这么神奇吗
2 0 1 9 人 教 版
四、乙醇的化学性质
2、氧化反应
②催化氧化 【实验7-5】
铜丝
乙醇
课本P78
实验现象: 铜丝红
Cu
反应①:
反应②:CuO+CH CH OH一 Cu +CH CHO+H O
乙醇 乙醛
插入乙醇
溶液中②
Cu 作催化剂
2019人教版必修二
②催化氧化 铜丝
变黑 插入乙醇溶 二又变红
C— H 或 —CHO
官能团:醛基
有刺激性气味
O
CuO 一
中间产物
液 中 ②
①+②=
课本P78
△
①
乙醇一
2019人教版必修二
【反应机理】 2CH CH OH+0或A2CH CHO+2H O
—铜原子
—碳原子
—氧原子
—氢原子
课本P78
2019人教版必修二
2.氧化反应
2)催化氧化
C-—0—H,①、 ② 处0—H 键断开
②
H
H
断键: H- C
H
—
氧化反应:去氢或加氧
还原反应:加氢或去氧
①
H
乙醇与强氧化剂的反应
(交警检查酒后驾车的检测原理)
2019人教版必修二
你知道吗
酸性高锰酸钾溶液
CH CH OH → CH COOH
酸性重铬酸钾溶液
酸性K Cr O (aq) 由橙色变为绿色,判定司机饮酒超标。
2019人教版必修二
加入 乙醇
重铬酸钾 酸性溶液
K Cr O
重铬酸钾(橙色)
(3)被强氧化剂氧化
Cr (SO )
硫酸铬(绿色)
酒驾快速检测
KMnO (紫色)
MnSO (无色)
与Na反应,断 ①键
催化氧化,断①③键
燃烧,断 ①②③④⑤键
【课堂小结】
CH CH ONa+H ←
2019人教版必修二
CH COOH 或 酸 性K C O溶液
酸性KMnO 溶液
Cu或Ag
△
CH CHO+H O
燃烧
→CO +H O
乙醇
Na
2019人教版必修二
【当堂检测】
1. 乙醇分子中不同的化学键如下图,下列关于乙醇在各种反应中断裂
键的说法不正确的是()
A. 乙醇和钠反应,键①断裂
B. 在Ag催化下和O 反反,键①③断裂 H H
C. 在Cu催化下和O 反应,键④⑤不断裂 H⑤ o①H
D. 乙醇是电解质,在水中键①断裂能电离出氢离 ③
H H
20 的修二
2.某有机物的结构简式为
下列关于该有机物的叙述中,不正确的是( C )
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与H 发生加成反应
C. 不能使酸性KMnO 溶液褪色
D. 在铜作催化剂条件下能发生催化氧化反应生成醛
2019人教版必修二
课堂练习
3.探究乙醇性质的实验中,下列描述正确的是( D ) A.金属钠沉在乙醇液面之下,熔化成小球,剧烈反应 B.向乙醇的水溶液滴入几滴酚酞,溶液变红色
C.将灼烧的铜丝伸入乙醇中,铜丝溶解,生成刺激性物质
D.向乙醇中滴加酸性KMnO 溶液,紫红色褪去
2019人教版必修二
四、用途 (1)用作酒精灯、火锅、内燃机等的燃料。
生活小常识
酒类产品标签中的酒精度
是指乙醇的体积分数。 白酒一般在25%~68% 啤酒一般在3%~5%
医用酒精(体积分数为75%的 乙醇溶液)可以杀菌、消毒、治 疗伤病,也是家中消毒、清洁的
(2)用作化工原料、香料、化妆品、涂料等。
好帮手。
2019人教版必修二
资料卡片P79:了解酒精在人体中的变化
乙醇
A 百度百科 三
2017年10月27日,世界卫生组织国际癌症研
究机构公布的致癌物清单初步整理参考,与 酒精饮料摄入有关的乙醛在一类致癌物清单 中、乙醛在2类致癌物清单中。
二氧化碳 水
乙醇在人体中的代谢过程示意图
乙醛
乙酸
消
化
A、醒酒原理: 第一是去除葡萄酒中的沉淀,使杯
中的酒看起来更靓丽。第二是让葡萄酒中的单宁 (干涩感和细微的苦味) 充分氧化,同时去除由 SO 带来的异味,使葡萄酒本身的香气更具活力。
B、变酸原理:醇氧化为醛,醛氧化为酸。
2CH CHO+O 准化剂 2 CH COOH
2019人教版必修二
葡萄酒开瓶后,喝酒前要进行“醒 酒”,但如果开瓶后多余的葡萄酒密封不够 严实,时间久了就会发酸,你知道其中的科学原理吗
生 活 中 的 化 学
1.某有机物的结构简式为 CH =CH—CH—CH OH
下列关于该有机物的叙述中,不正确的是( C ) A。能与金属钠发生反应并放出氢气
B.能在催化剂作用下与H 发生加成反应
C.不能使酸性KMnO 溶液褪色
D. 在铜作催化剂条件下能发生催化氧化反应生成醛
2019人教版必修二
课堂练习
CH
2019人教版必修二
2.下列有关乙醇物理性质的应用中不正确的是( D )
A. 由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法
B、由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药中 的有效成分
C 、由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D. 由于乙醇的密度比水小,所以乙醇会浮在水的上层
2019人教版必修二
3.下列有关乙醇的表述正确的是( D )
H
A.乙醇分子中含有甲基,甲基的电子式为:C :H H
B.乙醇的结构简式为C H O
C.乙醇分子中羟基的电子式为[xO:H]
D.乙醇分子的空间充填模型为
2019人教版必修二
4.决定乙醇主要化学性质的原子或原子团是( A )
A. 羟 基 B. 乙 基 ( —CH CH ) C. 氢 氧 根 离 子 D. 氢离子
2019人教版必修二
H H② ①
5.乙醇分子中有5种化学键,如图所示H—C—C—0÷H, 在不同的反应中
⑤H - ③
会有不同形式的化学键断裂,根据下列不同反应,按要求回答相关问题。
(1)和金属钠反应,断裂的化学键为_ ① (填断键序号,下同),化学方程 式 为_ 2 CH CH OH+2Na—→2CH CH ONa 古Hm ol 乙醇和足量的金 属钠反应,生成标准状况下的氢气为11.2 L。
(2)乙醇在空气中充分燃烧,反应时断裂的化学键为_ ①②③④ ⑤, 反 应的化学方程式为CH CH OH+30 点燃2CO +3H O。
H
十
2019人教版必修二
(3)①将弯成螺旋状的铜丝灼烧,铜丝变黑,反应原理为2 Cu+O =
2C uO(用化学方程式表示)。然后将灼热的铜丝插入乙醇中,铜丝表面 由黑变红,在此过程中,乙醇分子中断裂的化学键为 ①③, 反应方程 式为CH CH OH + Cuo—→Cu+CH CHO + H O , 整个过程反应总方
程式为 2CH CH OH+o2A-2CH CHO+2H O ,铜在反应中起到
催化剂作用。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
