共价晶体 (教学课件)——高中化学人教版(2019)选择性必修二(共13张PPT)
文档属性
| 名称 | 共价晶体 (教学课件)——高中化学人教版(2019)选择性必修二(共13张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 590.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 00:00:00 | ||
图片预览



文档简介
(共13张PPT)
人教版选择性必修二物质结构与性质
第三章晶体结构与性质
第二节分子晶体与共价晶体
第2课时
共价晶体
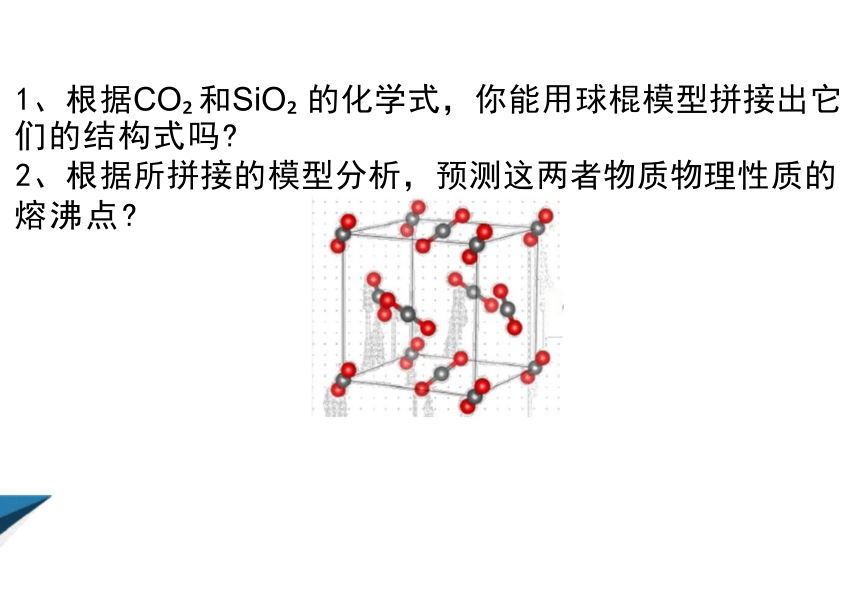
1、根据CO 和SiO 的化学式,你能用球棍模型拼接出它 们的结构式吗
2、根据所拼接的模型分析,预测这两者物质物理性质的 熔沸点
熔点 ℃沸点
℃状态(室温)
CO -56.2 一 7 8 . 4
气态
SiO 1723 2230
固态
碳元素和硅元素处于元素周期表中同一主族,
为什么CO 晶体的熔、沸点很低,而SiO 晶 体的熔沸点很高
思考与交流
·CO 和SiO 的一些物理性质如下表所示,通过 比较试判断SiO 晶体是否属于分子晶体。
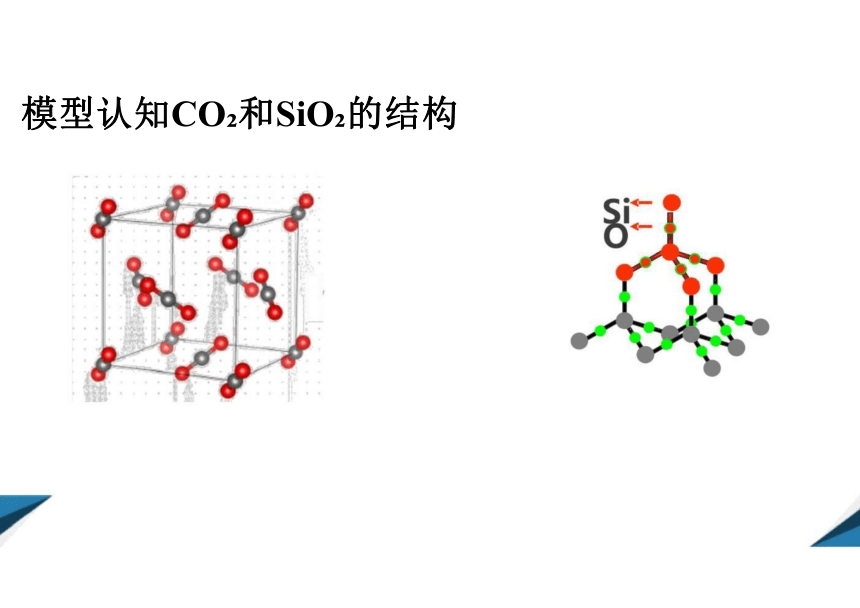
模型认知CO 和SiO 的结构
二、共价晶体
1. 概念:所有的相邻原子间都以共价键相结合而形 成空间立体网状结构的晶体。
(1)构成粒子:原子
(2)粒子间的作用力:共价键
( 3)结构特点:整块晶体是一个三维的共价键网 状结构,是一个“巨分子”,又 称共价晶体。
只由原子形成的晶体一定是共价晶体吗
稀有气体由单原子构成,属于分子晶体
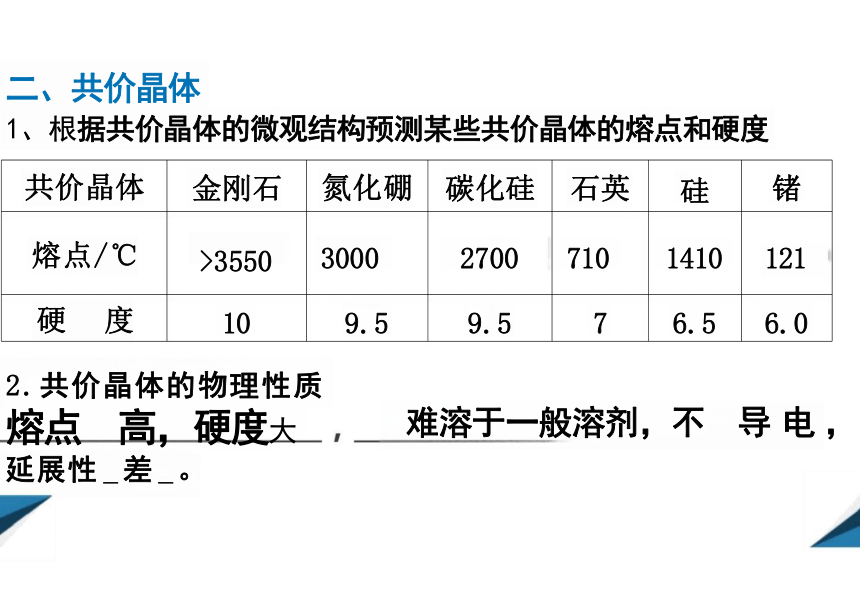
共价晶体 金刚石 氮化硼 碳化硅 石英 硅
锗
熔点/℃ >3550 3000 2700 710 1410
121
硬 度 10 9.5 9.5 7 6.5
6.0
二、共价晶体
1、根据共价晶体的微观结构预测某些共价晶体的熔点和硬度
2.共价晶体的物理性质 熔点 高,硬度大 延展性 差 。
难溶于一般溶剂,不 导 电 ,
(1)某些单质:硼(B)、硅(Si)、锗(Ge)、金刚石
(2)某些非金属化合物:碳化硅(SiC)、氮化硼 (BN)
(3)某些氧化物:二氧化硅(SiO )、Al O 晶体(刚 玉 )
二、共价晶体
根据共价晶体的常见类型分析其微观结构的中心原子共价键 杂化类型
3.常见的共价晶体类型
1.怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依
次下降
结构相似的共价晶体,原子半径越小,键长越短,键能越大 晶体熔点越高:金刚石>硅>锗
学与问
2.“具有共价键的晶体叫做共价晶体”。这种说法对吗 为 什么
不对,分子晶体中通常也含有共价键,如CO 、O , 某些离 子晶体中也含共价键,如NaOH、NH Cl
在金刚石晶胞中含有的碳原子数
一、在金刚石晶胞中
含有的碳原子数:
8×1/8+6×1/2+4 =8
二、共价晶体
4.典型的共价晶体
金刚石晶胞
(b)
①每个碳与相 邻 4 个 碳以 _共价键结合,形成正四面体结构。
②键角为109°28',碳原子采取了 sp 杂化。
③最小碳环由6个C组成且不在同一平面内,每个C被_12个最小环共 用,每个环平均拥有1/2个C, 平 均 拥 有 1 个C-C 键。
④1mol 金刚石中含有的C-C共价键数2_mol。
(1)金刚石
①在晶体中,每个Si与 4 个O以共价键结合,形成 正四面体 结构;每正四面体占有 1 个Si, 2 个O。 故SiO,晶体中Si与0之为1:2 。
②最小环上有 12 个 原 子 ( 6 个Si和 6 个 0 ) 。 1molSiO, 晶体中含4 molSi-O 键。
(2)二氧化硅
二氧化硅
金刚石
晶体类型 共价晶体
分子晶体
概 念 相邻原子间以共价键相结 合而形成空间网状结构
分子间以分子间作用力结合
组成微粒 原子
分子
粒子间作用力 共价键
分子间作用力
熔沸点 很高
较低
硬 度 很大
较小
溶解性 不溶于任何溶剂
部分溶于水
导电性 不导电,个别为半导体
固体和熔化状态都不导电,部分 溶于水导电
熔化时破坏的 作用力 破坏共价键
一定破坏分子间作用力(有时还 破坏氢键,Sg熔化还破坏共价键)
小结:分子晶体与共价晶体的比较
人教版选择性必修二物质结构与性质
第三章晶体结构与性质
第二节分子晶体与共价晶体
第2课时
共价晶体
1、根据CO 和SiO 的化学式,你能用球棍模型拼接出它 们的结构式吗
2、根据所拼接的模型分析,预测这两者物质物理性质的 熔沸点
熔点 ℃沸点
℃状态(室温)
CO -56.2 一 7 8 . 4
气态
SiO 1723 2230
固态
碳元素和硅元素处于元素周期表中同一主族,
为什么CO 晶体的熔、沸点很低,而SiO 晶 体的熔沸点很高
思考与交流
·CO 和SiO 的一些物理性质如下表所示,通过 比较试判断SiO 晶体是否属于分子晶体。
模型认知CO 和SiO 的结构
二、共价晶体
1. 概念:所有的相邻原子间都以共价键相结合而形 成空间立体网状结构的晶体。
(1)构成粒子:原子
(2)粒子间的作用力:共价键
( 3)结构特点:整块晶体是一个三维的共价键网 状结构,是一个“巨分子”,又 称共价晶体。
只由原子形成的晶体一定是共价晶体吗
稀有气体由单原子构成,属于分子晶体
共价晶体 金刚石 氮化硼 碳化硅 石英 硅
锗
熔点/℃ >3550 3000 2700 710 1410
121
硬 度 10 9.5 9.5 7 6.5
6.0
二、共价晶体
1、根据共价晶体的微观结构预测某些共价晶体的熔点和硬度
2.共价晶体的物理性质 熔点 高,硬度大 延展性 差 。
难溶于一般溶剂,不 导 电 ,
(1)某些单质:硼(B)、硅(Si)、锗(Ge)、金刚石
(2)某些非金属化合物:碳化硅(SiC)、氮化硼 (BN)
(3)某些氧化物:二氧化硅(SiO )、Al O 晶体(刚 玉 )
二、共价晶体
根据共价晶体的常见类型分析其微观结构的中心原子共价键 杂化类型
3.常见的共价晶体类型
1.怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依
次下降
结构相似的共价晶体,原子半径越小,键长越短,键能越大 晶体熔点越高:金刚石>硅>锗
学与问
2.“具有共价键的晶体叫做共价晶体”。这种说法对吗 为 什么
不对,分子晶体中通常也含有共价键,如CO 、O , 某些离 子晶体中也含共价键,如NaOH、NH Cl
在金刚石晶胞中含有的碳原子数
一、在金刚石晶胞中
含有的碳原子数:
8×1/8+6×1/2+4 =8
二、共价晶体
4.典型的共价晶体
金刚石晶胞
(b)
①每个碳与相 邻 4 个 碳以 _共价键结合,形成正四面体结构。
②键角为109°28',碳原子采取了 sp 杂化。
③最小碳环由6个C组成且不在同一平面内,每个C被_12个最小环共 用,每个环平均拥有1/2个C, 平 均 拥 有 1 个C-C 键。
④1mol 金刚石中含有的C-C共价键数2_mol。
(1)金刚石
①在晶体中,每个Si与 4 个O以共价键结合,形成 正四面体 结构;每正四面体占有 1 个Si, 2 个O。 故SiO,晶体中Si与0之为1:2 。
②最小环上有 12 个 原 子 ( 6 个Si和 6 个 0 ) 。 1molSiO, 晶体中含4 molSi-O 键。
(2)二氧化硅
二氧化硅
金刚石
晶体类型 共价晶体
分子晶体
概 念 相邻原子间以共价键相结 合而形成空间网状结构
分子间以分子间作用力结合
组成微粒 原子
分子
粒子间作用力 共价键
分子间作用力
熔沸点 很高
较低
硬 度 很大
较小
溶解性 不溶于任何溶剂
部分溶于水
导电性 不导电,个别为半导体
固体和熔化状态都不导电,部分 溶于水导电
熔化时破坏的 作用力 破坏共价键
一定破坏分子间作用力(有时还 破坏氢键,Sg熔化还破坏共价键)
小结:分子晶体与共价晶体的比较
