醛 酮 (教学课件)——高中化学人教版(2019)选择性必修三(共15张PPT)
文档属性
| 名称 | 醛 酮 (教学课件)——高中化学人教版(2019)选择性必修三(共15张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 21:07:23 | ||
图片预览





文档简介
(共15张PPT)
第九章 有机化合物
有机化合物结构特点与研究方法 第五课时醛酮
类别 官能团 代表物名称、 结构简式
主要反应类型
酮 0 (酮羰基) 丙 ch 配 C H
加成反应:能与H、HCN、NH、甲醇等
发生加成反应。
醛 O —C—H 醛基 乙醛 0 ( CH —S—H
(1)加成反应
(H一CN、NH,、R一NH,、CH,O-H、H等)发
生加成反应。
(2)氧化反应
①乙醛跟新制氢氧化铜反应,产生蓝色絮
状沉淀,加热后产生砖红色沉淀②银镜反
应③乙醛氧化为乙酸④乙醛使酸性KMnO,
溶液,溴水褪色。
(七)醛、酮
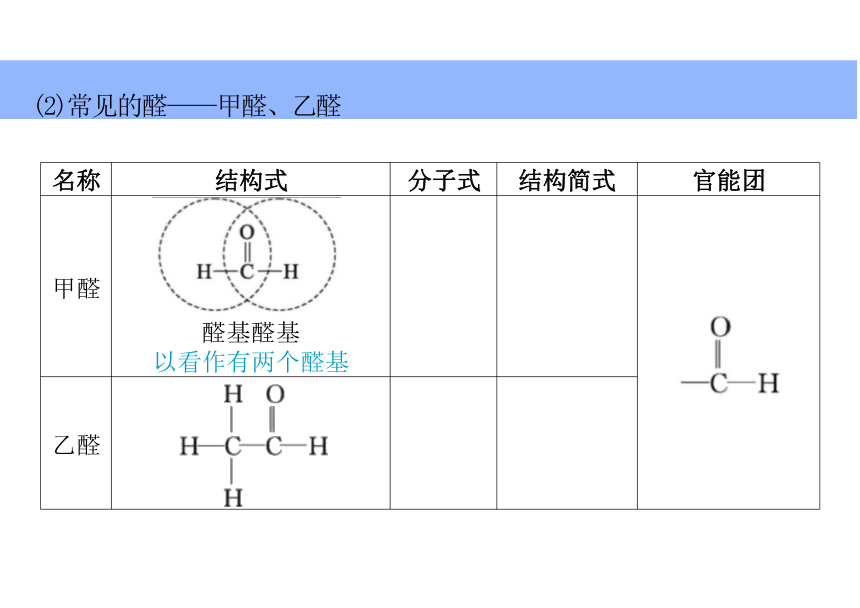
名称 结构式 分子式 结构简式
官能团
甲醛 醛基醛基 以看作有两个醛基
O
H
乙醛
(2)常见的醛——甲醛、乙醛
名称 颜色 常态 气味
溶解性
甲醛 无色 态 气味
水
乙醛 态
与水、乙醇等 互溶
(七)醛、酮
②甲醛、乙醛的物理性质:
醛类物质既有氧化性又有还原性,其氧化、还原关系为醇
以乙醛为例完成下列反应的化学方程式:
银镜反应
新制
Cu(OH)
乙 氧化 醛 反应
(3)醛的化学性质。
醛氧化羧酸。
点燃
2CH CHO+5O -
催化氧化
4CO +4H O
燃烧
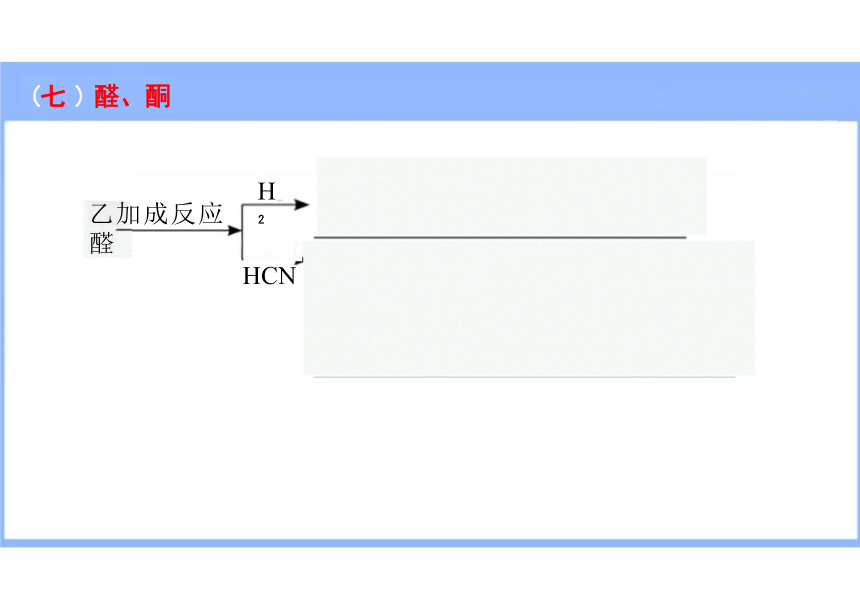
乙加成反应 醛
H
HCN
(七 ) 醛、酮
类型 与银氨溶液反应
与新制Cu(OH) 反应
反应 原理 RCHO+2[Ag(NH ) ]OH △
RCHO+2Cu(OH) +NaOH→
现象 产生
产生 沉淀
量的 关系 RCHO~2Ag;HCHO~4Ag
RCHO~2Cu(OH) ~Cu O
HCHO~4Cu(OH) ~2Cu O
注意 事项 (1)试管内壁必须洁净 (2)银氨溶液随用随配,不可久置 (3)水浴温热,不可用酒精灯直接加热 (4)乙醛用量不宜太多 (5)银镜可用稀硝酸浸泡除去
(1)新制Cu(OH) 要现用现配, 不可久置
(2)配制新制Cu(OH) 时,所用 NaOH溶液必须过量
(4)含醛基的有机化合物的特征反应及检验方法。
2.酮的结构与性质
(1)通式
①酮的结构简式可表示为
②饱和一元酮的组成通式为 (n≥3)。
①___ _发生银镜反应, ______被新制Cu(OH) 氧化。
②能发生加成反应
(3)丙酮。
丙酮是最简单的酮,是无色透明的液体,沸点56.2℃,易挥发,可与水、乙醇 等互溶,是重要的有机溶剂和化工原料。
(2)化学性质
易错辨析 判断正误:正确的画“ √”,错误的画“×”。
(1)甲醛分子中的所有原子都在同一平面上。( )
(2)醛基的结构简式可以写成—CHO, 也可以写成—COH。( )
(3)醛类既能被氧化为羧酸,又能被还原为醇。( )
(4)能发生银镜反应或与新制Cu(OH) 反应的物质一定是醛类物质。
( )
(5)乙醛不能使酸性KMnO 溶液和溴水褪色。(
(6)欲检验CH =CHCHO 分子中的官能团,应先检验“ ”后检验“— CHO” 。( )
随堂练习
1. (2022浙江6月选考)染料木黄酮的结构如图,下列说法正确的是( )
HO 0
A.分子中存在3种官能团 -OH
B.可与HBr反应 OH O
C.1 mol该物质与足量溴水反应,最多可消耗4 mol Br
D.1 mol该物质与足量NaOH 溶液反应,最多可消耗2 mol NaOH
针对训练
2. (2022湖北卷)同位素示踪是研究反应机理的重要手段之一。已知醛与
H O 在酸催化下存在如下 RCHO+H O RCH(OH) 。 据此推测,对
羟基苯甲醛与10倍量的 在少量酸催化下反应,达到平衡后,下列化合
物中含量最高的是( )
A. B.
C. D.
H
3.某甲酸溶液中可能含有少量甲醛,用下列方法可以证明的是( )
A.加入新制的Cu(OH) 加热,有红色沉淀产生,则含甲醛
B.能发生银镜反应,则含甲醛
C.先将试液充分进行酯化反应,收集生成物进行银镜反应,若有银镜产生, 则含甲醛
D.将该溶液与足量NaOH 溶液混合后蒸馏,若其蒸馏产物可发生银镜反应, 则含甲醛
选项 实验目的
操作
A 检验绿茶中是否含有酚类物质
向茶水中滴加FeCl 溶液
B 测定“84”消毒液的pH
用洁净的玻璃棒蘸取少许“84”消毒液 滴在pH试纸上
C 除去苯中混有的少量苯酚
向苯和苯酚的混合物中滴加溴水,过 滤后分液
D 实验室制备乙酸乙酯
向试管中依次加入浓硫酸、乙醇、乙 酸和碎瓷片,加热
4. (2022江苏苏州模拟)下列操作能达到相应实验目的的是( )
归纳总结
醛基与碳碳双键同时存在的有机化合物的官能团检验方法
醛基官能团能被弱氧化剂氧化,而碳碳双键不能被弱氧化剂氧化,只能被强 氧化剂氧化,所以可以用银氨溶液或新制Cu(OH) 检验醛基。而—CHO 与
都存在时,要检验 的存在,必须先用弱氧化剂将—CHO 氧
化后,再用强氧化剂检验 的存在。
(三)炔烃
第九章 有机化合物
有机化合物结构特点与研究方法 第五课时醛酮
类别 官能团 代表物名称、 结构简式
主要反应类型
酮 0 (酮羰基) 丙 ch 配 C H
加成反应:能与H、HCN、NH、甲醇等
发生加成反应。
醛 O —C—H 醛基 乙醛 0 ( CH —S—H
(1)加成反应
(H一CN、NH,、R一NH,、CH,O-H、H等)发
生加成反应。
(2)氧化反应
①乙醛跟新制氢氧化铜反应,产生蓝色絮
状沉淀,加热后产生砖红色沉淀②银镜反
应③乙醛氧化为乙酸④乙醛使酸性KMnO,
溶液,溴水褪色。
(七)醛、酮
名称 结构式 分子式 结构简式
官能团
甲醛 醛基醛基 以看作有两个醛基
O
H
乙醛
(2)常见的醛——甲醛、乙醛
名称 颜色 常态 气味
溶解性
甲醛 无色 态 气味
水
乙醛 态
与水、乙醇等 互溶
(七)醛、酮
②甲醛、乙醛的物理性质:
醛类物质既有氧化性又有还原性,其氧化、还原关系为醇
以乙醛为例完成下列反应的化学方程式:
银镜反应
新制
Cu(OH)
乙 氧化 醛 反应
(3)醛的化学性质。
醛氧化羧酸。
点燃
2CH CHO+5O -
催化氧化
4CO +4H O
燃烧
乙加成反应 醛
H
HCN
(七 ) 醛、酮
类型 与银氨溶液反应
与新制Cu(OH) 反应
反应 原理 RCHO+2[Ag(NH ) ]OH △
RCHO+2Cu(OH) +NaOH→
现象 产生
产生 沉淀
量的 关系 RCHO~2Ag;HCHO~4Ag
RCHO~2Cu(OH) ~Cu O
HCHO~4Cu(OH) ~2Cu O
注意 事项 (1)试管内壁必须洁净 (2)银氨溶液随用随配,不可久置 (3)水浴温热,不可用酒精灯直接加热 (4)乙醛用量不宜太多 (5)银镜可用稀硝酸浸泡除去
(1)新制Cu(OH) 要现用现配, 不可久置
(2)配制新制Cu(OH) 时,所用 NaOH溶液必须过量
(4)含醛基的有机化合物的特征反应及检验方法。
2.酮的结构与性质
(1)通式
①酮的结构简式可表示为
②饱和一元酮的组成通式为 (n≥3)。
①___ _发生银镜反应, ______被新制Cu(OH) 氧化。
②能发生加成反应
(3)丙酮。
丙酮是最简单的酮,是无色透明的液体,沸点56.2℃,易挥发,可与水、乙醇 等互溶,是重要的有机溶剂和化工原料。
(2)化学性质
易错辨析 判断正误:正确的画“ √”,错误的画“×”。
(1)甲醛分子中的所有原子都在同一平面上。( )
(2)醛基的结构简式可以写成—CHO, 也可以写成—COH。( )
(3)醛类既能被氧化为羧酸,又能被还原为醇。( )
(4)能发生银镜反应或与新制Cu(OH) 反应的物质一定是醛类物质。
( )
(5)乙醛不能使酸性KMnO 溶液和溴水褪色。(
(6)欲检验CH =CHCHO 分子中的官能团,应先检验“ ”后检验“— CHO” 。( )
随堂练习
1. (2022浙江6月选考)染料木黄酮的结构如图,下列说法正确的是( )
HO 0
A.分子中存在3种官能团 -OH
B.可与HBr反应 OH O
C.1 mol该物质与足量溴水反应,最多可消耗4 mol Br
D.1 mol该物质与足量NaOH 溶液反应,最多可消耗2 mol NaOH
针对训练
2. (2022湖北卷)同位素示踪是研究反应机理的重要手段之一。已知醛与
H O 在酸催化下存在如下 RCHO+H O RCH(OH) 。 据此推测,对
羟基苯甲醛与10倍量的 在少量酸催化下反应,达到平衡后,下列化合
物中含量最高的是( )
A. B.
C. D.
H
3.某甲酸溶液中可能含有少量甲醛,用下列方法可以证明的是( )
A.加入新制的Cu(OH) 加热,有红色沉淀产生,则含甲醛
B.能发生银镜反应,则含甲醛
C.先将试液充分进行酯化反应,收集生成物进行银镜反应,若有银镜产生, 则含甲醛
D.将该溶液与足量NaOH 溶液混合后蒸馏,若其蒸馏产物可发生银镜反应, 则含甲醛
选项 实验目的
操作
A 检验绿茶中是否含有酚类物质
向茶水中滴加FeCl 溶液
B 测定“84”消毒液的pH
用洁净的玻璃棒蘸取少许“84”消毒液 滴在pH试纸上
C 除去苯中混有的少量苯酚
向苯和苯酚的混合物中滴加溴水,过 滤后分液
D 实验室制备乙酸乙酯
向试管中依次加入浓硫酸、乙醇、乙 酸和碎瓷片,加热
4. (2022江苏苏州模拟)下列操作能达到相应实验目的的是( )
归纳总结
醛基与碳碳双键同时存在的有机化合物的官能团检验方法
醛基官能团能被弱氧化剂氧化,而碳碳双键不能被弱氧化剂氧化,只能被强 氧化剂氧化,所以可以用银氨溶液或新制Cu(OH) 检验醛基。而—CHO 与
都存在时,要检验 的存在,必须先用弱氧化剂将—CHO 氧
化后,再用强氧化剂检验 的存在。
(三)炔烃
