炔烃 (教学课件)——高中化学人教版(2019)选择性必修三(共14张PPT)
文档属性
| 名称 | 炔烃 (教学课件)——高中化学人教版(2019)选择性必修三(共14张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 21:08:23 | ||
图片预览




文档简介
(共14张PPT)
第二章烃 第2节烯烃、炔烃
第2课时炔烃
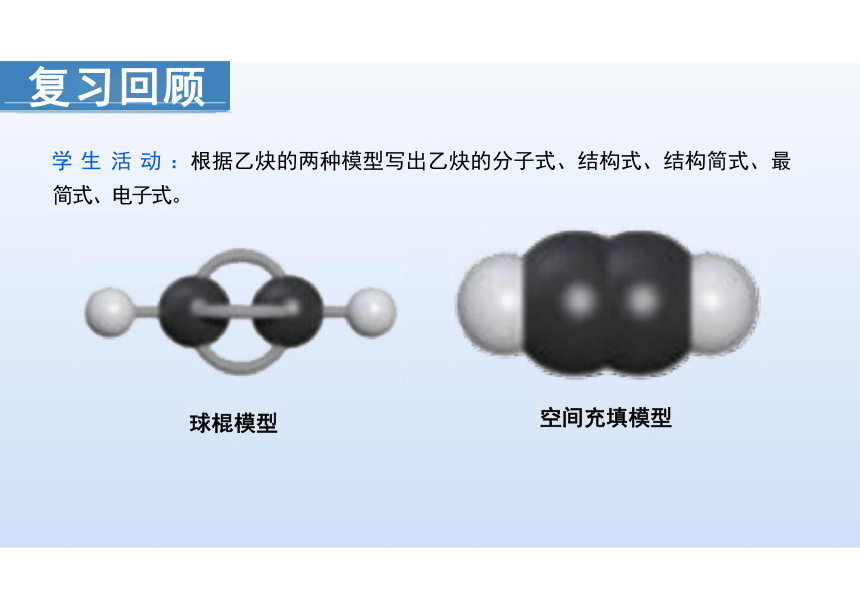
学 生 活 动 :根据乙炔的两种模型写出乙炔的分子式、结构式、结构简式、最
简式、电子式。
球棍模型 空间充填模型
复习回顾
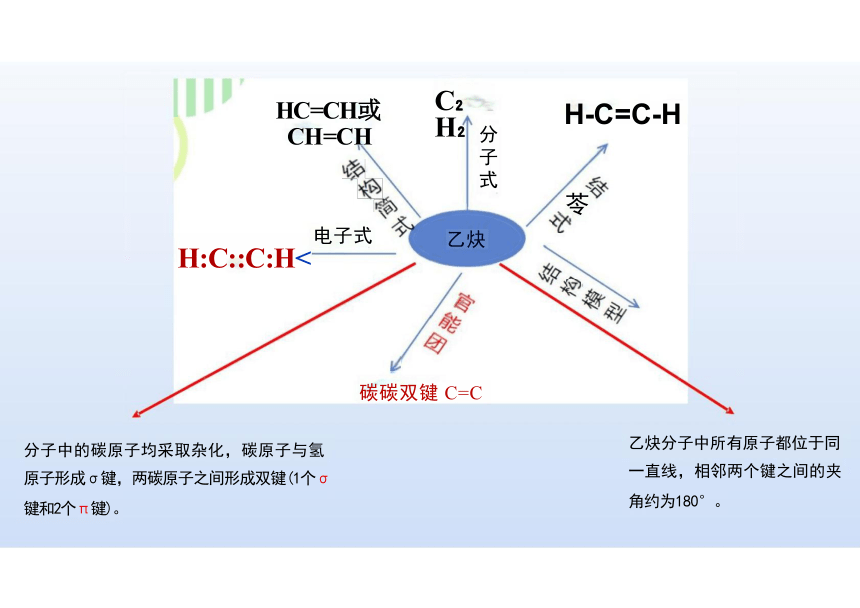
分子中的碳原子均采取杂化,碳原子与氢
原子形成σ键,两碳原子之间形成双键(1个σ 键和2个π键)。
乙炔分子中所有原子都位于同
一直线,相邻两个键之间的夹 角约为180°。
H-C=C-H
苓
电子式
H:C::C:H<
HC=CH或 CH=CH
碳碳双键 C=C
C H
分子式
乙炔
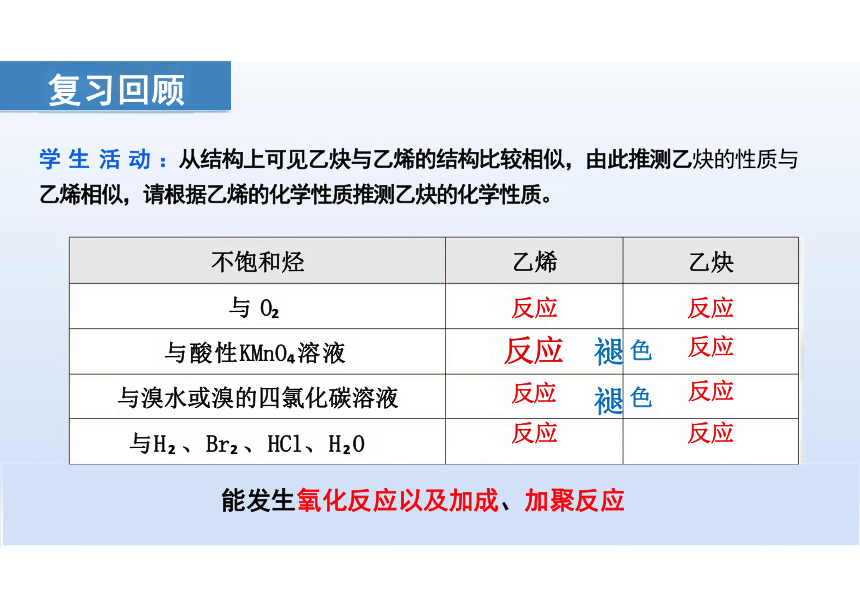
不饱和烃 乙烯
乙炔
与 O 反应
反应
与酸性KMnO 溶液 反应 褪
色 反应
与溴水或溴的四氯化碳溶液 反应 褪
色 反应
与H 、Br 、HCl、H O 反应
反应
能发生氧化反应以及加成、加聚反应
学 生 活 动 :从结构上可见乙炔与乙烯的结构比较相似,由此推测乙炔的性质与
乙烯相似,请根据乙烯的化学性质推测乙炔的化学性质。
复习回顾
炔烃的结构
1.定义:分子中含有碳碳三键的不饱和链烃
2.官能团:碳碳三键(—C=C—)
3.结构特点:碳碳三键碳原子均采取sp杂化,以碳碳三键为中心的4个 原子一定在同一直线
4.通式:链状单炔烃C H n- (n≥2) (与二烯烃、环烯烃相同)
炔烃的性质
一、炔烃的物理性质
1.乙炔(俗称电石气)是最简单的炔烃。乙炔是无色、无臭的气体, 微溶于水,易溶于有机溶剂。
2.炔烃的物理性质--递变规律与烷烃和烯烃相似
(1)炔烃的沸点随分子中碳原子数的递增而逐渐 升高碳原子数相同 时,支链越多,熔沸点越低。
(2)状态由气态(常温下,碳原子数_≤时)到液态、固态。
(3)炔烃几乎都_不溶于水,但可溶于有机溶剂。
(4)液态炔烃的密度均比水小 。
二、炔烃的化学性质
实验探究:乙炔的性质-通入酸性KMnO 溶液、通入溴的四氯化碳溶液、燃烧
炔烃的性质
二、炔烃的化学性质
1.氧化反应
a.可燃性 火焰明亮,并伴有浓烟
注意:乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
b.还原性
通入酸性高锰酸钾溶液,可以被酸性高锰酸钾氧化,而使高锰酸钾溶液褪色。
炔烃的性质
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
炔烃的性质
2.加成反应
a.与H 、Br 反应
CH=CH+H 催化剂CH
(
(少量氢气)
(足气)
1,2 -二溴乙烯
1,1,2,2-四溴乙烷
炔烃的性质
2.加成反应
b. 与HX 、H O反应
乙炔与HCI、H O以1:1比例发生反应的化学方程式
CH=CH+HCl化CH =CHCI(氯乙烯)
CH=CH+H O△CH CHO 乙醛
注 意 :乙炔与水加成后的产物乙烯醇(CH =CH-OH) 很不稳定,很快转化为乙醛。
炔烃的性质
3.加聚反应
n HC=CH 化剂+CH=CH 十 聚乙炔(导电塑料)
CH=CH+HCIl 化剂CH =CHCI( 氯乙 烯 )
聚氯乙烯( pvc塑料)
(1)实验药品:电石(CaC),常含有磷化钙,硫化钙等杂质
(2)原理:CaC +2H O—→Ca(OH) +CH=CH 个
乙炔的实验室制法
乙炔的实验室制取
发生装置除杂装置 检验装置 收集装置
使用CuSO 而不用NaOH除去H S PH 等杂质
CuSO +H S=CuSJ+H SO H S+CuSO =CuSl+H SO
8CuSO +2PH +8H O=8Cu|+2H PO +8H SO
反应放热,易使启普发生器炸裂
生成的Ca(OH) 呈糊状易堵塞球
形漏斗
电石一
取电石要用镊子夹取,切忌用手拿
使用饱和食盐水作为反应物,减小浓度、降低反应速率
⑤
乙炔的实验室制法
不能使用启普发生器:
反应剧烈,难控制;
食盐水
饱和
酸性
KMnO 溶液
③
( 3 ) 装 置 图 :使用前要先检查装置的气密性
CuSO 溶液
②
最好采取排水法,因为乙炔不溶于水
溴的 CCl 溶液
向下排空气法
④
①
谢谢大家!
第二章烃 第2节烯烃、炔烃
第2课时炔烃
学 生 活 动 :根据乙炔的两种模型写出乙炔的分子式、结构式、结构简式、最
简式、电子式。
球棍模型 空间充填模型
复习回顾
分子中的碳原子均采取杂化,碳原子与氢
原子形成σ键,两碳原子之间形成双键(1个σ 键和2个π键)。
乙炔分子中所有原子都位于同
一直线,相邻两个键之间的夹 角约为180°。
H-C=C-H
苓
电子式
H:C::C:H<
HC=CH或 CH=CH
碳碳双键 C=C
C H
分子式
乙炔
不饱和烃 乙烯
乙炔
与 O 反应
反应
与酸性KMnO 溶液 反应 褪
色 反应
与溴水或溴的四氯化碳溶液 反应 褪
色 反应
与H 、Br 、HCl、H O 反应
反应
能发生氧化反应以及加成、加聚反应
学 生 活 动 :从结构上可见乙炔与乙烯的结构比较相似,由此推测乙炔的性质与
乙烯相似,请根据乙烯的化学性质推测乙炔的化学性质。
复习回顾
炔烃的结构
1.定义:分子中含有碳碳三键的不饱和链烃
2.官能团:碳碳三键(—C=C—)
3.结构特点:碳碳三键碳原子均采取sp杂化,以碳碳三键为中心的4个 原子一定在同一直线
4.通式:链状单炔烃C H n- (n≥2) (与二烯烃、环烯烃相同)
炔烃的性质
一、炔烃的物理性质
1.乙炔(俗称电石气)是最简单的炔烃。乙炔是无色、无臭的气体, 微溶于水,易溶于有机溶剂。
2.炔烃的物理性质--递变规律与烷烃和烯烃相似
(1)炔烃的沸点随分子中碳原子数的递增而逐渐 升高碳原子数相同 时,支链越多,熔沸点越低。
(2)状态由气态(常温下,碳原子数_≤时)到液态、固态。
(3)炔烃几乎都_不溶于水,但可溶于有机溶剂。
(4)液态炔烃的密度均比水小 。
二、炔烃的化学性质
实验探究:乙炔的性质-通入酸性KMnO 溶液、通入溴的四氯化碳溶液、燃烧
炔烃的性质
二、炔烃的化学性质
1.氧化反应
a.可燃性 火焰明亮,并伴有浓烟
注意:乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
b.还原性
通入酸性高锰酸钾溶液,可以被酸性高锰酸钾氧化,而使高锰酸钾溶液褪色。
炔烃的性质
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
炔烃的性质
2.加成反应
a.与H 、Br 反应
CH=CH+H 催化剂CH
(
(少量氢气)
(足气)
1,2 -二溴乙烯
1,1,2,2-四溴乙烷
炔烃的性质
2.加成反应
b. 与HX 、H O反应
乙炔与HCI、H O以1:1比例发生反应的化学方程式
CH=CH+HCl化CH =CHCI(氯乙烯)
CH=CH+H O△CH CHO 乙醛
注 意 :乙炔与水加成后的产物乙烯醇(CH =CH-OH) 很不稳定,很快转化为乙醛。
炔烃的性质
3.加聚反应
n HC=CH 化剂+CH=CH 十 聚乙炔(导电塑料)
CH=CH+HCIl 化剂CH =CHCI( 氯乙 烯 )
聚氯乙烯( pvc塑料)
(1)实验药品:电石(CaC),常含有磷化钙,硫化钙等杂质
(2)原理:CaC +2H O—→Ca(OH) +CH=CH 个
乙炔的实验室制法
乙炔的实验室制取
发生装置除杂装置 检验装置 收集装置
使用CuSO 而不用NaOH除去H S PH 等杂质
CuSO +H S=CuSJ+H SO H S+CuSO =CuSl+H SO
8CuSO +2PH +8H O=8Cu|+2H PO +8H SO
反应放热,易使启普发生器炸裂
生成的Ca(OH) 呈糊状易堵塞球
形漏斗
电石一
取电石要用镊子夹取,切忌用手拿
使用饱和食盐水作为反应物,减小浓度、降低反应速率
⑤
乙炔的实验室制法
不能使用启普发生器:
反应剧烈,难控制;
食盐水
饱和
酸性
KMnO 溶液
③
( 3 ) 装 置 图 :使用前要先检查装置的气密性
CuSO 溶液
②
最好采取排水法,因为乙炔不溶于水
溴的 CCl 溶液
向下排空气法
④
①
谢谢大家!
