化学反应速率课件高中化学人教版(2019)选择性必修1(共23张PPT)
文档属性
| 名称 | 化学反应速率课件高中化学人教版(2019)选择性必修1(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-25 21:10:49 | ||
图片预览







文档简介
(共23张PPT)
第二章化学反应速率与化学平衡
第一节化学反应速率 第1课时化学反应速率
【思考与讨论】
在化学实验和日常生活中,我们经常观察到这样的现象:有的反
应进行的快,有的进行的慢。
你了解下图涉及的化学反应进行的快慢吗 反应的快慢程度与 我们有什么关系
橡胶老化
很慢
岩石风化
很慢
911事件
很快
很快
火柴燃烧的过程
【思考与讨论】
不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我 们以上的判断方法都是定性地描述反应的快慢。而在科学研究和实际 应用中,往往需要定量地描述一个反应的快慢。
什么是定性 什么是定量
例如:我们学过物理都知道:
(1)光的传播速度是很快的;
(2)光在空气中的传播速度3×108m/s。
定性描述
定量描述
【课堂练习】
在物理中我们是如何定量地判断一个物体移动速度快慢的
用速度来描述 :单位时间内物体移动的距离的大小
那么化学上又是如何定量地判断一个化学反应的快慢的呢
一、化学反应速率
1.定义
化学反应速率是用来衡量化学反应过程进行的快慢的物理量。如果 反应体系的体积时恒定的,则通常用单位时间内反应物或生成物浓度
(mol /L)的变化来表示化学反应速率。
2.数学表达式
3.常用单位 mol/(L·min)或 mol/(L·s) 或mol-L-1·min-1
注 :化学反应速率实际上是指某一段时间内化学反应的平均速率, 而不是某一时刻的瞬时速率。
【课堂练习】
1、在某一化学反应中,生成物B的浓度在5s内从0.5mol/L变成2.0m ol/L, 在这5s内B的化学反应速率为0.3mol/(L · s)。
2、一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气 体反应物还剩余6.8mol,这种反应物的化学反应速率为0.048mol/(L:min)
时间 N H
NH
t=0 s 4 mol/L 9 mol/L
0 mol/L
△c -1 mol/L -3 mol/L
2 mol/L
t=2 s 3 mol/L 6 mol/L
2 mol/L
V(B) 0.5 mol/(L · s) 1.5 mol/(L · s)
1.0 mol/(L · s)
思考1:各物质的浓度变化值△c之比、化学反应速率之比与方程式中它
们的计量数之比有什么关系
各物质的物质的量浓度变化值△c之比等于化学计量数之比 化学反应速率之比等于化学计量数之比
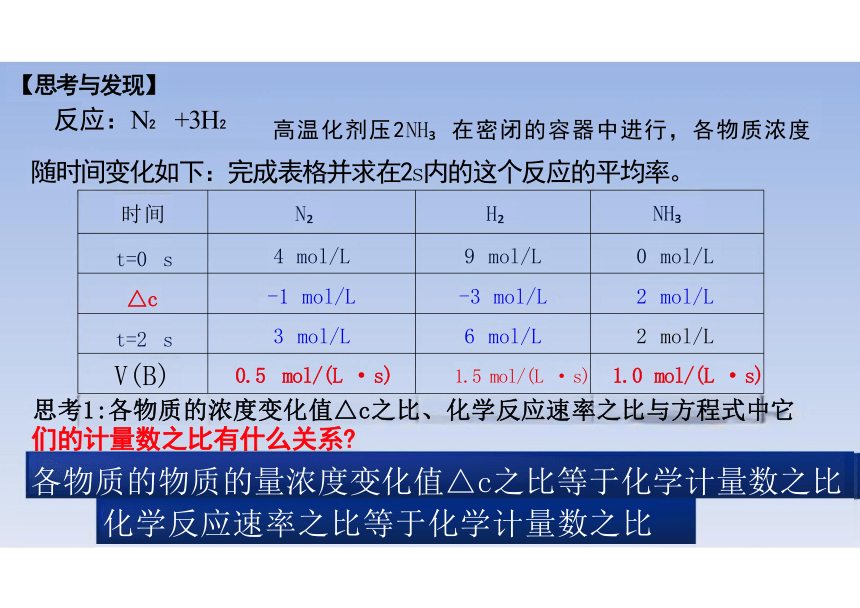
随时间变化如下:完成表格并求在2s内的这个反应的平均率。
【思考与发现】
反应:N +3H
高温化剂压2NH 在密闭的容器中进行,各物质浓度
时间 N H
NH
t=0 s 4 mol/L 9 mol/L
0 mol/L
△c 1 mol/L 3 mol/L
2 mol/L
t=2 s 3 mol/L 6 mol/L
2 mol/L
V(B) 0.5 mol/(L · s) 1.5 mol/(L · s)
1.0 mol/(L · s)
同一反应的速率可用不同物质来表示,其数值可能不同,
但表示的意义相同,所以需要指明具体物质 如 V(NO)
随时间变化如下:完成表格并求在2s内的这个反应的平均速率。
【思考与发现】
反应:N +3H
v(N )=0.5 mol/(L s)
v(NH )=1.0 mol/(L·s)
·
·
高温化剂压2NH 在密闭的容器中进行,各物质浓度
思考2:怎么表示这个反应的平均速率
v(H )=1.5 mol/(L s)
NH O NO
H O
△n物质的量(mol) 0.3 0.375 0.3
0.0
△c物质的量浓度(mol/L) 0.06 0.075 0.06
0.0
速率(mol/(L · s)) 0.002 0.0025 0.002
比例 4 :5:4
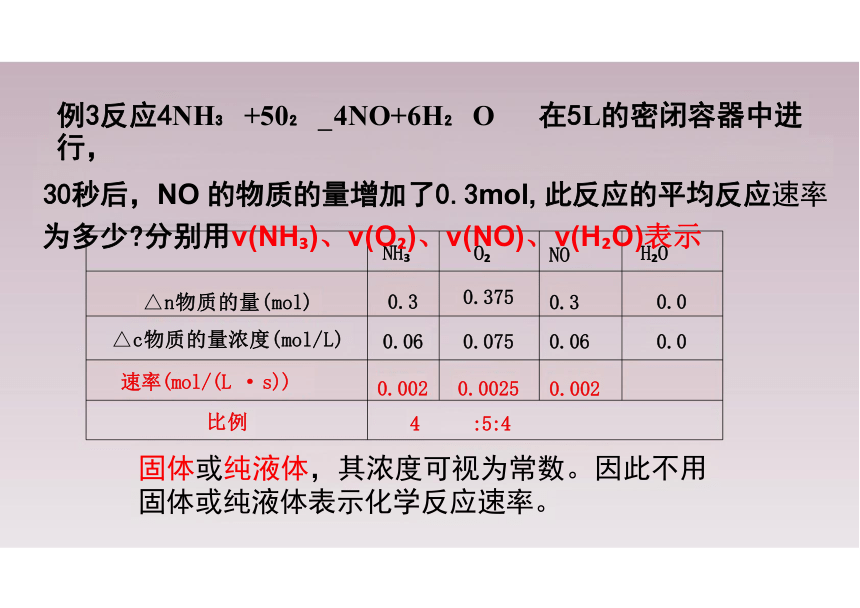
例3反应4NH +50 4NO+6H O 在5L的密闭容器中进行,
30秒后,NO 的物质的量增加了0.3mol, 此反应的平均反应速率 为多少 分别用v(NH )、v(O )、v(NO)、v(H O)表示
固体或纯液体,其浓度可视为常数。因此不用 固体或纯液体表示化学反应速率。
化学反应速率的注意事项
(1)化学反应速率指平均速率,不是瞬时速率,是标量。
(2)同一反应用不同的物质来表示速率, 需要指明具体物质,如V(co)。
(3)同一化学反应:aA+bB=cC+dD,
有V(A):V(B):V(C):V(D)= a:b:c:d
△cA): △C(B):△C(c):△Co)= a:b:c:d
△n(A):△n(B):△n(c):△n(o)=a:b:c:d
(4)不用固体或纯液体表示化学反应速率。
预习效果验收一
1.判断正误(正确的打“ √”,错误的打“×”)。
(1)对于反应 H +Cl ===2HCl, 化学反应速率可表示为 v=a mol·L-1.s-1 。 (×)
(2)化学反应速率为一段时间内的平均速率。 ( )
(3)化学反应速率可以为负值,如逆反应速率。 (×)
(4)同一化学反应中不同物质的速率之比等于对应的浓度变化之 比,还等于对应物质的物质的量变化之比。 ( √_)
①写出有关反应的化学方程式。
②找出各物质的起始量、变化量、某时刻量
③ 根据已知条件列方程式计算。
时间 N H
NH
t=0 s 4 mol/L 9 mol/L
0 mol/L
△c 1 mol/L 3 mol/L
2 mol/L
t=2 s 3 mol/L 6 mol/L
2 mol/L
V(B) 0.5 mol/(L · s) 1.5 mol(L · s)
1.0 mol/(L · s)
总结
化学反应速率的计算
该反应物的变化量 该反应物的起始量
www unjs.oom
(2)“三段式”法
(3)转化率:反应的转化率=
(1)公式法
常 见 题 型 :
1.用不同的物质来表示反应速率。
例1.反应4NH +50 =4NO+6H O 在5L的密闭容器中进行,
30s后 ,NO 的物质的量增加了0.3mol, 则此反应的平均速率可
表示为( D )
A 、V(o =0.01 mol/L·s B 、V(No)=0.008 mol/L·s
C 、V(H o)=0.003 mol/L·s D 、V(Nh =0.002 mol/L·s
再根据各物质的反应速率之比等于计量数之比。
3、已 知 4NH +50 =4NO+6H O, 则下列关系式正确的是( D )
A.4/5v(NH )=v(O ) B.4/5v(NH )=v(H O)
C.5/6v(O )=v(H O) D.4/5v(O )=v(NO)
2.比较反应速率的大小
例1、对化学反应2A(g)+B(g)=3C(g)+4D(g), 下列选项中表
示该反应速率最快的是 A
A.v(A)=0.6 mol/(L·s) B.v(B)=0.2 mol/(L·s) C.v(C)=0.8 mol/(L·s) D.v(D)=1.0 mol/(L·s)
方法归纳:比较反应速率常用方法
1、归 一 法,即按速率之比等于化学计量数之比转化为用同一物质表示的速率,
2、比 值 法 ,即由某物质表示的速率与该物质的化学计量数之比,比值越大,速
率越快.
3.根据各物质的反应速率之比写出化学方程式。
例.某温度下,浓度都是1mol/L的两种气体X 和Y , 在密闭容 器中反应生成气体Z, 经过t min后,测得物质的量浓度分别为:
c(X )=0.4mol/L,c(Y )=0.8mol/L ,c(Z)=0.4mol/L,则该反应的 反应方程式可表示为:
3X +Y =2X Y
练一练
一定温度下,在2 L密闭容器中,A、B、C 三种气 体的物质的量随时间变化的曲线如图所示。下列说
法正确的是C
A.a点时,u(A)=u(B)
B.反应开始到5min,B 的物质的量增加了0.2 mol
C.反应的化学方程式为:3A=2B+C
D.反应开始到5min,u(C)=0.04 mol/(L ·min)
a
B
C
5
0.6
0.4
0.g
n/mo 0.8
y/min
A
练一练.
根据下图回答:
5
C
B
1、反应物是__A、B
2 、2min内A的平均速率是2.5 mol/(L·s)
3、写出化学方程式 5A+4B=4C
1 2 A
t(min)
物 质 的 量 浓 度 ( m 1 / 1 )
rCtc A
化学反应速率的测定
定性描述:(根据实验现象)
①观察产生气泡的快、慢;
②观察试管中剩余锌粒的质量的多、少;
③用手触摸试管,感受试管外壁温度的高、低
化学反应速率是通过实验测定的。
气体 压强 选择可观测、 颜色 易操作的变量 pH
离子浓度 浑浊度
颜色
电导率
找与化学反应物质的浓度相关的物理量
v=At
找与该物理量化学变化对应的时间
体积
高锰酸钾溶液与草酸反应, 记录溶液褪色的时间
pH计 浊度仪
化学反应速率的测定
实验原理
集气法 注射法
读数时注意:
(1)恢复到室温状态
(2)调节量气管高度,使量气管与水准管两端液面相平
(3)视线与量气管凹液面最低处相平
气体体积的测定
25
化学反应速率的测定
H O 溶液
MnO
硫酸
锌粒
50
MnO
H O 溶液
量气管
【思维转变】通过气体体积的测定可实现反应速率的测定,同样的
通过气体质量的变化的测定也可实现反应速率的测定。
如图,A 为碳酸钠与稀硫酸 的反应装置。通过测定产生 的CO 的质量,可实现该反 应的反应速率的测定。
样品
B C
碱石灰
D
稀硫酸
碱石灰
测量化学反应速率的常见方法
1、量气法
2、比色法
3、电导法
4、激光技术法
第二章化学反应速率与化学平衡
第一节化学反应速率 第1课时化学反应速率
【思考与讨论】
在化学实验和日常生活中,我们经常观察到这样的现象:有的反
应进行的快,有的进行的慢。
你了解下图涉及的化学反应进行的快慢吗 反应的快慢程度与 我们有什么关系
橡胶老化
很慢
岩石风化
很慢
911事件
很快
很快
火柴燃烧的过程
【思考与讨论】
不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我 们以上的判断方法都是定性地描述反应的快慢。而在科学研究和实际 应用中,往往需要定量地描述一个反应的快慢。
什么是定性 什么是定量
例如:我们学过物理都知道:
(1)光的传播速度是很快的;
(2)光在空气中的传播速度3×108m/s。
定性描述
定量描述
【课堂练习】
在物理中我们是如何定量地判断一个物体移动速度快慢的
用速度来描述 :单位时间内物体移动的距离的大小
那么化学上又是如何定量地判断一个化学反应的快慢的呢
一、化学反应速率
1.定义
化学反应速率是用来衡量化学反应过程进行的快慢的物理量。如果 反应体系的体积时恒定的,则通常用单位时间内反应物或生成物浓度
(mol /L)的变化来表示化学反应速率。
2.数学表达式
3.常用单位 mol/(L·min)或 mol/(L·s) 或mol-L-1·min-1
注 :化学反应速率实际上是指某一段时间内化学反应的平均速率, 而不是某一时刻的瞬时速率。
【课堂练习】
1、在某一化学反应中,生成物B的浓度在5s内从0.5mol/L变成2.0m ol/L, 在这5s内B的化学反应速率为0.3mol/(L · s)。
2、一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气 体反应物还剩余6.8mol,这种反应物的化学反应速率为0.048mol/(L:min)
时间 N H
NH
t=0 s 4 mol/L 9 mol/L
0 mol/L
△c -1 mol/L -3 mol/L
2 mol/L
t=2 s 3 mol/L 6 mol/L
2 mol/L
V(B) 0.5 mol/(L · s) 1.5 mol/(L · s)
1.0 mol/(L · s)
思考1:各物质的浓度变化值△c之比、化学反应速率之比与方程式中它
们的计量数之比有什么关系
各物质的物质的量浓度变化值△c之比等于化学计量数之比 化学反应速率之比等于化学计量数之比
随时间变化如下:完成表格并求在2s内的这个反应的平均率。
【思考与发现】
反应:N +3H
高温化剂压2NH 在密闭的容器中进行,各物质浓度
时间 N H
NH
t=0 s 4 mol/L 9 mol/L
0 mol/L
△c 1 mol/L 3 mol/L
2 mol/L
t=2 s 3 mol/L 6 mol/L
2 mol/L
V(B) 0.5 mol/(L · s) 1.5 mol/(L · s)
1.0 mol/(L · s)
同一反应的速率可用不同物质来表示,其数值可能不同,
但表示的意义相同,所以需要指明具体物质 如 V(NO)
随时间变化如下:完成表格并求在2s内的这个反应的平均速率。
【思考与发现】
反应:N +3H
v(N )=0.5 mol/(L s)
v(NH )=1.0 mol/(L·s)
·
·
高温化剂压2NH 在密闭的容器中进行,各物质浓度
思考2:怎么表示这个反应的平均速率
v(H )=1.5 mol/(L s)
NH O NO
H O
△n物质的量(mol) 0.3 0.375 0.3
0.0
△c物质的量浓度(mol/L) 0.06 0.075 0.06
0.0
速率(mol/(L · s)) 0.002 0.0025 0.002
比例 4 :5:4
例3反应4NH +50 4NO+6H O 在5L的密闭容器中进行,
30秒后,NO 的物质的量增加了0.3mol, 此反应的平均反应速率 为多少 分别用v(NH )、v(O )、v(NO)、v(H O)表示
固体或纯液体,其浓度可视为常数。因此不用 固体或纯液体表示化学反应速率。
化学反应速率的注意事项
(1)化学反应速率指平均速率,不是瞬时速率,是标量。
(2)同一反应用不同的物质来表示速率, 需要指明具体物质,如V(co)。
(3)同一化学反应:aA+bB=cC+dD,
有V(A):V(B):V(C):V(D)= a:b:c:d
△cA): △C(B):△C(c):△Co)= a:b:c:d
△n(A):△n(B):△n(c):△n(o)=a:b:c:d
(4)不用固体或纯液体表示化学反应速率。
预习效果验收一
1.判断正误(正确的打“ √”,错误的打“×”)。
(1)对于反应 H +Cl ===2HCl, 化学反应速率可表示为 v=a mol·L-1.s-1 。 (×)
(2)化学反应速率为一段时间内的平均速率。 ( )
(3)化学反应速率可以为负值,如逆反应速率。 (×)
(4)同一化学反应中不同物质的速率之比等于对应的浓度变化之 比,还等于对应物质的物质的量变化之比。 ( √_)
①写出有关反应的化学方程式。
②找出各物质的起始量、变化量、某时刻量
③ 根据已知条件列方程式计算。
时间 N H
NH
t=0 s 4 mol/L 9 mol/L
0 mol/L
△c 1 mol/L 3 mol/L
2 mol/L
t=2 s 3 mol/L 6 mol/L
2 mol/L
V(B) 0.5 mol/(L · s) 1.5 mol(L · s)
1.0 mol/(L · s)
总结
化学反应速率的计算
该反应物的变化量 该反应物的起始量
www unjs.oom
(2)“三段式”法
(3)转化率:反应的转化率=
(1)公式法
常 见 题 型 :
1.用不同的物质来表示反应速率。
例1.反应4NH +50 =4NO+6H O 在5L的密闭容器中进行,
30s后 ,NO 的物质的量增加了0.3mol, 则此反应的平均速率可
表示为( D )
A 、V(o =0.01 mol/L·s B 、V(No)=0.008 mol/L·s
C 、V(H o)=0.003 mol/L·s D 、V(Nh =0.002 mol/L·s
再根据各物质的反应速率之比等于计量数之比。
3、已 知 4NH +50 =4NO+6H O, 则下列关系式正确的是( D )
A.4/5v(NH )=v(O ) B.4/5v(NH )=v(H O)
C.5/6v(O )=v(H O) D.4/5v(O )=v(NO)
2.比较反应速率的大小
例1、对化学反应2A(g)+B(g)=3C(g)+4D(g), 下列选项中表
示该反应速率最快的是 A
A.v(A)=0.6 mol/(L·s) B.v(B)=0.2 mol/(L·s) C.v(C)=0.8 mol/(L·s) D.v(D)=1.0 mol/(L·s)
方法归纳:比较反应速率常用方法
1、归 一 法,即按速率之比等于化学计量数之比转化为用同一物质表示的速率,
2、比 值 法 ,即由某物质表示的速率与该物质的化学计量数之比,比值越大,速
率越快.
3.根据各物质的反应速率之比写出化学方程式。
例.某温度下,浓度都是1mol/L的两种气体X 和Y , 在密闭容 器中反应生成气体Z, 经过t min后,测得物质的量浓度分别为:
c(X )=0.4mol/L,c(Y )=0.8mol/L ,c(Z)=0.4mol/L,则该反应的 反应方程式可表示为:
3X +Y =2X Y
练一练
一定温度下,在2 L密闭容器中,A、B、C 三种气 体的物质的量随时间变化的曲线如图所示。下列说
法正确的是C
A.a点时,u(A)=u(B)
B.反应开始到5min,B 的物质的量增加了0.2 mol
C.反应的化学方程式为:3A=2B+C
D.反应开始到5min,u(C)=0.04 mol/(L ·min)
a
B
C
5
0.6
0.4
0.g
n/mo 0.8
y/min
A
练一练.
根据下图回答:
5
C
B
1、反应物是__A、B
2 、2min内A的平均速率是2.5 mol/(L·s)
3、写出化学方程式 5A+4B=4C
1 2 A
t(min)
物 质 的 量 浓 度 ( m 1 / 1 )
rCtc A
化学反应速率的测定
定性描述:(根据实验现象)
①观察产生气泡的快、慢;
②观察试管中剩余锌粒的质量的多、少;
③用手触摸试管,感受试管外壁温度的高、低
化学反应速率是通过实验测定的。
气体 压强 选择可观测、 颜色 易操作的变量 pH
离子浓度 浑浊度
颜色
电导率
找与化学反应物质的浓度相关的物理量
v=At
找与该物理量化学变化对应的时间
体积
高锰酸钾溶液与草酸反应, 记录溶液褪色的时间
pH计 浊度仪
化学反应速率的测定
实验原理
集气法 注射法
读数时注意:
(1)恢复到室温状态
(2)调节量气管高度,使量气管与水准管两端液面相平
(3)视线与量气管凹液面最低处相平
气体体积的测定
25
化学反应速率的测定
H O 溶液
MnO
硫酸
锌粒
50
MnO
H O 溶液
量气管
【思维转变】通过气体体积的测定可实现反应速率的测定,同样的
通过气体质量的变化的测定也可实现反应速率的测定。
如图,A 为碳酸钠与稀硫酸 的反应装置。通过测定产生 的CO 的质量,可实现该反 应的反应速率的测定。
样品
B C
碱石灰
D
稀硫酸
碱石灰
测量化学反应速率的常见方法
1、量气法
2、比色法
3、电导法
4、激光技术法
