2.2.2炔烃 -(教学课件)-高中化学人教版(2019)选择性必修3(共16张PPT)
文档属性
| 名称 | 2.2.2炔烃 -(教学课件)-高中化学人教版(2019)选择性必修3(共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-26 12:38:24 | ||
图片预览






文档简介
(共16张PPT)
2.2乙烯烯烃炔烃
乙炔
三、乙炔
1、表示
分子式:
电子式:
结构式:
结构简式:
实验式/最简式:
sp
H 一 H
o键 π键
①C采取sP_杂化,共有_3个o键,2_ 个 π键,键角约为180 °。
② 直线形分子,4个原子共直线。
三、乙炔
2、结构
H-C=C-H
最多 8 个原子共平面
③CH —CH —CH=CH——C=C—CH
最多 7 个碳原子共平 面 11
最多 个原子共平面
练 习:①CH —CH —C=CH
②CH =CH—C=CH
最多_4_个原子共直线
最多4个原子共直线
三、乙炔
三、乙炔
3、实验室制乙炔
阅读教材选修三P37 找到实验室制备乙炔的物质
1)原理:CaC +H O→
杂质(CaS、Ca P )
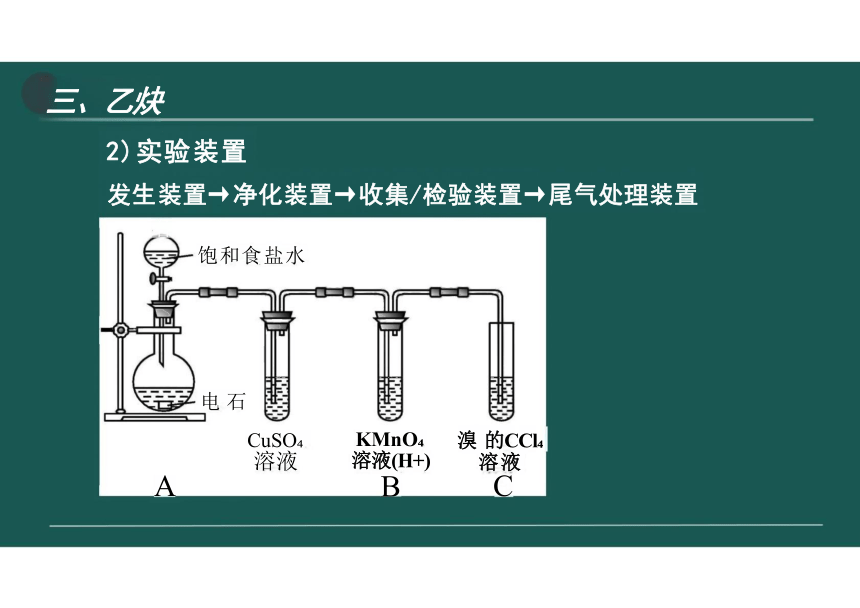
2)实验装置
发生装置→净化装置→收集/检验装置→尾气处理装置
→H-C=C-H个 +Ca(0H)
Ca2+[C=C ]2-+
H-0H
H-0H
三、乙炔
2)实验装置
发生装置→净化装置→收集/检验装置→尾气处理装置
各
饱和食盐水
电 石
A
溴 的CCl 溶液
C
KMnO 溶液(H+)
B
CuSO 溶液
实验内容
实验现象
(1)将饱和氯化钠溶液滴入盛有 电石的烧瓶中。
反应剧烈,放热,有气体产生
(2)将纯净的乙炔通入盛有酸性 高锰酸钾溶液的试管中。
酸性高锰酸钾溶液褪色
(3)将纯净的乙炔通入盛有溴的 四氯化碳溶液的试管中。
溴的四氯化碳溶液褪色
(4)点燃纯净的乙炔
产生明亮的火焰,有黑烟
三、乙炔
完成教材选修三P38 实验现象
三、乙炔
2)实验装置
注:①饱和食盐水:减小电石与水的反应速率
②导管口塞棉花:防止电石反应产生的浮渣堵塞导管
③制取乙炔不能用启普发生器
A.反应剧烈,难控制
B.反应放热,易使启普发生器炸裂。
C.生成的Ca(OH) 呈糊状易堵塞球形漏斗。
三、乙炔
4、乙炔的物理性质
无色、无臭气体,微溶于水,易溶于有机溶剂
5、乙炔的化学性质
1)氧化反应
①可燃性
2CHECH+50,点燃4CO +2H ,O
现象:火焰明亮,伴有浓烟
阅读教材选修三 P39 资料卡片找到氧炔焰的温度及用途
注:氧炔焰3000℃可切割/焊接金属
三、乙炔
5、乙炔的化学性质
②与KMnO (H+)
CH=CH KMnO4 2cO
2)加成反应
已知:键能:Ec=c=812kJ/mol、Ec=c=615kJ/mol、 Ec-c=348kJ/mol, 请预测乙炔加成的断键过程
三、乙炔
阅读教材选修三 P39 最下方文字,烯醇会转化为什么
3)加聚反应
阅读教材选修三 P40【 科学 · 技术 · 社会】,聚乙炔能导电的原因
1、定义:分子里含有-C=C- 的不饱和烃
2、通 式 :CnH n-2(n≥2)
3、炔烃的物理性质
1)随C 数个熔沸点I C2~4为气态
2)随C数个相对密度个
4、炔烃的化学性质
1)氧化反应 ① 与O
②KMnO (H+)
四、炔烃
四、炔烃
2)加成反应
请写出CH -C=CH 与足量H 的加成反应方程式
练:C—
由单烯烃加成而得,烯烃的结构简式可能有____ _ _ 种 ; 由单炔烃加成而得,炔烃的结构简式可能有 _种。
四、炔烃
3)加聚反应
5、命名
1)找主链 含三键
2)定支链 近三雏
3)写名称
四、炔烃
6、同分异构体
2.2乙烯烯烃炔烃
乙炔
三、乙炔
1、表示
分子式:
电子式:
结构式:
结构简式:
实验式/最简式:
sp
H 一 H
o键 π键
①C采取sP_杂化,共有_3个o键,2_ 个 π键,键角约为180 °。
② 直线形分子,4个原子共直线。
三、乙炔
2、结构
H-C=C-H
最多 8 个原子共平面
③CH —CH —CH=CH——C=C—CH
最多 7 个碳原子共平 面 11
最多 个原子共平面
练 习:①CH —CH —C=CH
②CH =CH—C=CH
最多_4_个原子共直线
最多4个原子共直线
三、乙炔
三、乙炔
3、实验室制乙炔
阅读教材选修三P37 找到实验室制备乙炔的物质
1)原理:CaC +H O→
杂质(CaS、Ca P )
2)实验装置
发生装置→净化装置→收集/检验装置→尾气处理装置
→H-C=C-H个 +Ca(0H)
Ca2+[C=C ]2-+
H-0H
H-0H
三、乙炔
2)实验装置
发生装置→净化装置→收集/检验装置→尾气处理装置
各
饱和食盐水
电 石
A
溴 的CCl 溶液
C
KMnO 溶液(H+)
B
CuSO 溶液
实验内容
实验现象
(1)将饱和氯化钠溶液滴入盛有 电石的烧瓶中。
反应剧烈,放热,有气体产生
(2)将纯净的乙炔通入盛有酸性 高锰酸钾溶液的试管中。
酸性高锰酸钾溶液褪色
(3)将纯净的乙炔通入盛有溴的 四氯化碳溶液的试管中。
溴的四氯化碳溶液褪色
(4)点燃纯净的乙炔
产生明亮的火焰,有黑烟
三、乙炔
完成教材选修三P38 实验现象
三、乙炔
2)实验装置
注:①饱和食盐水:减小电石与水的反应速率
②导管口塞棉花:防止电石反应产生的浮渣堵塞导管
③制取乙炔不能用启普发生器
A.反应剧烈,难控制
B.反应放热,易使启普发生器炸裂。
C.生成的Ca(OH) 呈糊状易堵塞球形漏斗。
三、乙炔
4、乙炔的物理性质
无色、无臭气体,微溶于水,易溶于有机溶剂
5、乙炔的化学性质
1)氧化反应
①可燃性
2CHECH+50,点燃4CO +2H ,O
现象:火焰明亮,伴有浓烟
阅读教材选修三 P39 资料卡片找到氧炔焰的温度及用途
注:氧炔焰3000℃可切割/焊接金属
三、乙炔
5、乙炔的化学性质
②与KMnO (H+)
CH=CH KMnO4 2cO
2)加成反应
已知:键能:Ec=c=812kJ/mol、Ec=c=615kJ/mol、 Ec-c=348kJ/mol, 请预测乙炔加成的断键过程
三、乙炔
阅读教材选修三 P39 最下方文字,烯醇会转化为什么
3)加聚反应
阅读教材选修三 P40【 科学 · 技术 · 社会】,聚乙炔能导电的原因
1、定义:分子里含有-C=C- 的不饱和烃
2、通 式 :CnH n-2(n≥2)
3、炔烃的物理性质
1)随C 数个熔沸点I C2~4为气态
2)随C数个相对密度个
4、炔烃的化学性质
1)氧化反应 ① 与O
②KMnO (H+)
四、炔烃
四、炔烃
2)加成反应
请写出CH -C=CH 与足量H 的加成反应方程式
练:C—
由单烯烃加成而得,烯烃的结构简式可能有____ _ _ 种 ; 由单炔烃加成而得,炔烃的结构简式可能有 _种。
四、炔烃
3)加聚反应
5、命名
1)找主链 含三键
2)定支链 近三雏
3)写名称
四、炔烃
6、同分异构体
