2-3化学反应的方向课件(共29张PPT)高中化学人教版2019选择性必修一
文档属性
| 名称 | 2-3化学反应的方向课件(共29张PPT)高中化学人教版2019选择性必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-26 12:57:03 | ||
图片预览








文档简介
(共29张PPT)
第二章化学反应速率与化学平衡
第三节 化学反应的方向
课程目标
1、知道化学反应是有方向的。
2、知道化学反应的方向与反应的焓变 和熵变有关。
3、能判断熵的变化(熵增或熵减)
4 、能判断简单反应能否自发进行。
排水:借助水泵, 持续消耗电能
低处
飞流直下:
不借助外力 高处
自发
非自发
初步认识
自发过程:
一定的条件下,不需要其它外力作用就能自动进行 的反应称为自发过程。
举例生活中的自发过程
冰融化
墨水扩散
自发反应:
在给定条件下,可以自发进行到显著程度的化学 反应称为自发反应。
初步认识
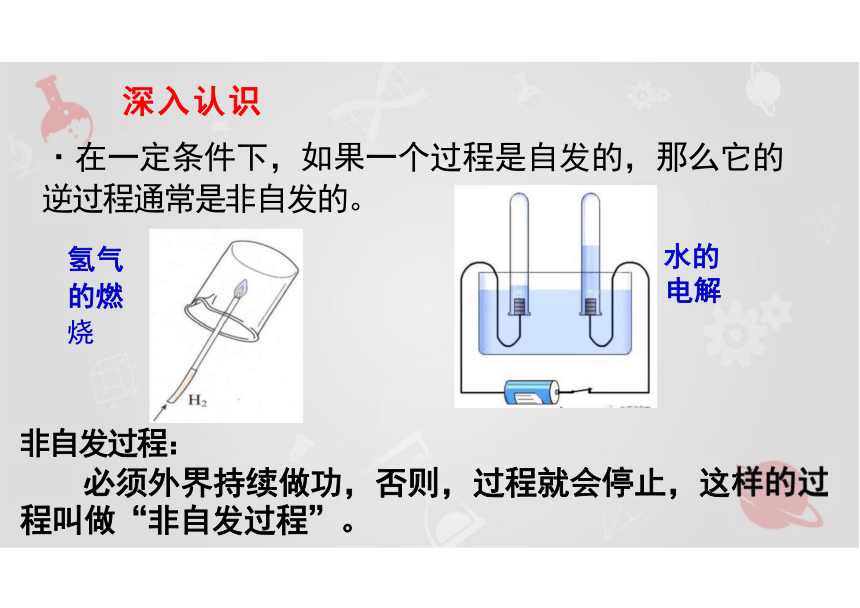
深入认识
·在一定条件下,如果一个过程是自发的,那么它的
逆过程通常是非自发的。
非自发过程:
必须外界持续做功,否则,过程就会停止,这样的过 程叫做“非自发过程”。
氢气 水的
的燃 电解
烧
深入认识
●“自发”只是有发生的趋势,并不代表实际发生,更不
能确定发生的速率。“非自发“也不代表不能发生。
处于高水位的水有 向低处流动的趋势 但是现在被大坝拦 截,此过程并没有 实际发生,但是有 发生的趋势。
深入认识
· “自发”是一定条件下的自发,条件变了,可能由原来
的“自发”变成“非自发”。
春天冰融水自发
冬天水结冰自发
思考交流
你们认为什么类型的化学反应更 容易发生呢
任务 一 化学反应方向的焓判据
分析下列反应进行的方向与△H之间的关系:
①2Na(s)+2H2O(1)====2NaOH(aq)+H2(g),该反应是放_ _ 热 反应,△H≤_0,常温下能自发进行。
②4Fe(OH)2(s)+2H2O(1)+02(g)====4Fe(OH)3(s),在常温 下能自发进行,该反应的△H__0。
行的倾向。19世纪,化学家就认为反应热是决定化学 反应是否自发进行的因素,即△H<0 的放热反应都可 以自发进行,而△H>0 的吸热反应则不能自发进行, 提出用焓变来判断反应进行的方向,这就是所谓的焓 判据。
能量趋于降低,△H<0,有自发进行倾向。
任务一化学反应方向的焓判据
放热反应过程中体系能量降低,因此具有自发进
思考交流
只有放热反应才能自发进行吗
氢氧化钡晶体和氯化铵晶体反应吸收热量
局限性
科学家由此提出用焓变来判断反应进行的方向。
多数能自发进行的化学反应是放热反应,但有些吸热反应
归纳小结
放热反应过程中体系能量降低,因此具有自发进行的倾向,
也能自发进行,因此,反应的焓变是与反应进行方向有关的因素
之一,但不是决定反应能否自发进行的唯一因素。
①放在同一密闭容器中的不同种气态物质(包括液态 物质或能够挥发的固态物质的蒸汽),不需要外界的任何 作用,气态物质会通过分子的扩散自发地形成均匀混合物。
②相互接触的固体物质体系,长期放置后,通过扩散 发现进入到另一种固体中的分子或原子。
③硝酸铵溶于水要吸热,它却能够自发地向水中扩散。
④有序排列的火柴散落时成为无序排列——有趋于最 大混乱度的倾向。
其他自发过程
空气
玻璃板— 二氧化氮
任务二化学反应方向的熵判据
德国科学家克劳修斯(R.Clausius) 最早 提出了另一个推动体系变化的因素,并称 之 为 “ 熵 ”(符号S) 的概念,用熵表示体 系混乱度,S=Q/T。
玻尔兹曼通过数学模型的建立得出微观状态数与熵有 数学关系,具体解释了熵的物理意义: S=k log W,
建立了熵与概率的关系,被誉为最美的三个公式之一。 其他两个公式分别为牛顿运动定律F =ma,爱因斯坦质 能关系E=mc2。
熵 (S): 是用来量度混乱(或无序)的程度。
在密闭条件下,体系有从有序自发地转变为无序的倾 向。与有序体系相比,无序体系“更加稳定”,可以采取 更多地存在方式。在与外界隔离的体系中,自发过程将导 致体系的熵增大,即熵变(符号△S) 大于零,这个原理 叫做熵增原理。
在用来判断过程的方向时,就称为熵判据。 即混乱度趋于增加△S>0, 有自发进行倾向。
任务二化学反应方向的熵判据
思考交流
1.同一物质固、液、气态,哪状态的熵最大
2.体系熵变与生成气体量有何关系
1.同一物质:
S(g)>S(1)>S(s)
2.化学反应中,固态物质或 液态物质生成气态物质,体 系的混乱度增大;从较少的 气态物质生成较多的气态物 质,体系的混乱度也增大
燕 发
熵的大小规律
(1)与物质的存在状态有关:对于同一种物质,等物质的 量的该物质其熵值(混乱度)大小与物质的存在状态有关。由 于气态分子比液态的分子中的间隔要大,而液态分子比固态分 子的间隔要大,所以,S(g)>S(1)>S(s),
即气态>液态>固态。
(2)与物质的量有关:物质的量越大,分子数越多,熵值 越大。
(3)不同物质熵值间的关系:物质的组成越复杂,其熵值 越大,一般组成物质的原子种类相同时, 一个分子中的原子数 目越多,其混乱度越大,熵值也越大。
思考交流
请说说下列吸热反应能够自发进行的原因。
①2N205 (g)=4NO2(g)+02(g)△H=+56.7kJ/mol △S>0
②(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)
△H=+74.9kJ/mol △S>0
熵判据:
熵增加(△S>0), 体系混乱度增加,具有自发 进行的倾向。
有些熵值减小的反应,在一定条件
下也能自发进行。例如:乙烯聚合为聚乙烯 的反应,就是熵减的过程,即△S<0, 再如: 2NO(g)+2C0(g)=N2(g)+2C02(g)
4Fe(OH)2(s)+02(g)+2H20(1)=4Fe(OH)3(s)
熵减的反应一定不能自发进行吗
思考交流
吉布斯确立了定量描述焓变和熵变在 判断反应的自发性过程中的地位。吉布斯 自由能的出现,完美地从定量角度揭示了 变化过程中焓变与熵变之间的协调与抗衡。
体系自由能变化(符号为△G, 单位为 kJ/mol) 综合考虑了焓变和熵变对体系的 影响,用来定量评价焓变和熵变在反应过 程中作用的关系称之为吉布斯公式:
△G=△H-T△S,G 为吉布斯自由能。
吉布斯
自发反应的方向与焓变和熵变有关,但焓变和熵变又都不能
单独作为判断反应自发进行方向的依据。要判断反应自发进行的 方向,必须综合考虑体系的焓变和熵变。
任务三化学反应方向的复合判据
利用吉布斯自由能的大小,可以判断反应的自发性:
△G=△H-T△<0, 反应能自发进行;
△G=△H-T△S>0,反应不能自发进行;
△G=△H-T△S=0,反应达到平衡状态。
也可以这样描述:
当△H<0,△S>0, 反应自发进行;
当△H>0,△S<0, 反应不自发进行;
当△H>0,△S>0 或△H<0,△S<0 反应是否自发与温度 有关,一般低温时焓变影响为主,高温时,熵变为主,而 温度影响的大小要视△H、△S的具体数值而定。
高温下反应
能自发进行
△H>0 △H
△S<0
所有温度下反应 都不能自发进行
深入认识
△H<0 △SA
△S>0
△H<0
△S<0
低温下反应 能自发进行
所有温度下反应 都能自发进行
△H>0 △S>0
0
活学活用
早在1791年,人们就在金红石的矿物中发现了钛元素(该矿物的主要成分 是TiO2,含量95%)。然而,直到1910年,人们第一次才得以制得纯净的钛。
科学家设计的第一步反应:
TiO2(s)+2Cl2(g)=TiCl4(1)+02(g)
△H=+161.9KJ/mol,△S=-38.4J/(mol·K) 不能自发反应。
另一个方案:科学家们为了解决这一难题,想出来另外一个方案:向二氧 化钛与氯气的反应体系中加入石墨,
TiO2(s)+2Cl2(g)+2C(石墨)=TiCl4(1)+2CO(g) △H=-59.1kJ·mol-1,
△S=141.0J mol-1 K-1。
随堂练习
1、下列说法不正确的是( C )
A. 焓变是一个与反应能否自发进行有关的因素,多数能 自发进行的反应都是放热反应。
B. 在同一条件下不同物质有不同的熵值,其体系的混 乱程度越大,熵值越大。
C. 一个反应能否自发进行取决于该反应放热还是吸热
D. 一个反应能否自发进行,与焓变和熵变的共同影响 有关
注意事项:
(1)很多情况下,简单地只用其中一个判据判断同一个反应,可 能会出现相反的判断结果,所以应两个判据兼顾。由能量判据 (以焓变为基础)和熵判据组合成的复合判据(吉布斯自由能变
△G)将更适合于所有的过程。
(2)过程的自发性只能用于判断过程的方向,不能确定过程是否 一定会发生和过程发生的速率。
例如:涂有防锈漆和未涂防锈漆的钢制器件,其发生腐蚀过程的 自发性是相同的,但只有后者可以实现;又如装在不同地方的 气体等例子。
(3)在讨论过程的方向时,指的是没有外界干扰时体系的 性质。如果允许外界对体系施加某种作用,就可能出现相 反的结果。
如:
水泵可以把水从低水位升至高水位;用高温可使石 灰石分解;高温高压石墨转化为金刚石的例子,实现后 者的先决条件是要向体系中输入能量,该过程的本质仍 然是非自发性的。
随堂练习
2、以下自发反应可用能量判据来解释的是( D ) A、硝酸铵自发地溶于水
B、2N205(g)===4NO2(g)+02(g);△H=+56.7kJ/mol
C 、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g);△H=+74.9 kJ/mol D 、2H2(g)+02(g)=2H2O(1)△H=-571.6 kJ/mol
3、下列反应中,熵减小的是(D )
A.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)
B.2N205(g)=4NO2(g)+02(g)
C.MgCO3(s)=MgO(s)+CO2(g)
D.2CO(g)=2C(s)+02(g)
第二章化学反应速率与化学平衡
第三节 化学反应的方向
课程目标
1、知道化学反应是有方向的。
2、知道化学反应的方向与反应的焓变 和熵变有关。
3、能判断熵的变化(熵增或熵减)
4 、能判断简单反应能否自发进行。
排水:借助水泵, 持续消耗电能
低处
飞流直下:
不借助外力 高处
自发
非自发
初步认识
自发过程:
一定的条件下,不需要其它外力作用就能自动进行 的反应称为自发过程。
举例生活中的自发过程
冰融化
墨水扩散
自发反应:
在给定条件下,可以自发进行到显著程度的化学 反应称为自发反应。
初步认识
深入认识
·在一定条件下,如果一个过程是自发的,那么它的
逆过程通常是非自发的。
非自发过程:
必须外界持续做功,否则,过程就会停止,这样的过 程叫做“非自发过程”。
氢气 水的
的燃 电解
烧
深入认识
●“自发”只是有发生的趋势,并不代表实际发生,更不
能确定发生的速率。“非自发“也不代表不能发生。
处于高水位的水有 向低处流动的趋势 但是现在被大坝拦 截,此过程并没有 实际发生,但是有 发生的趋势。
深入认识
· “自发”是一定条件下的自发,条件变了,可能由原来
的“自发”变成“非自发”。
春天冰融水自发
冬天水结冰自发
思考交流
你们认为什么类型的化学反应更 容易发生呢
任务 一 化学反应方向的焓判据
分析下列反应进行的方向与△H之间的关系:
①2Na(s)+2H2O(1)====2NaOH(aq)+H2(g),该反应是放_ _ 热 反应,△H≤_0,常温下能自发进行。
②4Fe(OH)2(s)+2H2O(1)+02(g)====4Fe(OH)3(s),在常温 下能自发进行,该反应的△H__0。
行的倾向。19世纪,化学家就认为反应热是决定化学 反应是否自发进行的因素,即△H<0 的放热反应都可 以自发进行,而△H>0 的吸热反应则不能自发进行, 提出用焓变来判断反应进行的方向,这就是所谓的焓 判据。
能量趋于降低,△H<0,有自发进行倾向。
任务一化学反应方向的焓判据
放热反应过程中体系能量降低,因此具有自发进
思考交流
只有放热反应才能自发进行吗
氢氧化钡晶体和氯化铵晶体反应吸收热量
局限性
科学家由此提出用焓变来判断反应进行的方向。
多数能自发进行的化学反应是放热反应,但有些吸热反应
归纳小结
放热反应过程中体系能量降低,因此具有自发进行的倾向,
也能自发进行,因此,反应的焓变是与反应进行方向有关的因素
之一,但不是决定反应能否自发进行的唯一因素。
①放在同一密闭容器中的不同种气态物质(包括液态 物质或能够挥发的固态物质的蒸汽),不需要外界的任何 作用,气态物质会通过分子的扩散自发地形成均匀混合物。
②相互接触的固体物质体系,长期放置后,通过扩散 发现进入到另一种固体中的分子或原子。
③硝酸铵溶于水要吸热,它却能够自发地向水中扩散。
④有序排列的火柴散落时成为无序排列——有趋于最 大混乱度的倾向。
其他自发过程
空气
玻璃板— 二氧化氮
任务二化学反应方向的熵判据
德国科学家克劳修斯(R.Clausius) 最早 提出了另一个推动体系变化的因素,并称 之 为 “ 熵 ”(符号S) 的概念,用熵表示体 系混乱度,S=Q/T。
玻尔兹曼通过数学模型的建立得出微观状态数与熵有 数学关系,具体解释了熵的物理意义: S=k log W,
建立了熵与概率的关系,被誉为最美的三个公式之一。 其他两个公式分别为牛顿运动定律F =ma,爱因斯坦质 能关系E=mc2。
熵 (S): 是用来量度混乱(或无序)的程度。
在密闭条件下,体系有从有序自发地转变为无序的倾 向。与有序体系相比,无序体系“更加稳定”,可以采取 更多地存在方式。在与外界隔离的体系中,自发过程将导 致体系的熵增大,即熵变(符号△S) 大于零,这个原理 叫做熵增原理。
在用来判断过程的方向时,就称为熵判据。 即混乱度趋于增加△S>0, 有自发进行倾向。
任务二化学反应方向的熵判据
思考交流
1.同一物质固、液、气态,哪状态的熵最大
2.体系熵变与生成气体量有何关系
1.同一物质:
S(g)>S(1)>S(s)
2.化学反应中,固态物质或 液态物质生成气态物质,体 系的混乱度增大;从较少的 气态物质生成较多的气态物 质,体系的混乱度也增大
燕 发
熵的大小规律
(1)与物质的存在状态有关:对于同一种物质,等物质的 量的该物质其熵值(混乱度)大小与物质的存在状态有关。由 于气态分子比液态的分子中的间隔要大,而液态分子比固态分 子的间隔要大,所以,S(g)>S(1)>S(s),
即气态>液态>固态。
(2)与物质的量有关:物质的量越大,分子数越多,熵值 越大。
(3)不同物质熵值间的关系:物质的组成越复杂,其熵值 越大,一般组成物质的原子种类相同时, 一个分子中的原子数 目越多,其混乱度越大,熵值也越大。
思考交流
请说说下列吸热反应能够自发进行的原因。
①2N205 (g)=4NO2(g)+02(g)△H=+56.7kJ/mol △S>0
②(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)
△H=+74.9kJ/mol △S>0
熵判据:
熵增加(△S>0), 体系混乱度增加,具有自发 进行的倾向。
有些熵值减小的反应,在一定条件
下也能自发进行。例如:乙烯聚合为聚乙烯 的反应,就是熵减的过程,即△S<0, 再如: 2NO(g)+2C0(g)=N2(g)+2C02(g)
4Fe(OH)2(s)+02(g)+2H20(1)=4Fe(OH)3(s)
熵减的反应一定不能自发进行吗
思考交流
吉布斯确立了定量描述焓变和熵变在 判断反应的自发性过程中的地位。吉布斯 自由能的出现,完美地从定量角度揭示了 变化过程中焓变与熵变之间的协调与抗衡。
体系自由能变化(符号为△G, 单位为 kJ/mol) 综合考虑了焓变和熵变对体系的 影响,用来定量评价焓变和熵变在反应过 程中作用的关系称之为吉布斯公式:
△G=△H-T△S,G 为吉布斯自由能。
吉布斯
自发反应的方向与焓变和熵变有关,但焓变和熵变又都不能
单独作为判断反应自发进行方向的依据。要判断反应自发进行的 方向,必须综合考虑体系的焓变和熵变。
任务三化学反应方向的复合判据
利用吉布斯自由能的大小,可以判断反应的自发性:
△G=△H-T△<0, 反应能自发进行;
△G=△H-T△S>0,反应不能自发进行;
△G=△H-T△S=0,反应达到平衡状态。
也可以这样描述:
当△H<0,△S>0, 反应自发进行;
当△H>0,△S<0, 反应不自发进行;
当△H>0,△S>0 或△H<0,△S<0 反应是否自发与温度 有关,一般低温时焓变影响为主,高温时,熵变为主,而 温度影响的大小要视△H、△S的具体数值而定。
高温下反应
能自发进行
△H>0 △H
△S<0
所有温度下反应 都不能自发进行
深入认识
△H<0 △SA
△S>0
△H<0
△S<0
低温下反应 能自发进行
所有温度下反应 都能自发进行
△H>0 △S>0
0
活学活用
早在1791年,人们就在金红石的矿物中发现了钛元素(该矿物的主要成分 是TiO2,含量95%)。然而,直到1910年,人们第一次才得以制得纯净的钛。
科学家设计的第一步反应:
TiO2(s)+2Cl2(g)=TiCl4(1)+02(g)
△H=+161.9KJ/mol,△S=-38.4J/(mol·K) 不能自发反应。
另一个方案:科学家们为了解决这一难题,想出来另外一个方案:向二氧 化钛与氯气的反应体系中加入石墨,
TiO2(s)+2Cl2(g)+2C(石墨)=TiCl4(1)+2CO(g) △H=-59.1kJ·mol-1,
△S=141.0J mol-1 K-1。
随堂练习
1、下列说法不正确的是( C )
A. 焓变是一个与反应能否自发进行有关的因素,多数能 自发进行的反应都是放热反应。
B. 在同一条件下不同物质有不同的熵值,其体系的混 乱程度越大,熵值越大。
C. 一个反应能否自发进行取决于该反应放热还是吸热
D. 一个反应能否自发进行,与焓变和熵变的共同影响 有关
注意事项:
(1)很多情况下,简单地只用其中一个判据判断同一个反应,可 能会出现相反的判断结果,所以应两个判据兼顾。由能量判据 (以焓变为基础)和熵判据组合成的复合判据(吉布斯自由能变
△G)将更适合于所有的过程。
(2)过程的自发性只能用于判断过程的方向,不能确定过程是否 一定会发生和过程发生的速率。
例如:涂有防锈漆和未涂防锈漆的钢制器件,其发生腐蚀过程的 自发性是相同的,但只有后者可以实现;又如装在不同地方的 气体等例子。
(3)在讨论过程的方向时,指的是没有外界干扰时体系的 性质。如果允许外界对体系施加某种作用,就可能出现相 反的结果。
如:
水泵可以把水从低水位升至高水位;用高温可使石 灰石分解;高温高压石墨转化为金刚石的例子,实现后 者的先决条件是要向体系中输入能量,该过程的本质仍 然是非自发性的。
随堂练习
2、以下自发反应可用能量判据来解释的是( D ) A、硝酸铵自发地溶于水
B、2N205(g)===4NO2(g)+02(g);△H=+56.7kJ/mol
C 、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g);△H=+74.9 kJ/mol D 、2H2(g)+02(g)=2H2O(1)△H=-571.6 kJ/mol
3、下列反应中,熵减小的是(D )
A.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)
B.2N205(g)=4NO2(g)+02(g)
C.MgCO3(s)=MgO(s)+CO2(g)
D.2CO(g)=2C(s)+02(g)
