2025年高考化学一轮复习专题突破卷06化学键分子结构与性质晶体结构与性质(新高考专用)(含解析)
文档属性
| 名称 | 2025年高考化学一轮复习专题突破卷06化学键分子结构与性质晶体结构与性质(新高考专用)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 632.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-26 13:10:59 | ||
图片预览




文档简介
专题突破卷06 物质结构与性质 元素周期律(二)
——化学键 分子结构与性质 晶体结构与性质
(考试时间:75分钟 试卷满分:100分)
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一项是符合题目要求的)
1.玻璃是常见的非晶体,在生产、生活中有着广泛的应用,有关玻璃的说法错误的是
A.玻璃内部微粒排列是长程无序和短程有序的
B.玻璃熔化时吸热,温度不断上升
C.水晶和玻璃都是非晶体
D.利用X射线衍射实验可以鉴别玻璃和水晶
2.维生素C的结构简式是,它能防治坏血病,该分子中有几个手性碳原子( )
A.1 B.2 C.3 D.4
(2024·河北石家庄检测)
3.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应为HCHO+O2CO2+H2O。下列有关说法正确的是
A.CO2只含有非极性共价键
B.0.5molHCHO含有1molσ键
C.HCHO、CO2分子中只含有σ键
D.H2O中含有极性共价键
4.已知几种共价键的键能如下:
化学键 H—N N≡N Cl—Cl H—Cl
键能/kJ·mol-1 390.8 946 242.7 431.8
下列说法错误的是
A.键能:N≡N>N=N>N-N
B.H(g)+Cl(g)=HCl(g) ΔH=-431.8 kJ·mol-1
C.H—N键能小于H—Cl键能,所以NH3的沸点高于HCl
D.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=-463.9 kJ·mol-1
5.关于σ键和π键的形成过程,说法不正确的是
A.分子中的σ键为两个s轨道“头碰头”重叠形成
B.分子中的π键为键,π键不能绕键轴旋转
C.中的碳原子为杂化,4个杂化轨道分别与氢原子s轨道形成σ键
D.乙烯()中的碳碳之间形成了1个σ键和1个π键
(2024·广东清远期中)
6.下列有关共价键和键参数的说法不正确的是
A.1个乙烯()分子中含有5个键和1个键
B.C—H键比Si—H键的键长更短,故比更稳定
C.BF3、、三种分子的键角依次增大
D.N与3个H结合形成分子,体现了共价键的饱和性
7.的分子结构与相似,如下图所示。下列有关说法错误的是
A.是极性分子
B.分子中所有原子均满足8电子稳定结构
C.分子中既含有极性键又含有非极性键
D.的相对分子质量比大,熔、沸点高
[2023·湖南长沙期中]
8.表中关于各微粒的描述完全正确的一项是
选项 A B C D
分子或离子的化学式 H2F+ PCl3 NO BH
中心原子的杂化轨道类型 sp sp3 sp2 sp3
VSEPR模型名称 直线形 平面三角形 平面三角形 正四面体形
分子或离子的空间结构 直线形 平面三角形 V形 三角锥形
A.A B.B C.C D.D
9.下列事实与氢键无关的是
A.相同压强下的沸点高于的沸点
B.一定条件下,与可以形成
C.羊毛制品水洗再晒干后变形
D.和的结构和极性并不相似,但两者能完全互溶
10.二茂铁分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是
A.二茂铁中与环戊二烯离子之间为离子键
B.1mol环戊二烯中含有键的数目为
C.分子中存在键
D.的电子排布式为
11.关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是
A.CH3OH为极性分子 B.N2H4空间结构为平面形
C.N2H4的沸点高于(CH3)2NNH2 D.CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同
(2024·山东聊城三模)
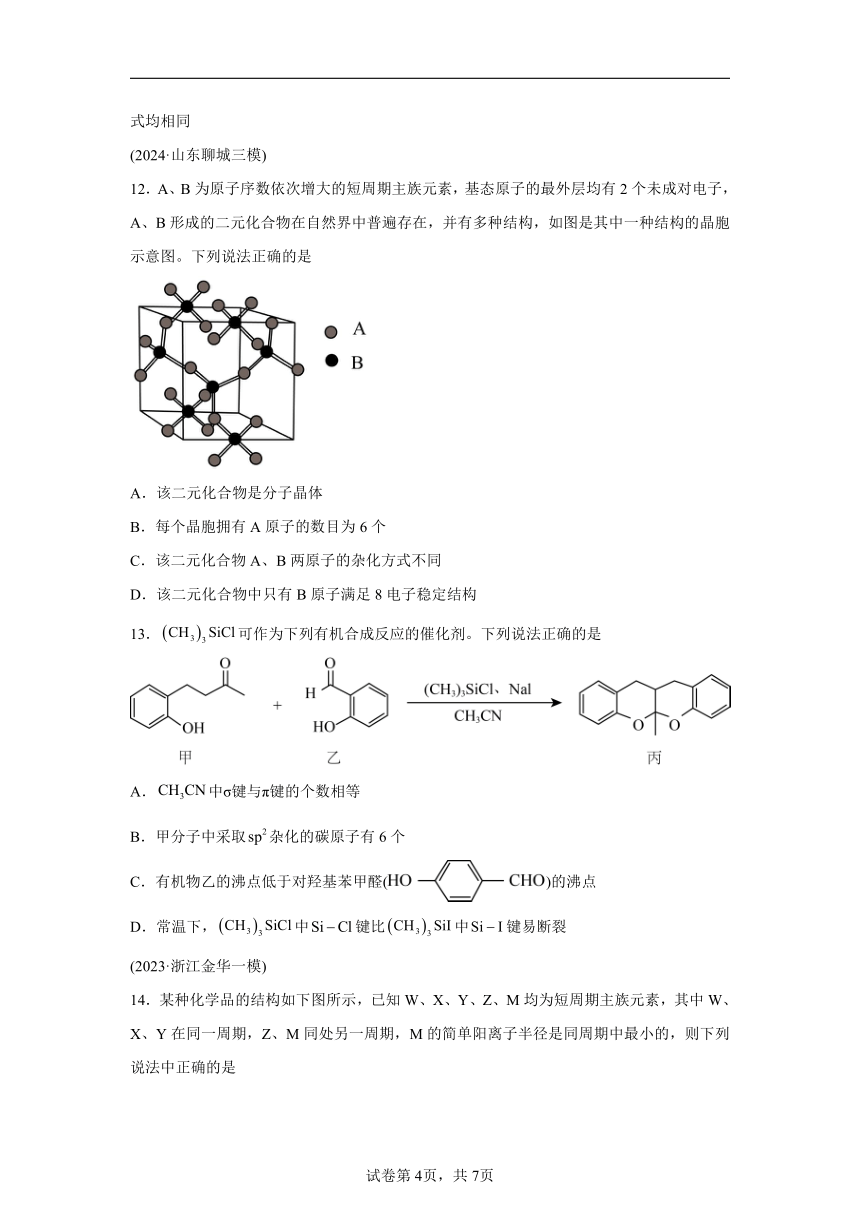
12.A、B为原子序数依次增大的短周期主族元素,基态原子的最外层均有2个未成对电子,A、B形成的二元化合物在自然界中普遍存在,并有多种结构,如图是其中一种结构的晶胞示意图。下列说法正确的是
A.该二元化合物是分子晶体
B.每个晶胞拥有A原子的数目为6个
C.该二元化合物A、B两原子的杂化方式不同
D.该二元化合物中只有B原子满足8电子稳定结构
13.可作为下列有机合成反应的催化剂。下列说法正确的是
A.中σ键与π键的个数相等
B.甲分子中采取杂化的碳原子有6个
C.有机物乙的沸点低于对羟基苯甲醛()的沸点
D.常温下,中键比中键易断裂
(2023·浙江金华一模)
14.某种化学品的结构如下图所示,已知W、X、Y、Z、M均为短周期主族元素,其中W、X、Y在同一周期,Z、M同处另一周期,M的简单阳离子半径是同周期中最小的,则下列说法中正确的是
A.元素电负性大小的顺序:X>W>Y>Z
B.W的某种单质的分子,是极性分子且分子中含有极性键
C.同一周期中,元素第一电离能处在Z和M之间的有2种
D.该分子中Y原子的杂化方式为sp2
15.氮化铬的晶胞结构如图所示,点分数坐标为。氮化铬的晶体密度为,摩尔质量为,晶胞参数为,代表阿伏加德罗常数的值。下列说法正确的是
A.铬原子的价电子排布图为: B.点的分数坐标为
C.距离原子最近的原子有8个 D.
二、非选择题(本题包括4小题,共55分)
(2024·河南部分重点中学联考)
16.填空
(1)Ni(CO)4中CO称为配体,其配位原子是碳原子而不是氧原子,理由是 。
(2)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)]Br,下列说法正确的是_____(填字母标号)。
A.CH3CN与Mn原子配位时,提供孤电子对的是C原子
B.Mn原子的配位数为6
C.CH3CN中C原子的杂化类型为sp2、sp3
D.CH3CN中σ键与π键数目之比为5∶2
(3)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存在 。
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(4)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,无明显现象。则第一种配合物可表示为 ,第二种配合物可表示为 。若在第二种配合物的溶液中滴加AgNO3溶液,则产生的现象是 。
17.钙钛矿类杂化材料(CH3NH3)PbI3在太阳能电池领域具有重要的应用价值。(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。
(1)代表I-的为 。
(2)原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),B为,则C的原子分数坐标为 。
(3)已知(CH3NH3)PbI3的摩尔质量为Mg·mol-1,则该晶体的密度为ρ= g·cm-3(设NA为阿伏加德罗常数的值)。
(4)该晶胞沿体对角线方向的投影图为 (填字母)。
18.已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素在周期表中的位置 ,属于 区。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为 (填元素符号),第一电离能最大的原因是 。
(3)D元素与氟元素相比,电负性:D F(填“>”、“=”或“<”),下列表述中能证明这一事实的是 (填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为 ,它的晶体中含有多种化学键,但一定不含有的化学键是 (填选项序号)。
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键 mol。
19.A、B、C、D、E为短周期的五种非金属元素,其中A、B、C的基态原子的价层电子排布式分别为asa、bsbbpb、csccp2c,D与B同主族,E位于C的下一周期,且E是同周期元素中电负性最大的。试回答下列问题:
(1)由A、B、C、D、E五种元素中的两种或三种元素可组成多种物质,分子①BC2、②DE4、③A2C、④BA3E中,属于极性分子的是 (填序号,下同);中心原子采取sp3杂化的是 。
(2)A、B两元素能组成一种分子中原子个数比为1∶1的常见溶剂,其分子式为 ;相同条件下,该物质在BE4中的溶解度 (填“大于”或“小于”)其在A2C中的溶解度。
(3)阴离子DC与EC的VSEPR模型名称分别为 、 ,其VSEPR模型与空间结构不一致的是 (填离子符号)。
(4)BA4、DA4和DE4的沸点由高到低的顺序为 (用化学式表示)。
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.C
【详解】A.根据玻璃是非晶体知,构成玻璃的粒子在空间的排列是长程无序和短程有序的,A正确;
B.玻璃是非晶体,没有固定的熔点,玻璃熔化时吸热,温度不断上升,B正确;
C.水晶的主要成分是二氧化硅,是原子晶体,玻璃是非晶体,C错误;
D.区分晶体与非晶体最科学的方法是对固体进行X射线衍射实验,D正确;
故选C。
2.B
【详解】判断一个碳原子是否是手性碳原子,可从碳原子上连接四个基团都不同角度分析,图中打*号为手性碳原子。。故B正确。
3.D
【详解】A.CO2中只含有极性共价键,故A错误;
B.根据结构式可知,0.5molHCHO含有1.5molσ键,故B错误;
C.HCHO、CO2分子中既含有σ键又含有π键,故C错误;
D.H2O中含有氢氧极性共价键,故D正确;
答案选D。
4.C
【详解】A.三键键长小于双键键长小于单键键长,键长越短,键能越大,所以键能:N≡N>N=N>N-N,故A正确;
B.H(g)+Cl(g)=HCl(g)的焓变为H—Cl键能的相反数,则ΔH=-431.8 kJ·mol-1,故B正确;
C.NH3的沸点高于HCl是由于NH3形成分子间氢键,而HCl不能,与键能无关,故C错误;
D.根据ΔH=反应物总键能-生成物总键能,则2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=6E(N-H)+3E(Cl-Cl)-E(N≡N)-6E(H-Cl)=-463.9 kJ·mol-1,故D正确;
故选C。
5.A
【详解】A. 分子中的σ键由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道“头碰头”重叠形成,故A错误;
B. 分子中p轨道与p轨道通过“肩并肩”重叠形成键,π键为镜面对称,不能绕键轴旋转,故B正确;
C. 中的碳原子为杂化,碳原子的4个杂化轨道分别与氢原子s轨道重叠,形成C-Hσ键,故C正确;
D. 中的碳碳之间形成双键,双键中有1个σ键和1个π键,故D正确;
答案选A。
6.C
【详解】A.C2H4分子中含有4个C-H键和1个C=C键,1个C=C键含有1个σ键和1个π键,即C2H4分子中含有5个σ键和1个π键,故A正确;
B.碳的原子半径小于硅,所以C-H键比Si-H键键长更短,而键长越短共价键强度越大,故CH4比SiH4更稳定,故B正确;
C.BF3中氟原子sp2杂化,为平面正三角形结构,键角为120℃,水分子中氧原子sp3杂化,含两对孤对电子,键角104.7℃,CO2分子中C原子sp杂化,键角为180℃,H2O、BF3、CO2三种分子的键角依次增大,故C错误;
D.氮原子的最外层有5个电子,因此N与3个H结合形成分子满足8电子稳定结构,体现了共价键的饱和性,故D正确;
故选C。
7.D
【详解】A.该分子中,电荷分布是不均匀的,不对称的,所以是极性分子,故A正确;
B.S2Cl2的电子式为 ,分子中各原子均达到8电子稳定结构,故B正确;
C.Cl-S-S-Cl中硫原子和硫原子之间存在非极性键,硫和氯原子之间存在极性键,故C正确;
D.和均属于分子晶体,中存在氢键,的熔沸点高,故D错误;
答案选D。
8.C
【详解】A.离子中氟原子的价层电子对数为,则离子的VSEPR模型为四面体形,离子的空间结构为V形,故A错误;
B.三氯化磷分子中磷原子的价层电子对数为,孤对电子对数为1,则分子的VSEPR模型为四面体形、分子的空间构型为三角锥形,故B错误;
C.亚硝酸根离子中氮原子的价层电子对数为,孤对电子对数为1,则原子的杂化方式为杂化,离子的VSEPR模型为平面三角形、分子的空间构型为V形,故C正确;
D.四氢合硼离子中硼原子的价层电子对数为,孤对电子对数为0,则离子的VSEPR模型和空间构型均为正四面体形,故D错误;
选C。
9.B
【详解】A.虽HF分子间的F-H…F氢键比H2O分子间的O-H…O氢键强,但一个水分子可以形成两个氢键,而知每个氟化氢分子只能形成一个氢键,所以相同压强下H2O的沸点高于HF的沸点,故A不选;
B.NH3 BF3中该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,B、N原子之间形成配位键,B原子含有3个σ 键一个配位键,与氢键无关,故B选;
C.羊毛制品含有电负性很大的氮原子,水洗与氢原子形成氢键,水洗再晒干后变形,故C不选;
D.H2O和CH3COCH3的结构和极性并不相似,但CH3COCH3能与水分子之间形成氢键,所以两者能完全互溶,故D不选。
答案选B。
10.C
【详解】含有孤电子对和空轨道的原子之间存在配位键,所以二茂铁中与环戊二烯离子之间为配位键,故A错误;
B.一个环戊二烯分子中含有键的数目为13,则1mol环戊二烯中含有键的数目为,故B错误;
C.碳碳双键之间存在键,所以该分子中存在键,故C正确;
D.铁原子核外有26个电子,铁原子失去最外层两个电子变为亚铁离子,根据构造原理知,亚铁离子核外电子排布式为,故D错误;
故选:C。
11.B
【详解】A.甲醇可看成是甲烷中的一个氢原子被羟基取代得到的,为四面体结构,是由极性键组成的极性分子,A正确;
B.N2H4中N原子的杂化方式为sp3,不是平面形,B错误;
C.N2H4分子中连接N原子的H原子数多,存在氢键的数目多,而偏二甲肼((CH3)2NNH2)只有一端可以形成氢键,另一端的两个甲基基团比较大,影响了分子的排列,沸点较N2H4的低,C正确;
D.CH3OH为四面体结构,-OH结构类似于水的结构,(CH3)2NNH2的结构简式为 ,两者分子中C、O、N杂化方式均为sp3,D正确;
故选B。
12.B
【分析】周期表中基态原子的最外层均有2个未成对电子的元素在第IVA族和第VIA族,短周期中符合此条件的有碳、硅、氧、硫四种元素,由图中看出,一个A周围有2个B,一个B原子周围有四个A,AB原子个数比应该是2:1,可以形成CO2,CS2,SiO2等物质,又知A、B原子序数依次增大,只有A是O元素,B是Si元素符合,形成的化合物是SiO2。
【详解】A.SiO2是共价晶体,故A错误;
B.由图可知晶胞中B原子(即Si原子)所在位置有4个在棱上,2个在面上,1个在晶胞内该晶胞中含有Si原子个数为 +2 +1=3,按照Si与O原子1:2,所以含有6个氧原子,故B正确;
C.SiO2中Si原子和O原子都是sp3杂化,杂化方式相同,故C错误;
D.硅最外层四个电子,一个硅与周围4个氧原子形成共价键,O原子最外层有6个电子,与2个硅形成共价键,因此Si原子和O原子都满足8电子稳定结构,故D错误;
答案选B。
【点睛】基态原子的最外层均有2个未成对电子是本题解题的关键。
13.C
【详解】A. CH3CN分子中单键为σ键,三键中含有1个σ键和2个π键,则由结构简式可知,CH3CN分子中含有5个,π键为2个,σ键与π键的个数不相等,故A错误;
B.由结构简式可知,甲分子中苯环中的碳原子和羰基中碳原子的杂化方式为sp2杂化,共有7个,故B错误;
C.邻羟基苯甲酸形成分子内氢键,对羟基苯甲酸形成分子间氢键,所以邻羟基苯甲酸的分子间作用力小于对羟基苯甲酸,沸点低于对羟基苯甲酸,故C正确;
D.氯元素的电负性大于碘元素,所以中键比中键难断裂,故D错误;
故选C。
14.BC
【分析】W、X、Y、Z、M均为短周期主族元素,其中W、X、Y在同一周期,Z、M同处另一周期,M的简单阳离子半径是同周期中最小的,可知M为Al元素,化合物中Z形成6个共价键,Z为S元素;X形成1个共价键、Y形成4个共价键、W形成2个共价键,则X为F元素、Y为C元素、W为O元素,以此来解答。
【详解】由上述分析可知,W为O元素、X为F元素、Y为C元素、Z为S元素、M为Al元素,
A.同周期,从左到右,元素的电负性逐渐增大,同主族从上到下,元素的电负性逐渐变小,则电负性F>O>S>C,故A错误;
B.O3的空间结构为V形,分子中正电荷中心和负电荷中心不重合,O3是极性分子,分子中含有极性键,故B正确;
C.同一周期中,随着核电荷数的增加,元素的第一电离呈现增大趋势,ⅡA族、ⅤA族反常,则元素第一电离能处在Al和S之间的有Si、Mg共2种,故C正确;
D.Y为C原子,价层电子对数是4,杂化方式为sp3,故D错误;
故选:BC。
15.D
【详解】
A.Cr原子的价层电子排布式为3d54s1,其价电子排布图为 ,A错误;
B.A点分数坐标为(0,0,0),根据坐标系,B点位于棱心上,则B点分数坐标为(,1,1),B错误;
C.以位于体心的Cr原子为例,距离原子最近的原子位于棱心,共有12个,C错误;
D.该晶胞中,位于顶点和面心的N原子个数为,位于体心和棱心的Cr原子个数为,则,解得nm,D正确;
故选D。
16.(1)C的电负性小于O,供电子能力强于O
(2)BD
(3)ACD
(4) [CoBr(NH3)5]SO4 [Co(SO4)(NH3)5]Br 生成淡黄色沉淀
【详解】(1)碳原子和氧原子都有孤电子对,但是O的电负性大于C,不易提供电子形成配位键,所以CO配位原子是碳原子而不是氧原子;
(2)A.CH3CN中N有孤电子对,C没有孤电子对,因此CH3CN与Mn原子配位时,提供孤电子对的是N原子,A错误;
B.该配合物中配体为5个CO和1个CH3CN,故Mn原子的配位数为6,B正确;
C.CH3CN中的甲基C为sp3杂化,—CN中的C为sp杂化,C错误;
D.CH3CN中单键全是σ键,三键中含一个σ键、两个π键,故CH3CN中σ键与π键数目之比为5∶2,D正确;
故选BD。
(3)[Al(OH)4]-中OH-和Al3+之间存在配位键,属于共价键,H、O之间形成共价键,也是极性键、σ键,故选ACD。
(4)由题意知,在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,配合物中外界离子能电离出来,而内界离子不能电离出来,说明在外界;在第二种配合物的溶液中加BaCl2溶液时,无明显现象,说明在内界,则第一种配合物可表示为[CoBr(NH3)5]SO4,第二种配合物可表示为[Co(SO4)(NH3)5]Br,第二种配合物中Br-在外界,若向其溶液中滴加AgNO3溶液,会生成淡黄色沉淀。
17.(1)C
(2)
(3)
(4)a
【详解】(1)B代表Pb2+;晶胞中A原子位于顶角,一个晶胞中A原子数目为8×=1,C原子位于晶胞面心,一个晶胞中C原子数目为6×=3,结合化学式(CH3NH3)PbI3可知,代表I-的为C,故答案为:C;
(2)原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),B为,与图可知,C原子为右侧面心,则C的原子分数坐标为,故答案为:;
(3)(CH3NH3)PbI3的摩尔质量为Mg·mol-1,晶胞质量为g;晶胞边长为apm,则晶胞体积为(apm)3=a3×10-30cm3,所以密度为g·cm-3,故答案为:;
(4)该晶胞沿体对角线方向的投影,体对角线方向的2个顶角A原子和体心B原子投到1个点,另外6个顶角A原子在平面上投出1个六边形,面心6个C原子在A投出六边形内部组成1个小六边形,故选a。
18. 第四周期第IB族 d C<O<N 氮的2p3为半满结构,较稳定 < BC BD 5
【分析】根据A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B为C元素;D原子L层上有2对成对电子,则D为C(舍去)或O元素;B、C、D的原子序数依次增大,则C为N元素;E+原子核外有3层电子且M层3d轨道电子全充满,则E为Cu元素,结合元素周期律分析解答。
【详解】(1)E为Cu元素,Cu在周期表中位于第4周期第IB族,属于d区;故答案为:第四周期第IB族;d;
(2)B、C、D三种元素分别是C、N、O元素,N的最外层为半充满结构,第一电离能最大,C的最小,第一电离能数值由小到大的顺序为C<O<N,故答案为:C<O<N;氮的2p3为半满结构,较稳定;
(3)D为O元素,电负性小于F;A.常温下氟气的颜色比D单质的颜色深属于物理性质,而电负性是化学性质,故A不选;B.氟气与D的氢化物剧烈反应,产生D的单质,说明氟气的氧化性比氧气强,说明氟的电负性大于氧,故B选;C.氟与D形成的化合物中D元素呈正价态,说明F得电子能力较强,电负性较大,故C选;D.单质与氢气化合时得电子的数目的多少与得电子的能力无关,故D不选;故答案为:<;BC;
(4)只含N、H两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,则其电子式为,含有离子键,铵根离子中含有极性键和配位键,不含非极性键和金属键,故答案为:;BD;
(5)C2H4为乙烯,1个C2H4分子中含有5个σ键,1个π键,因此1molC2H4分子中5molσ键,故答案为:5。
19.(1) ③④ ②③④
(2) C6H6 大于
(3) 平面三角形 四面体形 ClO
(4)SiCl4>SiH4>CH4
【分析】由A、B、C、D、E为短周期的非金属元素及s轨道最多可容纳2个电子,以及E所处的位置可知A的价层电子排布为,即A为H,B的价层电子排布为,则B为C,C的价层电子排布为,则C为O;由D与B同主族可知,D为Si;由E位于C的下一周期,且E是同周期元素中电负性最大的可知,E为Cl,据此解答。
【详解】(1)①、②、③、④分别为CO2、SiCl4、H2O、CH3Cl,其中H2O有两对孤对电子,CH3Cl中氯原子极性比H原子大,正负电荷中心不重合,为极性分子,其他均为非极性分子;CO2中C原子上的价层电子对数为,则CO2分子中C原子采取sp杂化,SiCl4中Si原子上的价层电子对数为,则SiCl4分子中Si原子采取sp3杂化,H2O分子中O原子上的价层电子对数为,故H2O中O原子采取sp3杂化,CH3Cl中C原子上的价层电子对数为,则CH3Cl中C原子采取sp3杂化,故答案为:③④;②③④;
(2)该溶剂为苯(C6H6),CCl4为非极性分子、水是极性分子,苯易溶于非极性溶剂CCl4中,相同条件下,该物质在CCl4中的溶解度大于其在H2O中的溶解度,故答案为:C6H6;大于;
(3)中Si原子的价层电子对数为,VSEPR模型名称为平面三角形,中Cl原子的价层电子对数为,VSEPR模型名称为四面体形;中Si原子上无孤电子对,中Cl原子上有孤电子对,则的VSEPR模型与空间结构不一致,故答案为:平面三角形;四面体形;;
(4)BA4、DA4、DE4分别为CH4、SiH4、SiCl4,三者都是由分子构成的物质,其结构相似,相对分子质量越大,范德华力越大,熔沸点越高,故它们的沸点由高到低的顺序为SiCl4>SiH4>CH4,故答案为:SiCl4>SiH4>CH4。
答案第1页,共2页
答案第1页,共2页
——化学键 分子结构与性质 晶体结构与性质
(考试时间:75分钟 试卷满分:100分)
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一项是符合题目要求的)
1.玻璃是常见的非晶体,在生产、生活中有着广泛的应用,有关玻璃的说法错误的是
A.玻璃内部微粒排列是长程无序和短程有序的
B.玻璃熔化时吸热,温度不断上升
C.水晶和玻璃都是非晶体
D.利用X射线衍射实验可以鉴别玻璃和水晶
2.维生素C的结构简式是,它能防治坏血病,该分子中有几个手性碳原子( )
A.1 B.2 C.3 D.4
(2024·河北石家庄检测)
3.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应为HCHO+O2CO2+H2O。下列有关说法正确的是
A.CO2只含有非极性共价键
B.0.5molHCHO含有1molσ键
C.HCHO、CO2分子中只含有σ键
D.H2O中含有极性共价键
4.已知几种共价键的键能如下:
化学键 H—N N≡N Cl—Cl H—Cl
键能/kJ·mol-1 390.8 946 242.7 431.8
下列说法错误的是
A.键能:N≡N>N=N>N-N
B.H(g)+Cl(g)=HCl(g) ΔH=-431.8 kJ·mol-1
C.H—N键能小于H—Cl键能,所以NH3的沸点高于HCl
D.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=-463.9 kJ·mol-1
5.关于σ键和π键的形成过程,说法不正确的是
A.分子中的σ键为两个s轨道“头碰头”重叠形成
B.分子中的π键为键,π键不能绕键轴旋转
C.中的碳原子为杂化,4个杂化轨道分别与氢原子s轨道形成σ键
D.乙烯()中的碳碳之间形成了1个σ键和1个π键
(2024·广东清远期中)
6.下列有关共价键和键参数的说法不正确的是
A.1个乙烯()分子中含有5个键和1个键
B.C—H键比Si—H键的键长更短,故比更稳定
C.BF3、、三种分子的键角依次增大
D.N与3个H结合形成分子,体现了共价键的饱和性
7.的分子结构与相似,如下图所示。下列有关说法错误的是
A.是极性分子
B.分子中所有原子均满足8电子稳定结构
C.分子中既含有极性键又含有非极性键
D.的相对分子质量比大,熔、沸点高
[2023·湖南长沙期中]
8.表中关于各微粒的描述完全正确的一项是
选项 A B C D
分子或离子的化学式 H2F+ PCl3 NO BH
中心原子的杂化轨道类型 sp sp3 sp2 sp3
VSEPR模型名称 直线形 平面三角形 平面三角形 正四面体形
分子或离子的空间结构 直线形 平面三角形 V形 三角锥形
A.A B.B C.C D.D
9.下列事实与氢键无关的是
A.相同压强下的沸点高于的沸点
B.一定条件下,与可以形成
C.羊毛制品水洗再晒干后变形
D.和的结构和极性并不相似,但两者能完全互溶
10.二茂铁分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是
A.二茂铁中与环戊二烯离子之间为离子键
B.1mol环戊二烯中含有键的数目为
C.分子中存在键
D.的电子排布式为
11.关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是
A.CH3OH为极性分子 B.N2H4空间结构为平面形
C.N2H4的沸点高于(CH3)2NNH2 D.CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同
(2024·山东聊城三模)
12.A、B为原子序数依次增大的短周期主族元素,基态原子的最外层均有2个未成对电子,A、B形成的二元化合物在自然界中普遍存在,并有多种结构,如图是其中一种结构的晶胞示意图。下列说法正确的是
A.该二元化合物是分子晶体
B.每个晶胞拥有A原子的数目为6个
C.该二元化合物A、B两原子的杂化方式不同
D.该二元化合物中只有B原子满足8电子稳定结构
13.可作为下列有机合成反应的催化剂。下列说法正确的是
A.中σ键与π键的个数相等
B.甲分子中采取杂化的碳原子有6个
C.有机物乙的沸点低于对羟基苯甲醛()的沸点
D.常温下,中键比中键易断裂
(2023·浙江金华一模)
14.某种化学品的结构如下图所示,已知W、X、Y、Z、M均为短周期主族元素,其中W、X、Y在同一周期,Z、M同处另一周期,M的简单阳离子半径是同周期中最小的,则下列说法中正确的是
A.元素电负性大小的顺序:X>W>Y>Z
B.W的某种单质的分子,是极性分子且分子中含有极性键
C.同一周期中,元素第一电离能处在Z和M之间的有2种
D.该分子中Y原子的杂化方式为sp2
15.氮化铬的晶胞结构如图所示,点分数坐标为。氮化铬的晶体密度为,摩尔质量为,晶胞参数为,代表阿伏加德罗常数的值。下列说法正确的是
A.铬原子的价电子排布图为: B.点的分数坐标为
C.距离原子最近的原子有8个 D.
二、非选择题(本题包括4小题,共55分)
(2024·河南部分重点中学联考)
16.填空
(1)Ni(CO)4中CO称为配体,其配位原子是碳原子而不是氧原子,理由是 。
(2)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)]Br,下列说法正确的是_____(填字母标号)。
A.CH3CN与Mn原子配位时,提供孤电子对的是C原子
B.Mn原子的配位数为6
C.CH3CN中C原子的杂化类型为sp2、sp3
D.CH3CN中σ键与π键数目之比为5∶2
(3)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存在 。
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(4)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,无明显现象。则第一种配合物可表示为 ,第二种配合物可表示为 。若在第二种配合物的溶液中滴加AgNO3溶液,则产生的现象是 。
17.钙钛矿类杂化材料(CH3NH3)PbI3在太阳能电池领域具有重要的应用价值。(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。
(1)代表I-的为 。
(2)原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),B为,则C的原子分数坐标为 。
(3)已知(CH3NH3)PbI3的摩尔质量为Mg·mol-1,则该晶体的密度为ρ= g·cm-3(设NA为阿伏加德罗常数的值)。
(4)该晶胞沿体对角线方向的投影图为 (填字母)。
18.已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素在周期表中的位置 ,属于 区。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为 (填元素符号),第一电离能最大的原因是 。
(3)D元素与氟元素相比,电负性:D F(填“>”、“=”或“<”),下列表述中能证明这一事实的是 (填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为 ,它的晶体中含有多种化学键,但一定不含有的化学键是 (填选项序号)。
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键 mol。
19.A、B、C、D、E为短周期的五种非金属元素,其中A、B、C的基态原子的价层电子排布式分别为asa、bsbbpb、csccp2c,D与B同主族,E位于C的下一周期,且E是同周期元素中电负性最大的。试回答下列问题:
(1)由A、B、C、D、E五种元素中的两种或三种元素可组成多种物质,分子①BC2、②DE4、③A2C、④BA3E中,属于极性分子的是 (填序号,下同);中心原子采取sp3杂化的是 。
(2)A、B两元素能组成一种分子中原子个数比为1∶1的常见溶剂,其分子式为 ;相同条件下,该物质在BE4中的溶解度 (填“大于”或“小于”)其在A2C中的溶解度。
(3)阴离子DC与EC的VSEPR模型名称分别为 、 ,其VSEPR模型与空间结构不一致的是 (填离子符号)。
(4)BA4、DA4和DE4的沸点由高到低的顺序为 (用化学式表示)。
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.C
【详解】A.根据玻璃是非晶体知,构成玻璃的粒子在空间的排列是长程无序和短程有序的,A正确;
B.玻璃是非晶体,没有固定的熔点,玻璃熔化时吸热,温度不断上升,B正确;
C.水晶的主要成分是二氧化硅,是原子晶体,玻璃是非晶体,C错误;
D.区分晶体与非晶体最科学的方法是对固体进行X射线衍射实验,D正确;
故选C。
2.B
【详解】判断一个碳原子是否是手性碳原子,可从碳原子上连接四个基团都不同角度分析,图中打*号为手性碳原子。。故B正确。
3.D
【详解】A.CO2中只含有极性共价键,故A错误;
B.根据结构式可知,0.5molHCHO含有1.5molσ键,故B错误;
C.HCHO、CO2分子中既含有σ键又含有π键,故C错误;
D.H2O中含有氢氧极性共价键,故D正确;
答案选D。
4.C
【详解】A.三键键长小于双键键长小于单键键长,键长越短,键能越大,所以键能:N≡N>N=N>N-N,故A正确;
B.H(g)+Cl(g)=HCl(g)的焓变为H—Cl键能的相反数,则ΔH=-431.8 kJ·mol-1,故B正确;
C.NH3的沸点高于HCl是由于NH3形成分子间氢键,而HCl不能,与键能无关,故C错误;
D.根据ΔH=反应物总键能-生成物总键能,则2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=6E(N-H)+3E(Cl-Cl)-E(N≡N)-6E(H-Cl)=-463.9 kJ·mol-1,故D正确;
故选C。
5.A
【详解】A. 分子中的σ键由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道“头碰头”重叠形成,故A错误;
B. 分子中p轨道与p轨道通过“肩并肩”重叠形成键,π键为镜面对称,不能绕键轴旋转,故B正确;
C. 中的碳原子为杂化,碳原子的4个杂化轨道分别与氢原子s轨道重叠,形成C-Hσ键,故C正确;
D. 中的碳碳之间形成双键,双键中有1个σ键和1个π键,故D正确;
答案选A。
6.C
【详解】A.C2H4分子中含有4个C-H键和1个C=C键,1个C=C键含有1个σ键和1个π键,即C2H4分子中含有5个σ键和1个π键,故A正确;
B.碳的原子半径小于硅,所以C-H键比Si-H键键长更短,而键长越短共价键强度越大,故CH4比SiH4更稳定,故B正确;
C.BF3中氟原子sp2杂化,为平面正三角形结构,键角为120℃,水分子中氧原子sp3杂化,含两对孤对电子,键角104.7℃,CO2分子中C原子sp杂化,键角为180℃,H2O、BF3、CO2三种分子的键角依次增大,故C错误;
D.氮原子的最外层有5个电子,因此N与3个H结合形成分子满足8电子稳定结构,体现了共价键的饱和性,故D正确;
故选C。
7.D
【详解】A.该分子中,电荷分布是不均匀的,不对称的,所以是极性分子,故A正确;
B.S2Cl2的电子式为 ,分子中各原子均达到8电子稳定结构,故B正确;
C.Cl-S-S-Cl中硫原子和硫原子之间存在非极性键,硫和氯原子之间存在极性键,故C正确;
D.和均属于分子晶体,中存在氢键,的熔沸点高,故D错误;
答案选D。
8.C
【详解】A.离子中氟原子的价层电子对数为,则离子的VSEPR模型为四面体形,离子的空间结构为V形,故A错误;
B.三氯化磷分子中磷原子的价层电子对数为,孤对电子对数为1,则分子的VSEPR模型为四面体形、分子的空间构型为三角锥形,故B错误;
C.亚硝酸根离子中氮原子的价层电子对数为,孤对电子对数为1,则原子的杂化方式为杂化,离子的VSEPR模型为平面三角形、分子的空间构型为V形,故C正确;
D.四氢合硼离子中硼原子的价层电子对数为,孤对电子对数为0,则离子的VSEPR模型和空间构型均为正四面体形,故D错误;
选C。
9.B
【详解】A.虽HF分子间的F-H…F氢键比H2O分子间的O-H…O氢键强,但一个水分子可以形成两个氢键,而知每个氟化氢分子只能形成一个氢键,所以相同压强下H2O的沸点高于HF的沸点,故A不选;
B.NH3 BF3中该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,B、N原子之间形成配位键,B原子含有3个σ 键一个配位键,与氢键无关,故B选;
C.羊毛制品含有电负性很大的氮原子,水洗与氢原子形成氢键,水洗再晒干后变形,故C不选;
D.H2O和CH3COCH3的结构和极性并不相似,但CH3COCH3能与水分子之间形成氢键,所以两者能完全互溶,故D不选。
答案选B。
10.C
【详解】含有孤电子对和空轨道的原子之间存在配位键,所以二茂铁中与环戊二烯离子之间为配位键,故A错误;
B.一个环戊二烯分子中含有键的数目为13,则1mol环戊二烯中含有键的数目为,故B错误;
C.碳碳双键之间存在键,所以该分子中存在键,故C正确;
D.铁原子核外有26个电子,铁原子失去最外层两个电子变为亚铁离子,根据构造原理知,亚铁离子核外电子排布式为,故D错误;
故选:C。
11.B
【详解】A.甲醇可看成是甲烷中的一个氢原子被羟基取代得到的,为四面体结构,是由极性键组成的极性分子,A正确;
B.N2H4中N原子的杂化方式为sp3,不是平面形,B错误;
C.N2H4分子中连接N原子的H原子数多,存在氢键的数目多,而偏二甲肼((CH3)2NNH2)只有一端可以形成氢键,另一端的两个甲基基团比较大,影响了分子的排列,沸点较N2H4的低,C正确;
D.CH3OH为四面体结构,-OH结构类似于水的结构,(CH3)2NNH2的结构简式为 ,两者分子中C、O、N杂化方式均为sp3,D正确;
故选B。
12.B
【分析】周期表中基态原子的最外层均有2个未成对电子的元素在第IVA族和第VIA族,短周期中符合此条件的有碳、硅、氧、硫四种元素,由图中看出,一个A周围有2个B,一个B原子周围有四个A,AB原子个数比应该是2:1,可以形成CO2,CS2,SiO2等物质,又知A、B原子序数依次增大,只有A是O元素,B是Si元素符合,形成的化合物是SiO2。
【详解】A.SiO2是共价晶体,故A错误;
B.由图可知晶胞中B原子(即Si原子)所在位置有4个在棱上,2个在面上,1个在晶胞内该晶胞中含有Si原子个数为 +2 +1=3,按照Si与O原子1:2,所以含有6个氧原子,故B正确;
C.SiO2中Si原子和O原子都是sp3杂化,杂化方式相同,故C错误;
D.硅最外层四个电子,一个硅与周围4个氧原子形成共价键,O原子最外层有6个电子,与2个硅形成共价键,因此Si原子和O原子都满足8电子稳定结构,故D错误;
答案选B。
【点睛】基态原子的最外层均有2个未成对电子是本题解题的关键。
13.C
【详解】A. CH3CN分子中单键为σ键,三键中含有1个σ键和2个π键,则由结构简式可知,CH3CN分子中含有5个,π键为2个,σ键与π键的个数不相等,故A错误;
B.由结构简式可知,甲分子中苯环中的碳原子和羰基中碳原子的杂化方式为sp2杂化,共有7个,故B错误;
C.邻羟基苯甲酸形成分子内氢键,对羟基苯甲酸形成分子间氢键,所以邻羟基苯甲酸的分子间作用力小于对羟基苯甲酸,沸点低于对羟基苯甲酸,故C正确;
D.氯元素的电负性大于碘元素,所以中键比中键难断裂,故D错误;
故选C。
14.BC
【分析】W、X、Y、Z、M均为短周期主族元素,其中W、X、Y在同一周期,Z、M同处另一周期,M的简单阳离子半径是同周期中最小的,可知M为Al元素,化合物中Z形成6个共价键,Z为S元素;X形成1个共价键、Y形成4个共价键、W形成2个共价键,则X为F元素、Y为C元素、W为O元素,以此来解答。
【详解】由上述分析可知,W为O元素、X为F元素、Y为C元素、Z为S元素、M为Al元素,
A.同周期,从左到右,元素的电负性逐渐增大,同主族从上到下,元素的电负性逐渐变小,则电负性F>O>S>C,故A错误;
B.O3的空间结构为V形,分子中正电荷中心和负电荷中心不重合,O3是极性分子,分子中含有极性键,故B正确;
C.同一周期中,随着核电荷数的增加,元素的第一电离呈现增大趋势,ⅡA族、ⅤA族反常,则元素第一电离能处在Al和S之间的有Si、Mg共2种,故C正确;
D.Y为C原子,价层电子对数是4,杂化方式为sp3,故D错误;
故选:BC。
15.D
【详解】
A.Cr原子的价层电子排布式为3d54s1,其价电子排布图为 ,A错误;
B.A点分数坐标为(0,0,0),根据坐标系,B点位于棱心上,则B点分数坐标为(,1,1),B错误;
C.以位于体心的Cr原子为例,距离原子最近的原子位于棱心,共有12个,C错误;
D.该晶胞中,位于顶点和面心的N原子个数为,位于体心和棱心的Cr原子个数为,则,解得nm,D正确;
故选D。
16.(1)C的电负性小于O,供电子能力强于O
(2)BD
(3)ACD
(4) [CoBr(NH3)5]SO4 [Co(SO4)(NH3)5]Br 生成淡黄色沉淀
【详解】(1)碳原子和氧原子都有孤电子对,但是O的电负性大于C,不易提供电子形成配位键,所以CO配位原子是碳原子而不是氧原子;
(2)A.CH3CN中N有孤电子对,C没有孤电子对,因此CH3CN与Mn原子配位时,提供孤电子对的是N原子,A错误;
B.该配合物中配体为5个CO和1个CH3CN,故Mn原子的配位数为6,B正确;
C.CH3CN中的甲基C为sp3杂化,—CN中的C为sp杂化,C错误;
D.CH3CN中单键全是σ键,三键中含一个σ键、两个π键,故CH3CN中σ键与π键数目之比为5∶2,D正确;
故选BD。
(3)[Al(OH)4]-中OH-和Al3+之间存在配位键,属于共价键,H、O之间形成共价键,也是极性键、σ键,故选ACD。
(4)由题意知,在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,配合物中外界离子能电离出来,而内界离子不能电离出来,说明在外界;在第二种配合物的溶液中加BaCl2溶液时,无明显现象,说明在内界,则第一种配合物可表示为[CoBr(NH3)5]SO4,第二种配合物可表示为[Co(SO4)(NH3)5]Br,第二种配合物中Br-在外界,若向其溶液中滴加AgNO3溶液,会生成淡黄色沉淀。
17.(1)C
(2)
(3)
(4)a
【详解】(1)B代表Pb2+;晶胞中A原子位于顶角,一个晶胞中A原子数目为8×=1,C原子位于晶胞面心,一个晶胞中C原子数目为6×=3,结合化学式(CH3NH3)PbI3可知,代表I-的为C,故答案为:C;
(2)原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),B为,与图可知,C原子为右侧面心,则C的原子分数坐标为,故答案为:;
(3)(CH3NH3)PbI3的摩尔质量为Mg·mol-1,晶胞质量为g;晶胞边长为apm,则晶胞体积为(apm)3=a3×10-30cm3,所以密度为g·cm-3,故答案为:;
(4)该晶胞沿体对角线方向的投影,体对角线方向的2个顶角A原子和体心B原子投到1个点,另外6个顶角A原子在平面上投出1个六边形,面心6个C原子在A投出六边形内部组成1个小六边形,故选a。
18. 第四周期第IB族 d C<O<N 氮的2p3为半满结构,较稳定 < BC BD 5
【分析】根据A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B为C元素;D原子L层上有2对成对电子,则D为C(舍去)或O元素;B、C、D的原子序数依次增大,则C为N元素;E+原子核外有3层电子且M层3d轨道电子全充满,则E为Cu元素,结合元素周期律分析解答。
【详解】(1)E为Cu元素,Cu在周期表中位于第4周期第IB族,属于d区;故答案为:第四周期第IB族;d;
(2)B、C、D三种元素分别是C、N、O元素,N的最外层为半充满结构,第一电离能最大,C的最小,第一电离能数值由小到大的顺序为C<O<N,故答案为:C<O<N;氮的2p3为半满结构,较稳定;
(3)D为O元素,电负性小于F;A.常温下氟气的颜色比D单质的颜色深属于物理性质,而电负性是化学性质,故A不选;B.氟气与D的氢化物剧烈反应,产生D的单质,说明氟气的氧化性比氧气强,说明氟的电负性大于氧,故B选;C.氟与D形成的化合物中D元素呈正价态,说明F得电子能力较强,电负性较大,故C选;D.单质与氢气化合时得电子的数目的多少与得电子的能力无关,故D不选;故答案为:<;BC;
(4)只含N、H两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,则其电子式为,含有离子键,铵根离子中含有极性键和配位键,不含非极性键和金属键,故答案为:;BD;
(5)C2H4为乙烯,1个C2H4分子中含有5个σ键,1个π键,因此1molC2H4分子中5molσ键,故答案为:5。
19.(1) ③④ ②③④
(2) C6H6 大于
(3) 平面三角形 四面体形 ClO
(4)SiCl4>SiH4>CH4
【分析】由A、B、C、D、E为短周期的非金属元素及s轨道最多可容纳2个电子,以及E所处的位置可知A的价层电子排布为,即A为H,B的价层电子排布为,则B为C,C的价层电子排布为,则C为O;由D与B同主族可知,D为Si;由E位于C的下一周期,且E是同周期元素中电负性最大的可知,E为Cl,据此解答。
【详解】(1)①、②、③、④分别为CO2、SiCl4、H2O、CH3Cl,其中H2O有两对孤对电子,CH3Cl中氯原子极性比H原子大,正负电荷中心不重合,为极性分子,其他均为非极性分子;CO2中C原子上的价层电子对数为,则CO2分子中C原子采取sp杂化,SiCl4中Si原子上的价层电子对数为,则SiCl4分子中Si原子采取sp3杂化,H2O分子中O原子上的价层电子对数为,故H2O中O原子采取sp3杂化,CH3Cl中C原子上的价层电子对数为,则CH3Cl中C原子采取sp3杂化,故答案为:③④;②③④;
(2)该溶剂为苯(C6H6),CCl4为非极性分子、水是极性分子,苯易溶于非极性溶剂CCl4中,相同条件下,该物质在CCl4中的溶解度大于其在H2O中的溶解度,故答案为:C6H6;大于;
(3)中Si原子的价层电子对数为,VSEPR模型名称为平面三角形,中Cl原子的价层电子对数为,VSEPR模型名称为四面体形;中Si原子上无孤电子对,中Cl原子上有孤电子对,则的VSEPR模型与空间结构不一致,故答案为:平面三角形;四面体形;;
(4)BA4、DA4、DE4分别为CH4、SiH4、SiCl4,三者都是由分子构成的物质,其结构相似,相对分子质量越大,范德华力越大,熔沸点越高,故它们的沸点由高到低的顺序为SiCl4>SiH4>CH4,故答案为:SiCl4>SiH4>CH4。
答案第1页,共2页
答案第1页,共2页
同课章节目录
